星形胶质细胞在凝胶环境下的三维培养
2022-05-06李挚雯刘志成钱秀清
李挚雯,刘志成,钱秀清
1.首都医科大学生物医学工程学院,北京100069;2.临床生物力学应用基础研究北京市重点实验室,北京100069
前言
青光眼是以视网膜神经节细胞凋亡、视乳头萎缩及凹陷、进行性视野缺损为共同特征的神经退行性疾病[1]。病理性眼压(Intraocular Pressure,IOP)升高是青光眼发病的主要危险因素[2]。目前普遍认为青光眼视网膜神经节细胞发生损伤进而凋亡的起始部位在视乳头筛板处[3-4]。星形胶质细胞是视乳头部位最常见的细胞类型,对视乳头具有支持及营养的功能。研究发现视乳头星形胶质细胞在青光眼视神经损害的发生、发展中起着至关重要的作用[5]。眼压升高时,星形胶质细胞的活化往往发生在视神经轴突损伤之前[6]。因此,研究压力作用下视乳头星形胶质细胞的力学生物学响应具有重要意义。然而,传统二维环境下的体外培养不能为细胞提供足够的生化和生理刺激[7],主要原因在于二维基质机械性能的差异以及细胞缺乏与细胞外基质之间的相互作用[8]。有研究证明三维培养能提高细胞体外培养的生理相关性[9-10]。本研究尝试建立一个与视乳头力学特性相似的三维细胞培养系统,模拟星形胶质细胞的在体生长环境;同时,该三维细胞培养系统具有足够的刚度,便于不同压力的加载。
水凝胶在生物医学领域具有广泛的应用,近年来人们对使用水凝胶构建体外三维凝胶环境培养细胞、研究细胞的力学生物学响应产生了浓厚的兴趣[11-12]。以往的研究在利用琼脂糖凝胶对成骨细胞和软骨细胞的力学加载中发现,琼脂糖的刚度随凝胶浓度增加,并影响力学作用下细胞的位移和变形[13-14];同时,软骨细胞在琼脂糖凝胶中受到机械刺激后会发生蛋白表达的变化[15]。以往对于星形胶质细胞凝胶环境的构建多基于胶原蛋白凝胶[16-17]以及胶原蛋白和透明质酸制成的光交联水凝胶[18]。结合之前的文献,测得的胶原蛋白凝胶的弹性模量仅为20~200 Pa[19],不能用作星形胶质细胞承受压力载荷的介质。因此,本研究尝试运用不同浓度的琼脂糖凝胶系统模拟细胞的三维微环境,从而为下一步探究压力作用下星形胶质细胞的力学生物学响应提供基础。
1 材料和方法
1.1 材料及试剂
SD大鼠(出生2~3周)视乳头星形胶质细胞(普诺赛,中国武汉);DMEM/F-12(1:1)培养基(Hyclone,美国);胎牛血清(Fetal Bovine Serum,FBS;Gibco,美国);青霉素和链霉素(Penicillin-streptomycin;Hyclone,美国);含有EDTA的胰酶(Trypsin 0.25%);磷酸盐缓冲液(Phosphate Buffered Saline,PBS;Hyclone,美国);低熔点琼脂糖(索莱宝,中国北京);Tris硼酸缓冲液(TBE,普利莱,中国北京);水温计;生物纳米压痕仪Piuma Nanoindenter(Opitics 11,荷兰);STED超高分辨率共聚焦显微镜(TCS SP8 STED,Leica,德国);Calcein AM/PI双染试剂盒(百奥莱博,中国北京);Hank's平衡盐溶液(Hank's Balanced Salt Solution,HBSS;索莱宝,中国北京);抗荧光衰减封片剂(索莱宝,中国北京);4%多聚甲醛(碧云天,中国上海);鬼笔环肽(Phalloidin-iFluor 488 Reagent,Abcam,美国)。
1.2 凝胶的准备与力学特性的测试
使用不同浓度的琼脂糖凝胶模拟星形胶质细胞的细胞外基质环境。将低熔点琼脂糖粉末与TBE 溶液混合,高温煮沸后得到凝胶质量浓度分别为1%、2%、3%(w/v)的低熔点琼脂糖凝胶。
利用纳米压痕仪Piuma Nanoindenter(Opitics 11,荷兰)测得凝胶的力学特性。将不同浓度的凝胶置于半径为20 mm 的培养皿中,选择悬臂弹簧常数为0.44 N/m、半径为101 μm 的球形探针进行压痕实验。首先探针从原点以10 μm/s 的速度进行加载,直至压入深度约为10 μm 时停止,获得压痕曲线的加载段;在压入深度约10 μm 处静置1 s,再以10 μm/s 的速度进行卸载,回到原点,获得压痕曲线的卸载段。获得载荷-位移曲线后,使用赫兹模型拟合曲线获得弹性模量[20-21]。凝胶每组3 个样本,每个样本随机选取3个点进行测试(n=9),取平均值作为测试结果。
1.3 细胞在凝胶中的培养
对购买的SD 大鼠(出生2~3周)视乳头星形胶质细胞(普诺赛,中国武汉),通过特异性标志蛋白的免疫荧光化学染色的方式进行细胞鉴定。
视乳头星形胶质细胞被胰蛋白酶消化,计数,重悬,并在37 ℃下与凝胶混合均匀,控制细胞密度在1×106个/mL。将凝胶转移至直径为15 mm 的共聚焦皿中,并加入1 mL 的DMEM/F12(10% FBS,1%双抗),置于37 ℃,5%CO2细胞培养箱内培养。每3 天换液,分别于体外培养的第1、3、5 和7 天进行细胞活性检测和细胞骨架观察。
1.4 细胞活性的检测
为评估三维凝胶系统体外细胞培养的可行性,使用标准方法评估星形胶质细胞的活性。利用Calcein AM/PI 双染试剂盒中染料稀释剂将Calcein AM 染色液和PI染色液稀释10倍,之后用HBSS溶液将Calcein AM 染色液和PI 染色液分别稀释至1 000倍和2 000 倍。凝胶在共聚焦皿中用PBS 清洗2~3次,加入150 μL 稀释1 000 倍的Calcein AM 染色液,37 ℃避光孵育30 min。用PBS 洗涤细胞后,加入150 μL稀释2 000倍的PI染色液,37 ℃避光孵育25 min,用PBS洗涤后,滴加抗荧光淬灭剂封片。
用STED 超高分辨率共聚焦显微镜(TCS SP8 STED,Leica,德国)选用20倍干镜对凝胶染色情况进行观察,拍照。使用488 nm 波长激发,活细胞为黄绿色;用545 nm 波长激发,死细胞为红色。从每个水凝胶的3 个位置获取共聚焦图像,扫描深度100 μm,扫描间隔为5 μm,并对结果进行叠加;最后用Image J对得到的图像进行阈值处理,对存活和死亡细胞的数量进行量化,从而得到细胞活性。
1.5 细胞骨架的观察
用PBS清洗凝胶3次,加入4%的多聚甲醛200 μL在室温固定30 min。吸出固定液,用PBS清洗固定的细胞3次。加入0.1%的Triton X-100(PBS配置)室温通透5 min,用PBS 清洗细胞3 次。每个孔中加入150 μL 鬼笔环肽染色液,在室温下孵育细胞90 min。用PBS 轻轻地冲洗细胞3 次,滴加抗荧光淬灭剂封片。使用STED 超高分辨率共聚焦显微镜在皿中任意选取3 个位置,选用40 倍油镜对凝胶染色情况进行观察,拍照。荧光激发波长为493 nm,发射波长为517 nm。
1.6 统计学分析
数据采用均数±标准差表示,所有数据分析采用SPSS统计学软件处理。各组组间差异性采用单因素方差分析进行比较;通过Bonferroni 事后检验确定显著性差异,P<0.05认为差异具有统计学意义。
2 结果
2.1 凝胶力学特性测试结果
使用Origin(OriginPro 2021, Originlab)软件拟合载荷-位移加载曲线,黑色数据点组成的曲线为压入载荷-压入深度加载段原始曲线,红色曲线为通过Hertz 公式计算的拟合曲线(图1a~c),曲线的平均拟合优度R2为0.996±0.002。结果显示,1%、2%、3%琼脂糖凝胶的杨氏模量分别为(2.99±0.59)、(25.42±3.89)、(64.03±9.94)kPa(图1d)。3 种凝胶浓度中任意两组间均具有统计学差异(**P<0.01)。随着琼脂糖浓度的增加,凝胶弹性模量逐渐增加,2%的琼脂糖凝胶的弹性模量最接近筛板组织的弹性模量[22-24]。
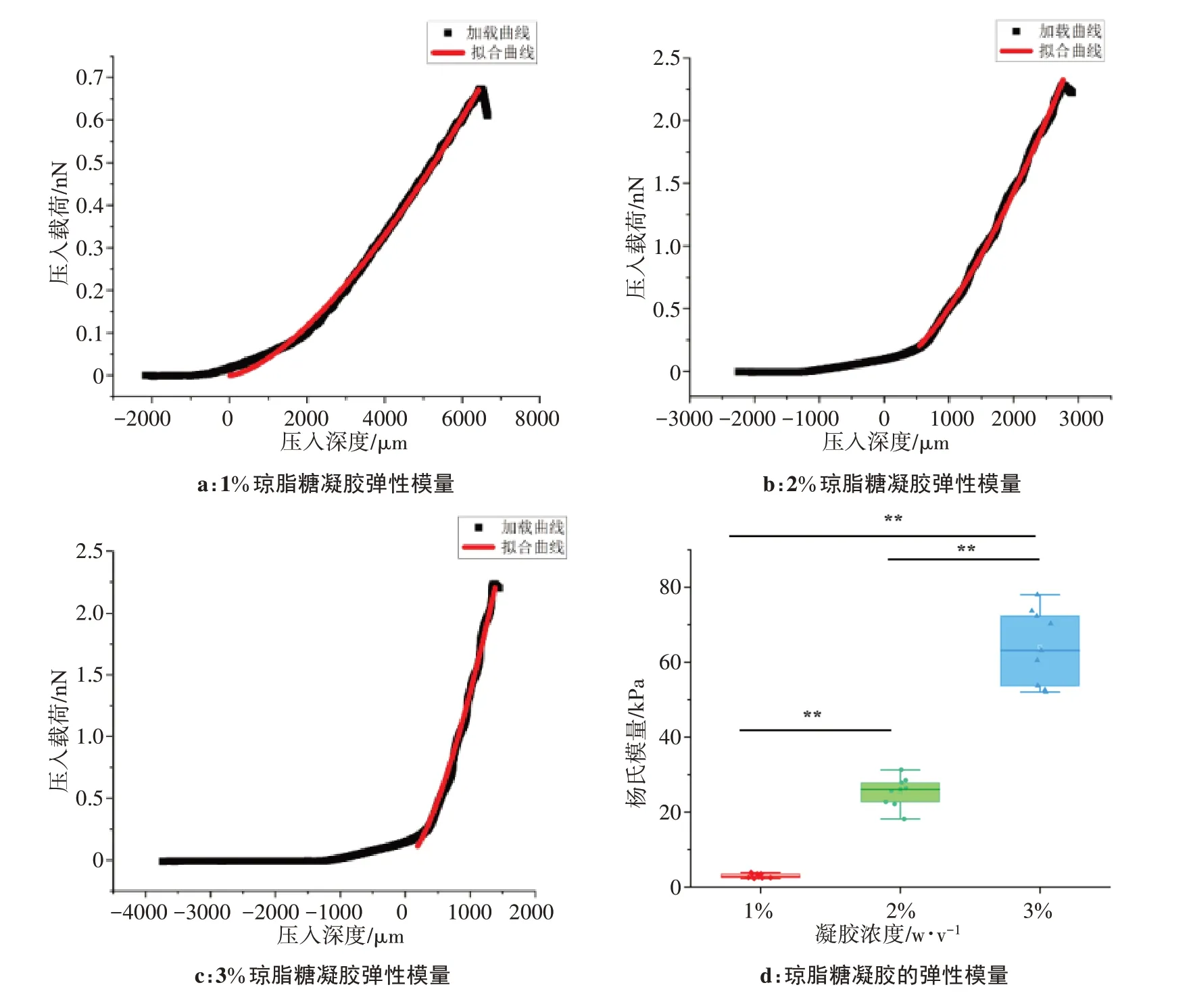
图1 琼脂糖凝胶力学特性Figure 1 Mechanical properties of agarose gels
2.2 星形胶质细胞鉴定结果
对星形胶质细胞特异性标志蛋白的免疫荧光化学染色见图2,绿色荧光为星形胶质细胞表达胶质纤维酸性蛋白,蓝色荧光为DAPI 所染细胞核。阳性细胞数占90%以上,即细胞纯度达90%以上,所购细胞为星形胶质细胞。
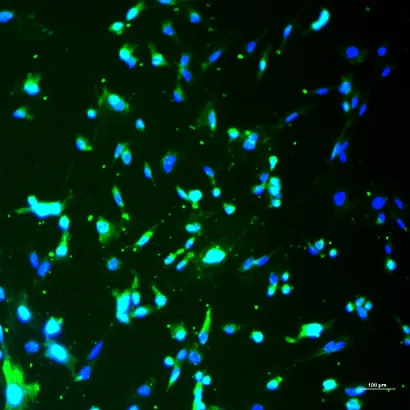
图2 星形胶质细胞免疫荧光图像Figure 2 Immunofluorescence image of astrocytes
2.3 细胞活性检测结果
分别对在不同浓度的凝胶中培养1、3、5、7 d 的细胞成活率进行观察,发现细胞在2%和3%琼脂糖凝胶中成活率分别在第1 天和第3 天达到最高(图3a、b)。其中生长在2%琼脂糖凝胶中细胞的成活率随培养时间的增加而减少。生长在1%琼脂糖凝胶中的细胞,在1、3、5 d细胞成活率均低于2%、3%凝胶环境下生长的细胞。培养1 d,2%凝胶成活率较1%的差异具有统计学意义(*P<0.05)。培养3 d,2%凝胶成活率较3%的差异具有统计学意义(*P<0.05),1%凝胶成活率较3%的差异具有统计学意义(**P<0.01)。培养5、7 d,不同凝胶浓度间,细胞成活率均没有显著性差异,可以推测在一定时间之后细胞在不同凝胶中生长无显著性差异。综上所述,这几种浓度的凝胶均能实现细胞存活,其中细胞在2%、3%浓度的琼脂糖凝胶中细胞成活率较1%浓度的琼脂糖凝胶更好。
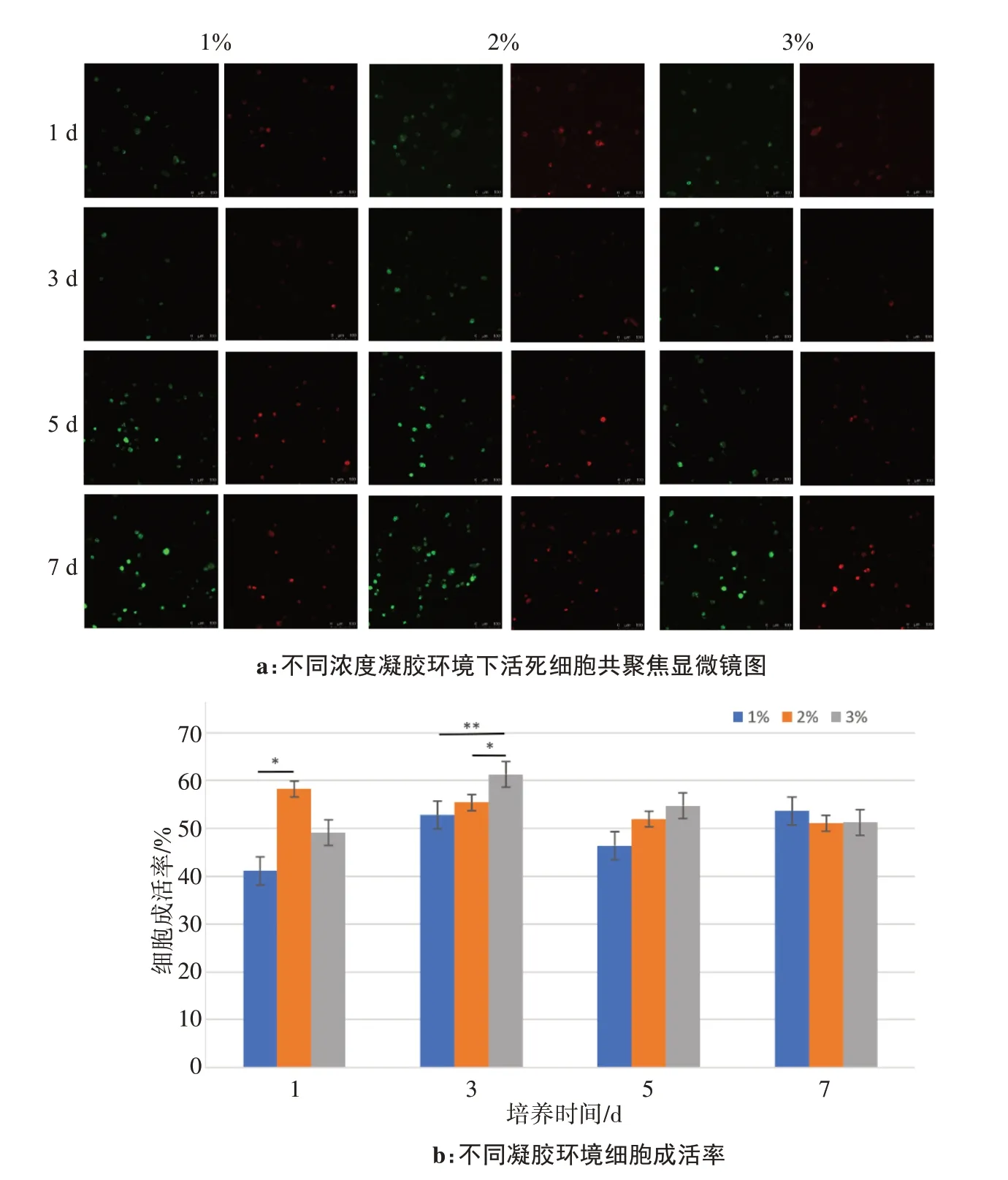
图3 不同浓度凝胶细胞成活率的变化Figure 3 Changes in the viability of cells cultured in different concentrations of gels
2.4 细胞骨架
通过对在不同琼脂糖浓度下培养细胞的细胞骨架观察发现,随着细胞在凝胶中培养的时间增加,星形胶质细胞的突起逐渐伸出,细胞从大多数的球形向梭形或星形转变(图4),在不同的浓度的凝胶环境下均有变化,说明细胞在凝胶中可以正常生长,并且更接近正常的生长状态(图5)。
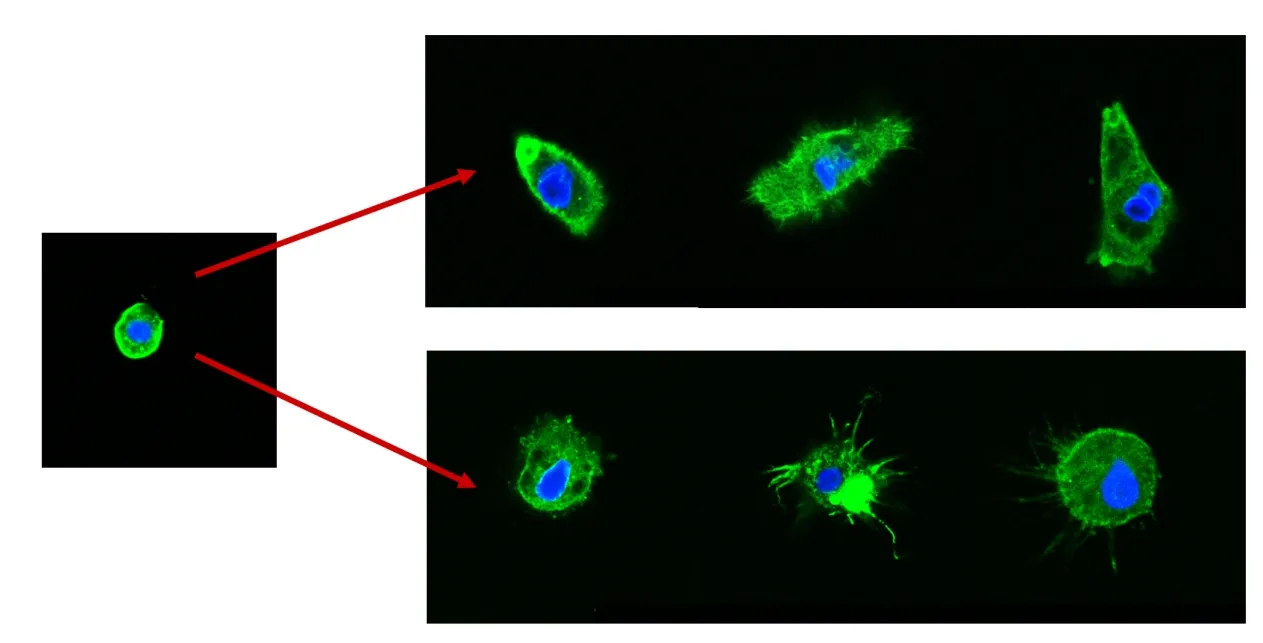
图4 典型细胞骨架变化Figure 4 Typical cytoskeleton changes
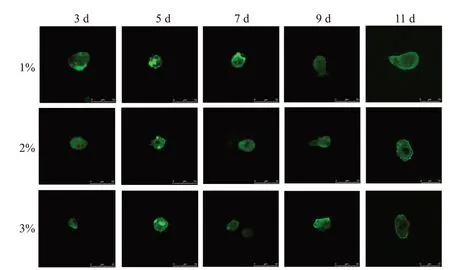
图5 不同浓度凝胶中细胞骨架的变化Figure 5 Changes of cytoskeleton in different concentrations of gels
3 讨论
高眼压作用会导致视乳头区星形胶质细胞活化[6],而星形胶质细胞在体内的生长环境由弹性模量为10~17 kPa 的筛板和视网膜神经节细胞轴突构成[22]。了解星形胶质细胞的力学环境对理解星形胶质细胞的活化具有重要的意义。为研究压力作用下视乳头星形胶质细胞的力学生物学响应,需要建立一个与视乳头力学特性相似的三维细胞培养系统。有研究使用I型胶原蛋白凝胶[16-17]以及胶原蛋白和透明质酸制成的光交联水凝胶[18]进行星形胶质细胞的体外培养,然而胶原蛋白凝胶的弹性模量仅为20~200 Pa[19],不能用于研究压力作用下星形胶质细胞的力学生物学响应。琼脂糖凝胶的弹性模量范围大(1~200 kPa)[25],通过调节琼脂糖凝胶的浓度可模拟最接近星形胶质细胞生长的三维凝胶环境。
本研究通过对不同浓度凝胶力学特性进行测试,以期寻找到最接近星形胶质细胞在体生长的凝胶环境;并通过对细胞活性以及形态评估星形胶质细胞在凝胶中生存的可行性。研究发现2%琼脂糖凝胶力学特性最接近星形胶质细胞在体内的生长环境,且细胞成活率较高,是星形胶质细胞体外三维培养的理想环境。然而,2%和3%琼脂糖凝胶中的细胞成活率随培养时间的变化存在波动,可能的原因在于本实验随机选取的测量位置存在误差。之后的实验会增加测量位置及测量次数,从而探究凝胶不同位置细胞成活率的一致性和准确性。同时,细胞接种密度可能会导致凝胶弹性模量的改变,将进一步探究不同细胞接种密度与凝胶弹性模量的影响。
本研究建立了星形胶质细胞体外三维培养系统,未来将基于此系统,在体外环境下模拟星形胶质细胞的在体生长环境探究星形胶质细胞的力学生物学响应[26],从而研究青光眼发病过程中的力学敏感蛋白和力学信号传导通路,为青光眼早期诊断寻找新思路。