绿原酸对烟草疫霉的抑制作用及对烟草黑胫病的防治效果研究
2022-05-05张豫丹马晓寒李俊领许自成石秋环
张豫丹 马晓寒 李俊领 许自成 贾 玮 石秋环
(1河南农业大学烟草学院,450002,河南郑州;2河南省烟草公司洛阳市公司,471003,河南洛阳)
烟草黑胫病(tobacco black shank,TBS)俗称烟草疫病,由寄生烟草疫霉菌(Phytophthora nicotianae)引起,属于世界性烟草病害,也是我国烟草最严重的病害之一,在各个烟区均有发生[1-3]。烟草疫霉菌是典型的土传病原真菌,以菌丝或厚垣孢子的形式长期寄生在植物病残体或土壤中,可存活数年[4]。一旦遇到适宜的生长条件,便会萌发并释放出大量的游动孢子,并通过植物气孔和伤口等侵入到烟株的根、茎、叶等部位[3]。目前,TBS的防治手段主要包括农业防治、化学防治、抗病育种和生物防治。单一化学农药的长期过度施用会导致病原菌抗性增强和污染残留严重,且破坏土壤微生态,导致烟叶农药残留超标,影响烟叶安全性;生物防治持效期较短且成本过高,且至今尚未寻找到完全抗TBS的烟草品种[5]。因此,亟需开发防治TBS的有效、生态和绿色的措施。
绿原酸(chlorogenic acid,CGA)是由咖啡酸和奎尼酸缩合而成的一种苯丙素类物质,广泛存在于自然界中。因其具有抗氧化、抗菌和清除自由基等多种生物活性,且安全、天然、造价低,日益成为食品和医药等领域的研究热点之一。大量研究表明,CGA具有广谱抗真菌和细菌活性[6-9],且在增强植物抗病性方面发挥着重要的作用[10-11]。目前,有关CGA在烟草疫霉抑菌及TBS防治方面的应用鲜有报道。本文以离体培养的方式研究CGA对烟草疫霉的抑制作用,采用叶面喷施CGA来研究其对TBS的防治效果,为开发新型植物杀菌剂提供参考。
1 材料与方法
1.1 试验材料
试验所用烟草疫霉为实验室保存菌种,用燕麦琼脂培养基(简称OA培养基)在26℃下培养1周左右后于4℃冰箱保存待用。供试烟草品种为K326。纯品 CGA购于北京索莱宝科技有限公司。试验于2020年12月在河南农业大学品质生态实验室进行。
1.2 试验方法
1.2.1 OA培养基及含药培养基的制备 将30g燕麦加纯水煮烂(煮沸25min左右,燕麦微微膨胀裂开),用 4层纱布过滤于烧杯中,用去离子水补充至1000mL,加入准确称量的15g琼脂,搅拌完全后,分装于三角瓶中,在121℃、0.1MPa条件下灭菌25min。冷却至60℃后,取15mL灭菌培养基分别加入50和100µg/mL CGA,分别记为CGA1和CGA2,用磁力搅拌器混匀后,倒入培养皿中,冷却至室温备用。以不添加CGA为对照(CK)处理。
1.2.2 抑菌活性的测定 用打孔器在培养 5~7d的OA培养基的等直径菌落边缘(菌丝长势一致)打取直径为5mm的圆形疫霉菌饼,后用无菌接种针挑至平板中间,用封口膜密封好,试验中所用器具均为无菌器具,试验全程在超净台酒精灯火焰旁进行。将接种好的平板置于26℃培养箱中恒温培养。待对照组平板长满菌丝后,采用十字交叉法测定菌落直径,并计算抑菌率,每个处理重复3次。抑菌率(%)=(对照组菌落直径−试验组菌落直径)/对照组直径×100。
1.2.3 扫描电镜样品的制备 选用培养6~7d的培养基,取培养基中长势均匀一致的菌落,切下厚约20mm、长约50mm的正方形菌块,观察面尽可能保持平整,用双面胶粘在扫描电镜样品台上,抽真空后,将样品置于扫描电镜(日立SU3500)上进行观察。
1.2.4 菌丝 PI染色 用无菌刮刀在长势均匀的对照平板和试验平板(100µg/mL)中分别刮取适量菌丝,在10%的福尔马林溶液中浸泡固定1h后用PBS缓冲液反复冲洗数次,滴加 20µg/mL的 PI染液200mL,置于暗处30min,将带有菌落的滴液置于荧光显微镜下进行观察并拍照。
1.2.5 离体烟叶侵染试验 取长势一致的烟草幼苗自下而上第2片真叶进行离体侵染。用无菌刀避开叶脉十字划伤叶片,接种5mm的圆形菌饼进行侵染,覆盖浸湿无菌水的脱脂棉并用保鲜膜保湿。将侵染后的离体烟叶置于均匀铺满脱脂棉和纱布的培养盒中,培养盒上方覆保鲜膜保湿。对照组每天喷施3次无菌水,试验组每天喷施3次100µg/mL CGA溶液,共喷施3d,每组处理包含6片烟叶。
1.2.6 离体烟叶台盼蓝染色 将侵染3d后的离体烟叶用台盼蓝溶液在常温下染色40min,之后用75%乙醇进行脱色,每2~3h更换1次脱色液,直至叶片脱去绿色。
1.2.7 烟株侵染试验 待烟苗在基质中长至4~5片真叶时,选取长势一致的幼苗进行处理。根据前期试验结果设置对照组和试验组,每组3株烟苗。
在烟株真叶上用无菌刀避开叶脉十字划伤叶片,打取5mm的圆形菌饼,用脱脂棉浸湿无菌水覆于菌饼上,再用保鲜膜覆盖脱脂棉,完成接种。对照组每天揭开脱脂棉喷施纯水3次,试验组每天喷施100µg/mL CGA溶液3次,共喷施5d。
1.2.8 烟株生理特征 称取0.5g 1.2.7中处理的烟叶样品,加入5mL pH为7.8的磷酸缓冲溶液进行冰浴研磨,低温离心20min,取上清液(酶液)于4℃冰箱保存,用于测定过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)的活性[12]。
POD活性:反应液为0.1mol/L、pH 6.0的磷酸缓冲液50mL,置于烧杯中,加入愈创木酚28µL,磁力搅拌器加热搅拌至完全溶解,冷却后加入30%过氧化氢(H2O2)19µL混合。酶液20µL,加入反应液5mL于比色皿中,470nm下每隔1min读数一次,共读3次,以每分钟吸光度变化值表示酶活力大小。
SOD活性:取同样型号试管,吸取酶液20µL,加入反应液3mL,4000lx照光30min,取2支对照空白试管以缓冲液代替酶液,空白置于暗处,对照和酶液同置于4000lx条件下照光30min,再遮光保存,以空白调零,测560nm处吸光值。
CAT活性:反应液体系包含0.1mol/L H2O25mL和0.1mol/L、pH 7.0的缓冲液20mL。取0.1mL酶液加入到2.5mL反应液中,测240nm处吸光值。
采用ELISA试剂盒测定多酚氧化酶(PPO)活性;采用考马斯亮蓝(G-250)比色法测定烟叶中的可溶性蛋白含量;采用蒽酮法测定烟叶中可溶性糖含量;采用茚三酮法测定游离脯氨酸含量[13]。
可溶性蛋白含量:0.1g G-250反应液溶于90%乙醇50mL中,加入85%磷酸100mL,定容至1000mL,过滤至棕色瓶中。取上述酶液20µL和反应液3mL于常温自然光放置2min,测595nm处吸光值。
可溶性糖含量:取0.5g烟叶,剪碎后置于研钵中,加蒸馏水1mL,研磨成匀浆,分2次各加蒸馏水2mL洗涤研钵,置于沸水浴中加盖煮沸10min,冷却后过滤,滤液收集到50mL容量瓶中,蒸馏水定容后,即为提取液。用移液管吸取提取液1mL和蒽酮0.5mL于25mL的大试管中,再加入浓硫酸5mL,轻轻摇匀,置于沸水浴10min。冷却至室温后于620nm下比色。
脯氨酸含量:取烟叶0.5g加3%磺基水杨酸5mL,沸水浴提取10min,冷却至室温,即为提取液。提取液2mL加入到含有2mL酸性茚三酮和2mL冰乙醇的试管中,沸水浴40min,溶液呈现红色,冷却后加甲苯5mL,摇匀后静置10min,取上清滴至10mL离心管中,3000转/min下离心5min。用吸管吸取上层红色甲苯溶液于比色皿中,以甲苯为空白对照,520nm波长下测量吸光值。
1.3 数据处理
采用SPSS 20中Duncan多重比较进行单因素方差分析(ANOVA)(P<0.05),采用 Excel进行作图。
2 结果与分析
2.1 不同浓度CGA对烟草疫霉菌径向生长的抑制
由表1和图1可知,CGA显著抑制烟草疫霉的生长,同时抑制作用随CGA浓度的增加而增强,且各处理间差异显著。CGA1处理下烟草疫霉菌径向生长已经受到了显著的抑制,抑菌率为 8.2%。CGA2处理下,菌落直径从CK处理的7.51cm减小到5.95cm,抑菌率高达20.8%。
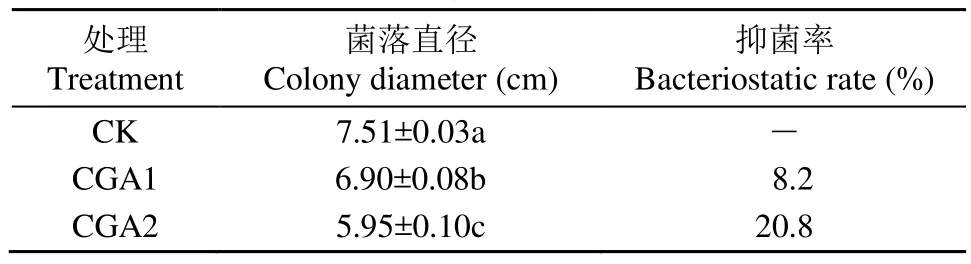
表1 不同浓度CGA对烟草疫霉菌径向生长的抑制Table 1 Effects of different concentrations of CGA on radial growth of P. nicotianae
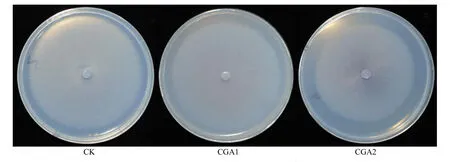
图1 不同浓度CGA对烟草疫霉菌径向生长的抑制Fig.1 Effects of different concentrations of CGA on radial growth of P. nicotianae
2.2 CGA2处理后烟草疫霉菌丝的形态变化
根据上述试验结果,为了明确CGA对烟草疫霉的抑制作用,选择100µg/mL的CGA与CK进行菌丝形态对比分析。由图2可知,与CK处理相比,CGA2处理的烟草疫霉菌菌丝发生了明显的形态变化。CK处理的菌丝密集且完整,生长十分规则,CGA2处理的菌丝量明显减少,排列无序杂乱,菌丝有多处断裂,部分菌丝异常生长,产生小的结节。

图2 CGA2处理对烟草疫霉菌丝形态的影响Fig.2 Effects of CGA2 treatment on morphology of P. nicotianae
2.3 CGA2处理后烟草疫霉菌丝PI染色结果
荧光染料PI是一种细胞核染色剂,能对DNA进行染色。鲜活的细胞膜能够阻止PI进入细胞内,进而避免对DNA染色。破损的细胞膜则无法阻止其与胞内DNA的特异结合,形成红色荧光。如图3所示,在普通光场下,CK处理的烟草疫霉菌丝形态饱满圆润,表面较为光滑,菌丝量大且较为完整,CGA2处理后的烟草疫霉菌丝变得细小干瘪,有多处断裂。在荧光光场下,CK处理的菌丝视野内仅有少量轻微泛红,而CGA2处理后的菌丝视野内几乎整体变红,证明经CGA2处理后,烟草疫霉菌菌丝胞膜破裂严重,导致PI染料大量与胞内DNA进行特异结合,使视野内呈现出大量红色荧光。
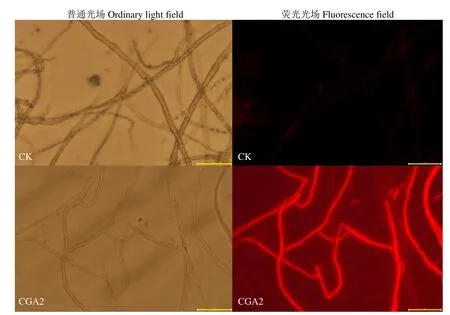
图3 CGA2处理对烟草疫霉菌丝细胞的影响Fig.3 Effects of CGA2 treatment on cell of P. nicotianae
2.4 离体烟叶侵染结果
如图4所示,侵染3d后,CK处理的烟叶染病严重,病斑蔓延至主脉,并通过主脉扩散至支脉,而CGA2处理的烟叶侵染面积显著小于CK处理的烟叶,在侵染相同时间后,病斑尚未蔓延至主脉。

图4 离体烟叶侵染结果Fig.4 Infection results of isolated tobacco leaves
台盼蓝是一种用于标记死细胞的染料,可用于检测细胞膜的完整性,活细胞不会被染成蓝色[14]。图5中经台盼蓝染色后的CK处理呈现出面积较大的深蓝色,而CGA2处理的烟叶则仅有小面积被染色,证明喷施CGA后烟叶细胞膜完整性较好,细胞死亡较少,CGA对感染疫霉菌的离体烟叶有较好的保护作用。

图5 台盼蓝染色结果Fig.5 The results of trypan blue staining
2.5 烟株侵染结果
如图6所示,CK处理的烟叶已经发黄萎蔫,接种的叶片全部感染TBS,且感染面积大,感染程度深,而CGA2处理的烟叶仅接种处小面积感染,叶片未发生萎蔫。CGA2处理后,病斑平均面积由4.6个单位下降到1.2个单位,下降7%(图7)。经t检验分析,CGA2处理后病斑大小与CK处理差异显著。表明叶片喷施CGA可显著抑制病原真菌的扩散,能有效缓解TBS对烟苗造成的损伤。

图6 烟株侵染结果Fig.6 The results of P. nicotianae infection
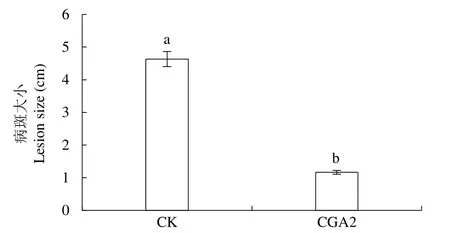
图7 喷施CGA对烟叶病斑大小的影响Fig.7 Effects of CGA foliar application on the lesion size in tobacco leaves
2.6 CGA对接种疫霉菌后烟草抗性相关酶活力的影响
如图8所示,CGA2和CK处理抗性相关酶活性都有显著差异。其中,CGA2处理的POD活性显著高于CK处理,较CK处理升高72.6%(图8a);CGA2处理的SOD活性显著上升54.6%(图8b);CGA2处理的CAT活性上升最多,达到155.8%(图8c);CGA2处理的 PPO活性也显著上升了 8.2%(图8d)。由此证明,CGA能够显著提高侵染后烟草幼苗中的POD、SOD、CAT和PPO等相关抗性酶活性,从而提高烟苗抵御疫霉菌侵害的能力。
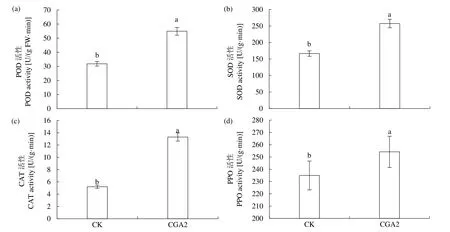
图8 CGA对接种疫霉菌后烟草叶片酶活力的影响Fig.8 Effects of CGA on the enzymes activities in tobacco leaves inoculated with P. nicotianae
2.7 CGA对接种疫霉菌后烟草中可溶性蛋白、可溶性糖以及脯氨酸含量的影响
由图9可知,在CGA的影响下,烟草幼苗中的可溶性蛋白、可溶性糖和脯氨酸含量也表现出了显著的差异。图9a中,CGA2处理的可溶性蛋白含量由CK处理的3.0mg/g上升到5.3mg/g,显著上升76.4%。CGA2处理可溶性糖和脯氨酸含量则有不同程度的下降,可溶性糖含量由CK处理的2.7mg/g降到1.5mg/g,显著下降42.9%(图9b);脯氨酸含量也从CK处理的192.7µg/g下降到150.4µg/g,显著降低22.0%(图9c)。
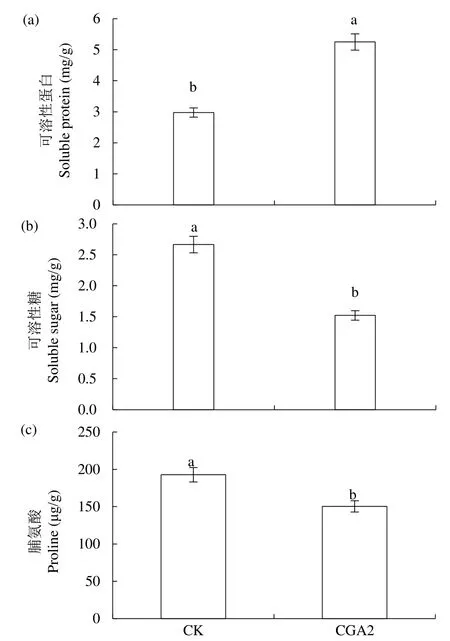
图9 CGA对接种疫霉菌后烟草可溶性糖、可溶性蛋白和脯氨酸含量的影响Fig.9 Effects of CGA on soluble sugar, soluble protein and proline contents in tobacco leaves inoculated with P. nicotianae
3 讨论
CGA是一种天然、安全的酚类物质,具有良好的抑菌活性。本研究表明,离体条件下 100μg/mL CGA可显著抑制烟草疫霉的生长,菌丝形态结构干瘪,部分菌丝发生断裂,大量细胞死亡,这与陈娟妮等[15]关于纳米氧化锌对烟草疫霉菌菌丝生长的抑制作用研究结果基本一致。
在抑菌活性的研究基础上,为进一步确定 CGA对TBS的防治效果,采用抑菌效果更好的100μg/mL CGA溶液喷施叶片,结果表明,无论是离体叶片还是活体植株,喷施CGA均可显著降低叶片的病斑大小。
植物在遭受病原菌侵染后,往往伴随着活性氧的爆发,造成植株的氧化损伤[16]。抗氧化酶POD、SOD和CAT等主要用于清除有机体内过多的活性氧,减轻细胞膜脂质过氧化程度。本研究中,外源CGA的施用显著提高了烟叶中POD、SOD和CAT的活性,将有助于减少烟叶内由烟草疫霉侵染带来的活性氧累积,保护叶片免受氧化损伤,这与开凯[17]在CGA对猕猴桃和樱桃番茄采后病原菌抑制作用研究中POD、SOD和CAT活性变化基本一致。PPO是参与植物抗病代谢的关键酶,其活性可直接反映植物的抗病能力[18]。施用外源 CGA后,烟叶PPO活性显著提高,表明烟叶的抗病性有所提高,这与张钰等[19]研究中PPO活性增加有助于增强杨树抗溃疡病能力的结论一致。
可溶性蛋白是了解植物总代谢的一个重要指标,CGA处理后的烟叶可溶性蛋白含量增加,很可能是出现了新的病程相关蛋白[20]。糖分在植物防御反应中占据着重要地位。本研究表明,CGA2处理后病烟叶中可溶性糖含量显著降低,推测植物体内低糖含量有利于植物抗病。与此类似,赵芳等[21]的研究也表明可溶性糖含量与烟草赤星病的病情指数呈显著负相关。
脯氨酸是植物细胞中重要的渗透调节物质,可以清除细胞内活性氧以维持膜结构的稳定性,较高的脯氨酸含量有利于提高植物的抗逆性[22]。本研究中CGA2处理的烟叶脯氨酸含量反而降低,这可能是由于喷施CGA,严重阻碍了烟草疫霉的侵染,使得烟株本身不需要产生更多的脯氨酸抵御烟草疫霉的入侵。
4 结论
CGA能显著抑制烟草疫霉的生长,且随浓度的增加,抑制作用增强。喷施100µg/mL CGA溶液可显著降低烟叶病斑大小,明显提高抗氧化酶及抗病相关酶活,且影响烟叶细胞的内含物含量。由此可见,CGA不仅能够直接抑制烟草疫霉的生长,也有助于提高烟草抵抗TBS的能力,有较大潜力发展成为防治TBS的安全杀菌剂。
