血清β-Amyloid水平在膝骨关节炎发生评估中的应用价值
2022-04-30徐羽谢奇朋陈少敏叶涵涛李飞达水小龙
徐羽,谢奇朋,陈少敏,叶涵涛,李飞达,水小龙
温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.骨科;2.检验科;3.康复科
膝骨关节炎(knee osteoarthritis, KOA)作为一种常见的慢性退行性疾病,其主要特点为关节软骨损伤、软骨下骨破坏、滑膜炎症、骨赘增生。KOA患者临床上常表现为关节疼痛、僵硬、弹响和功能障碍,患者的日常生活、工作和活动深受影响。OA的进展取决于由于机械负荷和炎症增加导致的软骨破坏[1]。软骨内软骨细胞的损伤能够释放与损伤相关的分子模式(damage associated molecular patterns, DAMPs)[2]。一般认为原发性骨关节炎是多种致病因素包括机械性和生物性因素的相互作用所致。由于发病机制与病因太过复杂和不明确,目前为止影像学改变是KOA早期发现和诊断的主要方法,但只有当患者局部软骨组织出现不可逆转的损伤时经X线检查才会发现,因此影像学诊断缺乏特异性及敏感性[3]。目前尚缺乏有效逆转和阻断KOA进展的方法,探寻出一种可以用于早期诊断KOA的方法并采取有效的治疗措施是我们应该努力的方向。本研究主要探讨损伤相关的分子模式在KOA的诊断、进展及预后判断中的作用。
1 资料和方法
1.1 一般资料 从2020年10月1日至2021年1月1日在温州医科大学附属第二医院育英儿童医院住院的患者中选取经全膝关节置换或膝关节镜手术治疗的KOA患者56例(试验组),所有试验组患者均符合由中华医学会各科学分会制定的KOA的诊断标准,同时至少有一侧膝关节符合KOA的放射性诊断标准,见表1。纳入标准:①确诊为KOA并在本院行膝关节置换或膝关节镜清理者;②根据Kellgren-Lawrence(K-L)分级为2~4级者;③受试者签署知情同意书。

表1 KOA的诊断标准
排除标准:①严重的糖尿病;②类风湿关节炎;③创伤性关节炎;④近90 d内有关节药物注射史;⑤近90 d内有止痛药物服用史;⑥其他类型的骨关节病;⑦有糖皮质激素药物服用史;⑧系统性感染性疾病;⑨自体免疫紊乱性疾病;⑩恶性、慢性疾病。随机选取25例于2020年10月1日至2021年1月1日期间在温州医科大学附属第二医院育英儿童医院住院的体质量指数(body mass index, BMI)与试验组匹配的非KOA患者为对照组。研究经本院医学伦理委员会审核(编号:LCKY2019-34)。
1.2 K-L分级方法 K-L分级标准见表2。

表2 K-L分级标准
1.3 样本采集和测量方法 常规静脉采血约5 mL,置含分离胶的橙色盖真空采血管内,2 h内转运至实验室,接收标本后在30 min内将标本离心(3 500 r/min,10 min)分离为血清和细胞组分,将血清分装至洁净EP管,全过程严格控制,避免溶血。
采用双抗体夹心酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定血清β-Amyloid(美国CUSBIO公司)浓度[4]。
1.4 统计学处理方法 采用SPSS26.0 统计软件进行数据处理与分析。计量资料符合正态分布用±s表示,2 组间比较用t检验;非正态分布用M(P25,P75)表示,2组间比较用Mann-WhitneyU检验。计数资料用百分比表示,用χ2检验。用非条件Logistic逐步回归模型分析危险因素。相关性分析用Pearson相关或Spearman相关分析。绘制受试者工作特征(receiver operator characteristic curve, ROC)曲线评价血清β-Amyloid对KOA的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 本研究纳入试验组56 例,对照组25 例。两组性别、年龄、BMI等基本情况差异无统计学意义(均P>0.05),见表3。KOA患者的β-Amyloid、C-反应蛋白(C-reactionprotein, CRP)、血尿素氮(blood urea nitrogen, BUN)和尿酸显著高于对照组,差异有统计学意义(均P<0.05),而高迁移率族蛋白B1(high mobility group protein B1, HMGB1)、谷丙转氨酶(glutamic pyruvic transaminase, ALT)、谷草转氨酶(glutamic oxaloacetic transaminase, AST)、总胆红素(total bilirubin, TBIL)和血肌酐(creatinine, CREA)差异无统计学意义(均P>0.05),见表4。
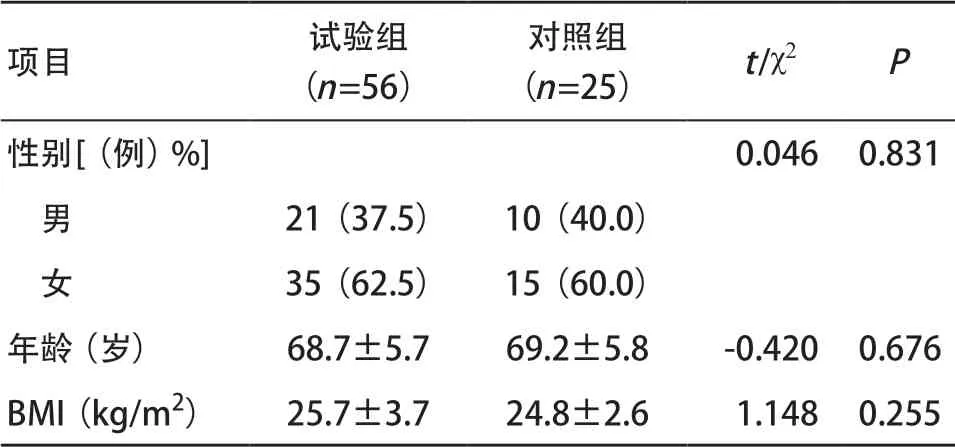
表3 两组患者一般情况
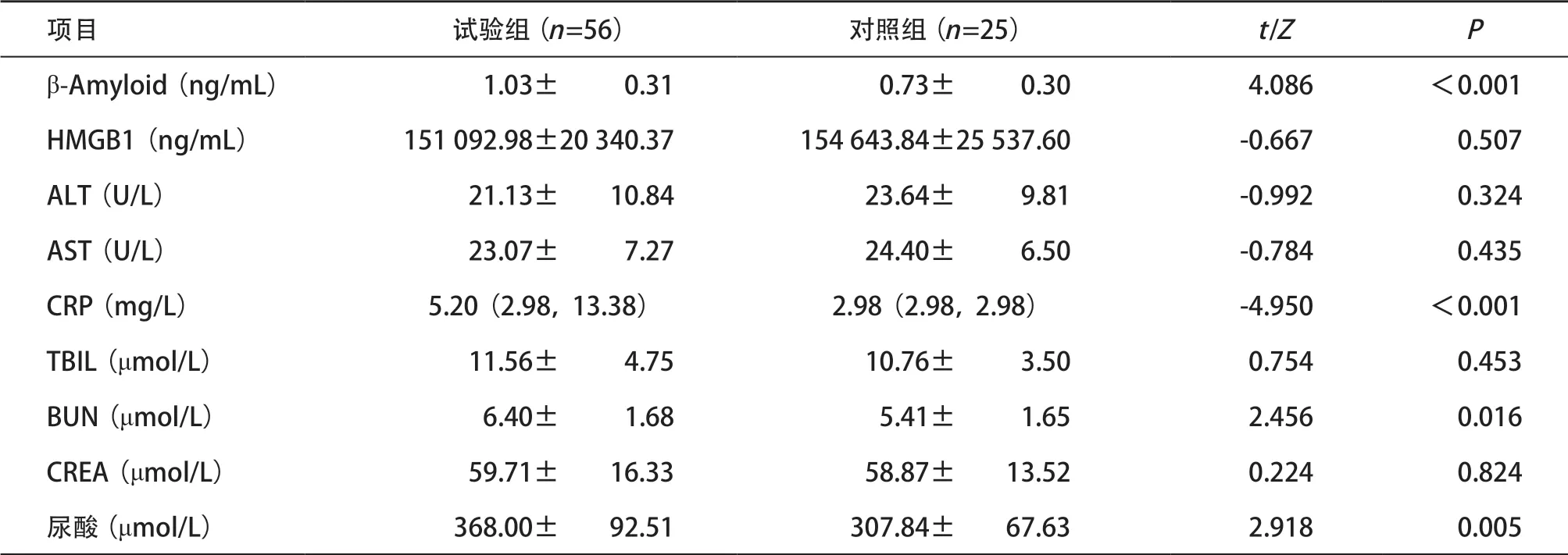
表4 两组患者实验室指标的比较
2.2 非条件Logistic逐步回归模型分析KOA危险因素 为进一步确定KOA的独立危险因素,以KOA为因变量,单因素分析有统计学意义的指标为自变量,拟合非条件Logistic回归模型。结果显示,β-Amyloid是KOA发生的独立危险因素(OR=15.122,P=0.028),见表5。
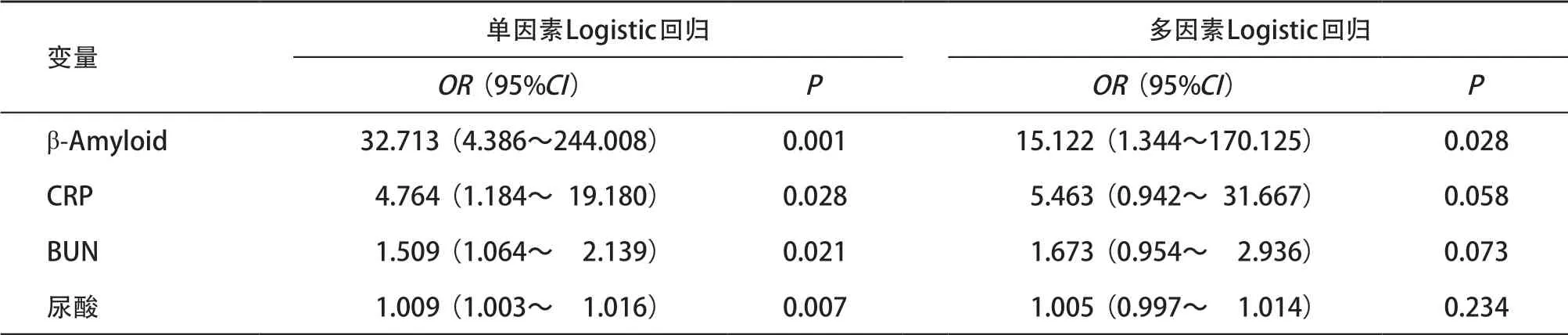
表5 KOA危险因素的单因素和多因素Logistic回归分析
2.3 血清β-Amyloid诊断KOA的ROC曲线 血清β-Amyloid诊断KOA的ROC曲线提示,其曲线下面积(area under curve, AUC)为0.752(0.636~0.867),β-Amyloid临界值为0.770 ng/mL,特异度为60.0%,敏感度为85.5%,见图1。
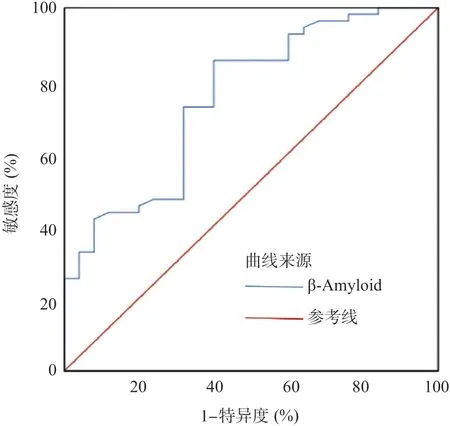
图1 血清β-Amyloid诊断KOA的ROC曲线
2.4 不同严重程度KOA患者β-Amyloid水平比较
56例试验组按照K-L分级分为K-L 2级8例、K-L 3/4级48例患者。β-Amyloid的表达在K-L 2级与K-L 3/4级间差异有统计学意义(t=-2.093,P=0.041),见图2。且β-Amyloid的表达与KOA严重程度分级呈显著正相关(r=0.332,P=0.013),提示患者血清β-Amyloid越高,KOA越严重。
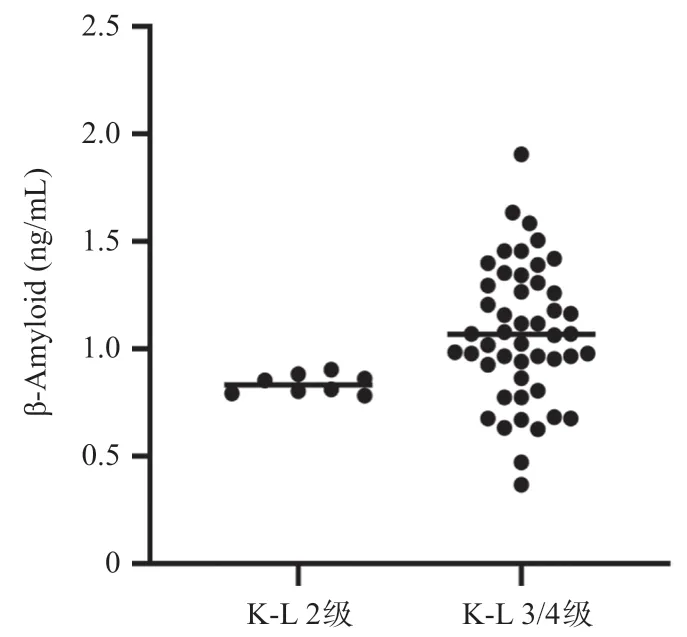
图2 β-Amyloid在不同K-L分级KOA患者中的表达
2.5 血清β-Amyloid在KOA手术前后变化值与康复恢复时间分析 比较K-L 4级患者中有8例患者术前术后血清β-Amyloid的表达变化以及患者的住院时间,β-Amyloid在K-L 4级KOA患者术后较手术前显著降低,差异有统计学意义(t=3.749,P=0.002),见图3。且KOA患者手术前后血清β-Amyloid变化值与患者住院时间呈显著负相关(r=-0.949,P<0.001),提示KOA患者手术前后血清β-Amyloid下降越多的患者住院时间越短,康复恢复越快,见图4。以疼痛、活动受限、关节畸形等为主要临床表现,病理学变化表现为关节软骨损伤、骨赘形成、软骨下骨及半月板等组织的改变。据调查中国症状性KOA(诊断明确,存在临床症状且需要就诊)的患病率为8.1%,且女性患病率明显高于男性[5]。其中,大于55岁的人群中约60%具有KOA的影像学表现,65岁以上的老年人KOA的发病率可达85%[6]。KOA发病受多种因素影响,包括遗传、性别、种族、年龄、肥胖、关节过度活动和损伤等[7]。其致病机制复杂,原发性损伤常涉及机械应力、炎症、代谢、免疫、遗传等因素,继发性多由创伤、关节先天发育不良或医源性损伤引起[8]。随着社会的发展、人口老龄化的加快、肥胖人群比例的上升,膝骨关节创伤的增加,KOA发病率显著增高。不仅对个人的生理功能、生活质量造成严重损害,还导致了个人、家庭和社会的经济成本显著增加。
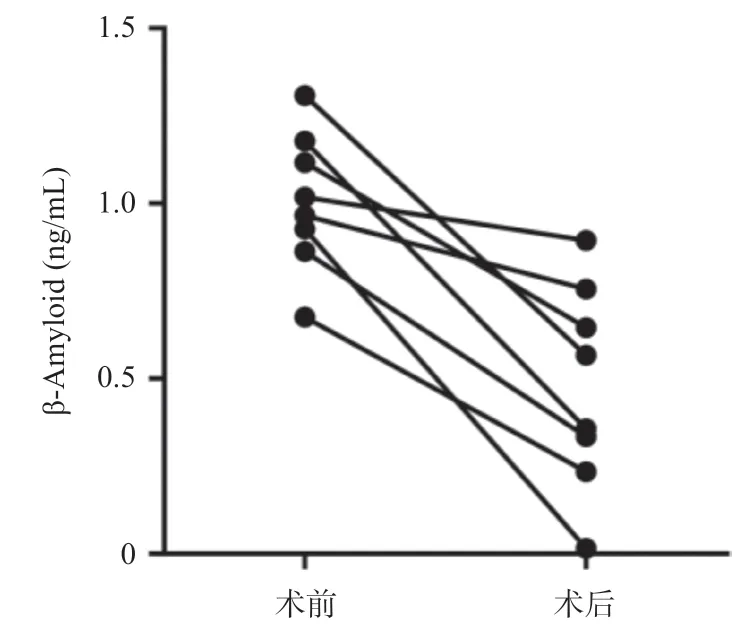
图3 β-Amyloid在KOA术前和术后中的表达比较
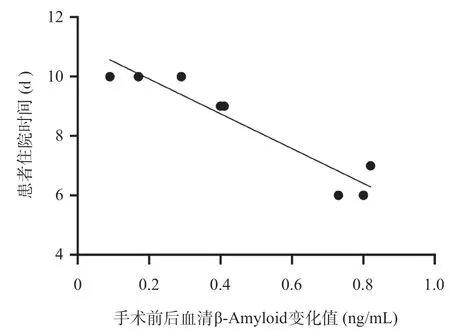
图4 术前后血清β-Amyloid变化值与患者住院时间的相关性
本研究发现β-Amyloid分子在KOA患者中显著升高,而在术后显著下降。细胞膜上的淀粉样蛋白前体(amyloid protein precursor, APP)经β和γ蛋白酶的水解形成Mr 4 000左右的蛋白,称为β-Amyloid(β-淀粉样蛋白)。GLENNER等[9]1980年首先分离和测序了β-Amyloid,发现其通常两种形式存在,分别
3 讨论
KOA多发于中老年人,是一种退行性关节病变,为β-淀粉样蛋白40(amyloid-β protein 40, Aβ40)和β-淀粉样蛋白42(amyloid-β protein 42, Aβ42)。自从它被发现以来就与阿尔兹海默病(Alzheimer’s disease, AD)密切相关。β-Amyloid通过氧化应激和Ca2+超载导致细胞内凋亡因子激活,同时破坏线粒体使细胞的供能系统障碍,最终造成凋亡[10]。此外,β-Amyloid还可以激活神经胶质细胞,释放细胞因子和炎症介质,产生炎症反应,从而间接损伤神经细胞[10-12]。本研究发现β-Amyloid在KOA中明显升高,术后的β-Amyloid水平较术前明显降低,表明其不仅能够提示KOA的发生,还对KOA的预后有着一定的提示作用。根据此前在AD中的研究,机体APP和β-Amyloid的代谢受机体老化、毒素、感染、炎症等外界因素的影响,发生紊乱引起β-Amyloid的异常释放和沉积[13]。而从KOA发病机制上来看,在机械力学作用、炎症、免疫代谢、遗传等多因素作用下会诱发KOA[14]。推测在KOA患者中,可能正是因为炎症反应等因素作用,导致β-Amyloid代谢紊乱增加,进而引发线粒体损伤和神经元细胞凋亡。线粒体的损伤进一步导致β-Amyloid代谢障碍和堆积,发展为β-Amyloid不断堆积的恶性循环;β-Amyloid的堆积又损伤神经细胞,释放细胞因子和炎症介质,加强了炎症反应,进一步导致β-Amyloid累积。而手术清除了炎症反应灶,中断了恶性循环,使得β-Amyloid降低。
非条件Logistic逐步回归模型分析KOA的危险因素,结果显示β-Amyloid是KOA患病的危险因素(OR=15.122),表明β-Amyloid与KOA的发生发展密切相关。Spearman秩相关分析,提示β-Amyloid的表达量和KOA严重程度呈正相关;Pearson相关分析,提示患者手术前后β-Amyloid的表达变化和康复恢复时间呈负相关。综上所述,β-Amyloid是KOA患病的危险因素,血清β-Amyloid水平可能成为一种评估KOA发生及预后的生物标志物。
本研究样本比较少,时间跨度短,下一步计划纳入更多患者进行进一步验证。康复恢复指标近患者住院时间,指标单一,下一步需增加功能活动康复指标,做进一步的深入研究。
