茶叶中虱螨脲等6种农药残留量的检测及结果分析
2022-04-29张聪王秀云陈硕
张聪 王秀云 陈硕


摘要:为打破发达国家设置关于茶叶中虱螨脲等6种农药残留的绿色壁垒,提高我国茶叶出口质量,降低茶叶出口贸易风险,研究建立茶中虱螨脲等6种农药残留量的检测方法。文中首先确定6种农药的质谱参数,并优化液相条件,然后通过优化实验条件建立了茶叶中虱螨脲等6种农药残留量的液相色谱-串联质谱检测方法。方法的标准曲线相关系数、精密度、回收率、检测限、定量限等指标符合GB/T 27404-2008《实验室质量控制规范食品理化检测》要求。用该方法对151批市售样品进行检测,除氯噻啉外其他5种农药均有检出。该方法便捷、高效、准确、灵敏,可用于茶叶中虱螨脲等6种农药残留量的测定。
关键词:茶叶;液相色谱-质谱联用仪;农药残留;固相萃取
Analysis of Detection Results of Six Pesticides Residues Including Lufenuro in Tea
ZHANG Cong WANG Xiu-Yun CHEN Shuo
(1 Fujian Institute for Food and Drug Quality Control, Fuzhou 35000, Fujian, China)
(2 Fujian Provincial Center for Drug Inspection, Fuzhou 35000, Fujian, China)
Abstract: In order to break the green barriers set up by developed countries about 6 pesticide residues such as lufenuron in tea, improve the quality of China's tea export, and reduce the risk of tea export trade, the detection methods for 6 pesticide residues such as lufenuron in tea were studied and established. Firstly, the mass spectrometry parameters of the six pesticides were determined, and the liquid phase conditions were optimized. Then, a liquid chromatography-tandem mass spectrometry method was established for the determination of six pesticide residues including lufenuron in tea by optimizing the experimental conditions. The correlation coefficient of standard curves, precisions, recoveries, limit of detections, limit of quantifications and other indicators of the method meet the requirements of GB/T 27404-2008 standard: Criterion on Quality Control of Laboratories-Chemical Testing of Food. 151 batches of commercial samples were tested by this method, and all five pesticides except chlorothiline were detected in tea. The method is convenient, efficient, accurate and sensitive, and can be used for the determination of 6 pesticide residues including lufenuron in tea.
Key Words: Tea; Liquid chromatography-tandem mass spectrometry; Pesticide residues; Solid phase extraction
1引言
茶叶是我国传统特色农产品,在国内外农产品贸易市场中占有十分重要的地位。福建省茶叶产量居全国第一,占全国总产量的20%左右,出口总量位居全国第二[1]。随着经济水平的高速发展,人们越来越重视农产品的质量问题。目前,世界各国特别是发达国家都制定了严格的茶叶标准,不仅增加了需要检测的农药种类,也降低了农药在茶叶中的最大残留量,并针对茶叶中农药残留量设置了相关的绿色贸易壁垒[2-4],对我国茶叶的出口产生消极影响。据统计,2015年至2020年间,因茶叶农药残留对华发出的通告共90次(占总农残通报比59.5%),仅在2015年一年内,有35批次的茶叶被美国和日本通报为不合格产品,其中因农残超标的就有29批,占比高达83%[5-6],其中唑虫酰胺、氯虫苯甲酰胺、丁醚脲、虱螨脲等农药被多次通报。因此,我国茶叶出口大国日本和美国及欧盟委员会多次修改茶叶中氯虫苯甲酰胺、虱螨脲等农药最大残留量的限值,修改后的限量值要远低于之前的数值。由此可见,在茶叶出口贸易中,农药残留量是我国目前面临的最大问题,完善我国现有茶叶中农药残留的检测方法是解决这一问题的途径之一。
GB 2763-2021《食品中农药最大残留限量》作为现行有效的国家标准,其中仅对丁醚脲、唑虫酰胺和氯噻啉的最大残留量限值进行规定,丁醚脲和唑虫酰胺给出了相应的检验方法,而虱螨脲、氯虫苯甲酰胺和甲基硫菌灵仍未给出相应的检验方法和限量值。对比我国植物类和茶叶中农残的其他现行检验标准,发现氯虫苯甲酰胺、虱螨脲、甲基硫菌灵、氯噻啉、唑虫酰胺在2022年1月1日开始实施的标准GB 23200.121-2021《食品安全国家标准植物源性食品中331种农药及其代谢物残留量的测定液相色谱-质谱联用法》有相应的检验方法,丁醚脲在GB 23200.13-2016《食品安全国家标准茶叶中448种农药及相关化学品残留量的测定液相色谱-质谱法》有相应的检验方法,这6种农药不能同时检测,且在标准中氯虫苯甲酰胺、唑虫酰胺、虱螨脲、甲基硫菌灵和氯噻啉的定量限均为0.05mg/kg,氯虫苯甲酰胺、虱螨脲的定量限要高于欧盟规定限量值的0.02mg/kg,氯噻啉的定量限要高于欧盟和日本规定的限量值0.01mg/kg,唑虫酰胺的定量限要高于欧盟规定的0.01mg/kg[7-10]。由此可见,针对虱螨脲等6种农药,我国现行的国家标准正在逐步完善,但是也存在着一定的不足,因此建立合适的适用茶叶中虱螨脲等6中农药残留量的检验方法,对于保障我国茶叶出口及我国人民身体安全具有重要意义。
因此,本研究建立液相-串联质谱联用法的同时对残留进行检测,对检测方法的前处理进行调整,并降低了茶叶中虱螨脲等6种农药残留检测的定量限、检测限。不仅可以对市售产品进行风险监测研究,提高我国茶叶及其制品的食品质量,还可以攻破发达国家设置的关于茶叶中这6种农药限量值的壁垒,同时为政府监管与企业产品质量改进与提高提供一定依据。
2实验部分
2.1 试剂与材料
1290 Infinity高效液相色谱仪(美国Agilent公司);AB 5500 Qtrap三重四极杆质谱仪(美国AB公司);CR21N离心机(日本日立公司);MS3型涡旋混合器(德国IKA公司);XSE204型电子天平(0.1mg,瑞士Mettler Toledo公司);HM100刀式研磨仪(北京格瑞德曼公司);实验用水由Milli-Q超纯水器(美国Milipore公司)制得。
甲苯(色谱纯,德国默克公司);乙腈(色谱纯,美国Fisher公司);甲酸(色谱纯,上海阿拉丁公司);石墨化碳/氨基复合固相萃取柱(500mg/500mg,6mL)、弗罗里硅土固相萃取柱(1000mg,12mL)、C18固相萃取小柱(2.0g,12mL)、石墨化碳固相萃取小柱(500mg,6mL)、氨基固相萃取小柱(500mg,3mL)(天津艾杰尔科技公司);氯虫苯甲酰胺、虱螨脲、甲基硫菌灵、氯噻啉、唑虫酰胺、丁醚脲标准溶液(浓度均为100μg/mL,天津农业部环境质量监督检验测试中心)。
茶叶样品购自福建各地茶叶市场或超市。
2.2 标准溶液的配制
准确吸取6种标准物质各1mL分别置于6个10mL容量瓶中,用乙腈定容至刻度摇匀,得质量浓度为10μg/mL的标准储备液,-18℃保存;准确吸取虱螨脲、氯噻啉、丁醚脲标准储备液各5mL,氯虫苯甲酰胺、唑虫酰胺标准储备液各0.5mL,甲基硫菌灵标准储备液2.5mL,用乙腈定容至50mL容量瓶中,得混合标准储备液;根据实验需求,按照样品前处理步骤处理空白茶叶样品制得空白样品基质,用空白基质溶液配制虱螨脲、氯噻啉、丁醚脲质量浓度为1.0ng/mL、2.0ng/mL、5.0ng/mL、10.0ng/mL、20.0ng/mL、50.0ng/mL,氯虫苯甲酰胺、唑虫酰胺的质量浓度为0.1ng/mL、0.2ng/mL、0.5ng/mL、1.0ng/mL、2.0ng/mL、5.0ng/mL,甲基硫菌灵的质量浓度为0.5ng/mL、1.0ng/mL、2.5ng/mL、5.0ng/mL、10.0ng/mL、25.0ng/mL的标准工作溶液。
2.3 样品前处理
准确称取10g样品(精确至0.01g)于50mL离心管中,加入10mL的水浸泡30min,准确加入20mL乙腈溶液,以12000r/min匀浆提取1min,4500r/min离心5min,上清液移入鸡心瓶中。再重复提取一次,合并两次提取液,40℃水浴旋转浓缩至近干,准确加入5mL乙腈溶解残余物,待净化。石墨化碳/氨基固相萃取柱加样前先用5mL乙腈-甲苯溶液预洗柱,准确移取1mL样品提取液转移至固相小柱上,25mL乙腈-甲苯(3:1)溶液洗脱,洗脱液在40℃水浴中旋转浓缩至近干,加1mL乙腈-水溶液溶解残渣,经0.22μm微孔滤膜过滤后,待上机测定。
2.4 液相色谱-串联质谱条件
2.4.1液相条件
ACQUITY UPLC R BEH C18色谱柱(2.1mm×50mm,1.7μm),流动相:0.1%甲酸水(A)-乙腈(B),流速:0.3mL/min,进样体积:2.0μL,柱温:30℃。液相色谱梯度洗脱程序:0min~1.0min,70%A;1.0min~5.0min,70%~10%A;5.0min~8.0min,10%A;8.0min~9.0min,10%~70%A;9.0min~11.0min,70%A。柱温:35℃;流速:0.3mL/min;进样量:1.0μL。
2.4.2 质谱条件
丁醚脲、甲基硫菌灵、氯噻啉、氯虫苯甲酰胺、唑虫酰胺的质谱条件:①离子源:电喷雾电离正负切换模式(ESI±);②扫描模式:多反应监测扫描模式(MRM);③电喷雾电压:±4500V;④离子源温度:450℃;⑤气帘气压:20Psi;⑥雾化气压:50Psi;⑦辅助气压:50Psi;⑧碰撞池入口电压:9.0V;⑨碰撞室出口电压:15.0V。
3 结果与讨论
3.1 质谱条件优化
将6种农药配制成50μg/L浓度的混合标液,在电喷雾正负离子(ESI+/-)模式下进行全扫。结果发现,丁醚脲、甲基硫菌灵、氯噻啉、氯虫苯甲酰胺、唑虫酰胺在正离子模式下响应值较高,而虱螨脲在正离子模式下的响应值要比负离子模式下的响应值要低一个数量级,故而前5种化合物在正离子模式下进行检测,虱螨脲则在负离子模式下进行检测。采用直接进样的模式,将50μg/L浓度的混合标液直接注入离子源,在相应的正负离子模式下,先获得准分子离子峰,结果表明,丁醚脲、甲基硫菌灵、氯噻啉、氯虫苯甲酰胺、唑虫酰胺均可形成稳定[M+H]+峰,虱螨脲可形成稳定[M-H]-峰;然后以该分子离子峰为母离子,对准分子离子进行二级质谱分析得相应的离子碎片信息,参照欧盟2002/657/EC的规定[11],每种农药选择两对响应值高且无干扰的特征离子对作为定量和定性的离子对,同时优化了MRM参数,结果详见表1。
3.2 液相条件优化
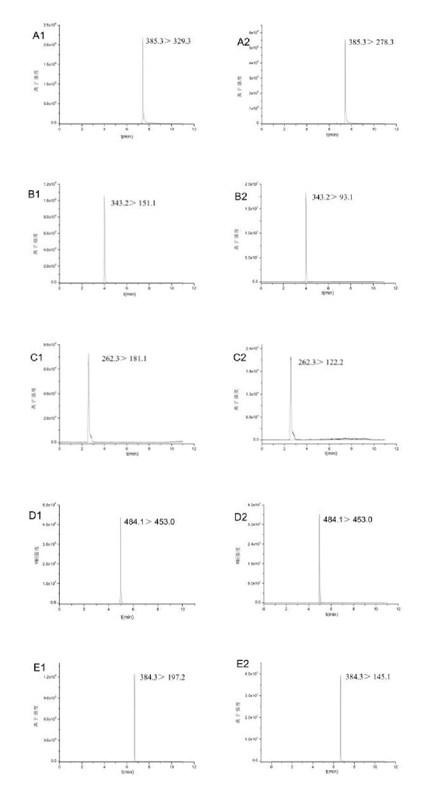
由于6种农药化合物均含有多个N原子,与色谱柱固定相硅胶上裸露的硅羟基形成氢键,造成峰型的拖尾,加入一定量的甲酸,可以抑制化合物与硅羟基之间氢键的形成,可以改善峰型,同时甲酸还可提高电喷雾中化合物的离子化效率,因此本试验选择在水相中加入一定量的甲酸。反相色谱常用到的有机相为甲醇和乙腈,本试验比较了以这两种溶剂为有机相条件下6种化合物的分离度,结果发现以乙腈为流动相的分离效果更好,且在相同条件下乙腈对茶叶中色素、茶多酚等干扰成分的洗脱能力要远大于甲醇,故本试验选择乙腈作为最终的有机相流动相,含有0.1%甲酸水体系为流动相。6种化合物的MRM图谱详见图1。
3.3提取溶剂优化
6种农药的结构差异较大,但都易溶于乙腈、丙酮、甲醇等有机溶剂。同时茶叶是基质比较复杂的样品,为了保证提取效率及降低基质中杂质的干扰,选择常用的乙腈、甲醇、丙酮进行提取效果考察,结果显示,相对于其他溶剂,乙腈的除杂及提取效果最佳,因其渗透性强,溶解性能良好,不仅能提高6种农药的回收率,而且能减少提取液中色素、茶多酚等共萃取物的含量,有利于后续的净化。
3.4净化条件优化
参照现有的茶叶中农药检测标准[12-15],本试验分别考察了弗罗里硅土固相萃取柱、石墨化碳/氨基复合固相萃取柱、C18-石墨化碳-氨基串联固相萃取柱对6种化合物回收率的影响。结果发现在经过净化后,弗罗里硅土固相萃取柱的上机液颜色最深,串联固相萃取柱的上机液基本无色,石墨化碳/氨基复合固相萃取柱的上机液颜色少带浅绿,说明串联固相萃取柱的净化效果最佳,但是串联固相萃取柱的上机液回收率低于石墨化碳/氨基复合固相萃取柱,弗罗里硅土柱的颜色深且回收率远低于其他两种萃取小柱,结果详见图2,故本试验在SPE净化法选取石墨化碳/氨基复合固相萃取柱。
3.5 方法学验证
3.5.1基质效应
在检测过程中基质效应(ME)是普遍存在的[16],其会影响方法的灵敏度、精密度和准确度,茶叶是一种基质比较复杂的食品,因此需要对所建立的检测方法中基质效应带来的影响进行评价。本试验采用相对响应值的方法[17]来评价6种化合物的基质效应:ME(%)=(1-A/B)×100%,其中A为基质匹配标准溶液的响应值,B为乙腈溶剂标准溶液的响应值。通常认为当ME的绝对值大于20%时,存在较大的基质干扰,当ME为正值是为基质增强,为负值时为基质抑制,由表2可知,6种化合物的ME均为负值,且绝对值均大于20%,说明在液质检测过程中存在明显的基质抑制效应,为了提高方法的准确度和灵敏度,本实验采用空白基质提取液来配置标准溶液,进行外标法定量。
3.5.2 线性、检出限和定量限
按照2.2配制标准曲线,按照2.4色谱和质谱条件进行检测,以6种化合物的质量浓度为X轴,定量离子的峰面积为Y轴,绘制工作曲线,得到线性回归方程及相关系数r,如表2所示,6种化合物的线性关系均良好。以3倍的信噪比(S/N)和10倍的信噪比(S/N)来确定方法的检出限(limit of detection, LODs)和定量限(limits of quantification, LOQs),如表2所示,丁醚脲、甲基硫菌灵、氯噻啉、氯虫苯甲酰胺、唑虫酰胺和虱螨脲的LODs分别为5.0μg/kg、2.5μg/kg、5.0μg/kg、0.5μg/kg、0.5μg/kg、5.0μg/kg,LOQs分别为10.0μg/kg、6.0μg/kg、13.7μg/kg、1.2μg/kg、1.2μg/kg、11.6μg/kg。其中甲基硫菌灵、氯噻啉、氯虫苯甲酰胺、唑虫酰胺和虱螨脲的检出限和定量限要低于现行有效的国家标准,且低于欧盟、美国及日本规定的最大残留量限值,说明本方法的灵敏度完全满足实际检测的要求。
3.5.3 准确度及精密度
本试验采用加标回收实验,并以加标回收率来评价方法的准确度,以加标回收的相对标准偏差来评价方法的精密度。先选取不含6种农药残留的阴性样品,分别向其中加入一定量的6种农药,加标量详见表3,每个添加水平的实验平行测定6次,然后计算平均回收率及RSD,结果详见表3。结果表明,6种农药的回收率在74.7%~112%之间,RSD在1.8%~8.1%之间,说明本方法具有较好的准确度和精密度,方法的准确性和重复性满足GB/T 27404-2008《实验室质量控制规范食品理化检测》规定的方法回收率偏差、实验室内变异系数要求,可以用于实际样品的检测。
3.6 实际样品检测及结果分析
按照最优的实验条件对151批市场购买的茶叶样品进行检测。151批茶叶涵盖了5大类茶叶(绿茶65批、红茶20批、白茶12批、黑茶4批、青茶50批),其中有124批次检出唑虫酰胺,占比82.1%,20批次检出氯虫苯甲酰胺,占比13.2%,27批次检出丁醚脲,占比17.9%,14批次检出甲基硫菌灵,占比9.3%,35批次检出虱螨脲,占比23.2%,氯噻啉未检出;151批次茶叶中21批次6种农药残留均未检出,占比仅有13.9%,检出一种农残的65批次,占比43.0%,检出两种农残的40批次,占比26.5%,检出三种农残的20批次,占比13.3%,检出四种农残的5批次,占比3.3%。由于欧盟没有规定茶叶中丁醚脲的最低限量值,按照欧盟最低检出量默认标准0.01mg/kg来计算,151批茶叶中共20批茶叶丁醚脲不符合欧盟的规定;1批的氯虫苯甲酰胺和15批的虱螨脲超出欧盟规定的0.02mg/kg;99批次的唑虫酰胺超出了欧盟规定的0.01mg/kg。
虱螨脲和唑虫酰胺在5种茶叶中均有检出。丁醚脲在绿茶、白茶和黑茶中有检出,其白茶和黑茶的检出占比相对较大,这可能和茶叶制作工艺有关及丁醚脲易光解、水解有关[18],而绿茶中丁醚脲只能在当年的新茶中检出,白茶和黑茶不分年份均能检出,结合相关文献[18-19],可能是白茶和黑茶在制作工艺中加热、见光较少,丁醚脲分解较少,所以容易检出,而针对绿茶、红茶和青茶制作工艺过程中致使丁醚脲分解而致其未检出。甲基硫菌灵在绿茶、红茶和青茶中有检出,且检出值均比较小,这和甲基硫菌灵已分解的特性有关,而买到的白茶和黑茶大部分都是陈茶。氯虫苯甲酰胺除黑茶外均有检出,但是检出值相对较低,这跟其本身为新型酰胺类农药有关,病虫害的抗药性较低,故其用药量较低,且我国还尚未登记其在茶叶种植过程中使用。
结果表明在茶叶种植过程中唑虫酰胺是普遍使用的一种农药,且残留量较大;虱螨脲、丁醚脲、甲基硫菌灵和氯虫苯甲酰胺存在一定范围的使用,其中氯虫苯甲酰胺、甲基硫菌灵、虱螨脲国家标准并未规定限量值,存在一定的食品安全风险。
4 结论
本研究建立了同时检测茶叶中虱螨脲等6种农药残留量的高效液相色谱-串联质谱测定方法,方法步骤简便、快速,方法学指标符合GB/T 27404-2008 《实验室质量控制规范食品理化检测》的要求。通过本方法对市售的5大类茶叶151批样品的检测,结果发现唑虫酰胺大批量检出,氯虫苯甲酰胺、虱螨脲、甲基硫菌灵、丁醚脲少量样品检出,只有氯噻啉未发现有检出,这表明在茶叶种植过程中确有用到上述6种农药中的5种农药,唑虫酰胺是普遍使用的一种农药,残留量较大;虱螨脲、丁醚脲、甲基硫菌灵和氯虫苯甲酰胺存在一定范围的使用,其中氯虫苯甲酰胺、甲基硫菌灵、虱螨脲国家标准并未规定限量值,其存在一定的食品安全风险,且会对我国茶叶出口造成一定的影响。本方法可用于茶叶中同时检测虱螨脲等6种农药的残留量,且方法的检出限和定量低于现行的国家标准和欧盟、美国等发达国家的限量值,可为出口茶叶中这6种农药检测提供技术支撑,同时也可为我国现行标准的提高,提供一定的技术支持。另外,可通过方法监测茶叶种植过程中农药喷施时间和采收时间对茶叶中残留量的影响,确保在保证茶叶品质和产量的同时,尽可能降低农药残留量。
参考文献
[1]刘新,陈红平,王国庆.中国茶叶质量安全40年[J].中国茶叶,2019,(12):1-9.
[2]彭威民.绿色壁垒对湖南茶叶出口的影响研究[J]. 中国市场,2016,(29):185-186.
[3]周洲.国际市场绿色壁垒下的我国茶叶外贸对策构建[J]. 福建茶叶,2017,(7):40-41.
[4]李妍月.欧盟绿色贸易壁垒对中国茶叶出口的影响研究[D].东北财经大学,2016.
[5]张虹艳,杨淑琴,王小乔,高鹏,李赟,邱国玉.2015-2019年欧盟食品和饲料快速预警系统对华食品农兽药残留通报的数据分析[J]. 食品安全质量检测学报,2021,12(7)2600-2606.
[6]朱凤玲.2013-2017年欧美日韩通报我国不合格茶叶信息汇总与评析[J].中国茶叶,2018,40(6):24-27.
[7]王金鑫.基于欧盟官网通报不合格茶叶信息分析茶叶农残现状及应对措施[J].中国茶叶,2018(01):37-39.
[8]丁亦男,童小麟,赖国银,徐敦明,林立毅,黄旖珏,张志刚.国内外茶叶农药残留限量标准与出口茶叶安全研究[J].食品安全质量检测学报,2019,10(23):8140-8145.
[9]杨梅,罗逢健,周利,楼正云,张新忠,孙荷芝,王新茹,陈宗懋.国内外茶叶农药最大残留限量标准比较分析与建议[J].浙江农业学报,2020, 32(1):168-175.
[10]孔紫薇.农药最大残留限量标准差异对中国茶叶出口的影响[J]. 福建茶叶,2021(02):36-37.
[11]高海荣.二氧化锆QuEChERS-高效液相色谱-串联质谱测定鱼肉中2种硝基咪唑及代谢产物[J].食品工业科技,2019,40(4):266-270.
[12]食品安全国家标准茶叶中448种农药及相关化学品残留量的测定液相色谱-质谱法:GB 23200.13-2016 [S].
[13]茶叶中农药多残留测定气相色谱/质谱法:GB/T 23376-2009[S].
[14]食品安全国家标准植物源性食品中208种农药及其代谢物残留量的测定气相色谱-质谱联用法:GB 23200.113-2018[S].
[15]食品安全国家标准植物源性食品中331种农药及其代谢物残留量的测定液相色谱-质谱联用法:GB 23200.121-2021[S].
[16]HE Z,WANG L,PENG Y,et al.Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatography-tandem mass spectrometry-based method[J].Food chemistry,2015,169:372-380.
[17]孙利东,许秀丽,袁飞,等 .高效液相色谱-串联质谱法测定牛奶和鸡肉中4种激素本底值[J].食品科学,2017,38(22):291-297.
[18]董晓倩,刘松南,刘蕊,黄田田,宗琦,王华,欧阳亚旭. QuEChERS-液相色谱-串联质谱法测定茶叶中的丁醚脲[J].食品科学,2017,38(08):244-250.
[19]姜楠,刘思洁,崔勇,马杰.超高效液相色谱-串联质谱法测定植物源性食品中18种农药残留[J]. 食品安全质量检测学报,2021,12(7):2919-2928.
