实时荧光PCR在检测鸡精中鸡源性成分中的应用
2022-04-29陈欣周正海尹露付莎莉王利刚
陈欣 周正海 尹露 付莎莉 王利刚

摘要:为监测鸡精中鸡源性成分情况,文中设计了一套特异性的探针和引物,使用实时荧光PCR,对市售的30种鸡精样品进行鸡源性检测。其中,能检测出鸡源性成分的样品28个,未能检测出鸡源性成分的样品2个。实验结果显示,设计的特异性探针和引物在给定的扩增条件下可以在较短时间内检测出鸡精中的鸡源性成分,具有操作简便快捷,检出灵敏度高,扩增特异性强等优点,方法可用于鸡精中鸡源性的检测,为市场监管部门开展风险监测提供技术支撑。
关键词:实时荧光PCR;鸡精;鸡源性成分
Application of Real-time PCR in the Detection of Chicken-derived Components in Chicken Essence
CHEN Xin ZHOU Zheng-Hai YIN Lu FU Sha-Li WANG Li-Gang
Abstract:In order to monitor whether chicken essence contains chicken derived components, a set of specific probes and primers were designed. Real-time PCR was used to detect 30 kinds of chicken essence in the market. The results manifested that 28 chicken essences were found to have chicken derived components, and 2 chicken essences were not found to have chicken derived components. The designed probe and primer can specifically detect the chicken derived components in chicken essence in a short time. This method is simple, rapid, highly accurate and specific, which can provide a practical and effective method for the monitoring of chicken origin in chicken essence.
Key Words: Real-time PCR; Chicken essence seasoning; Chicken-derived ingredients
1前言
随着人们对烹饪需求的提高,近几年,我国固体调味品市场日渐增大,其中鸡精更是受到了消费者的广泛喜爱。鸡精的产量逐年增加,2019年的产量达到43.42万吨,其市场规模也在2019年达到44.95亿元。根据我国商业标准SB/T 10371-2003《鸡精调味料》,鸡精的原料是鸡肉/鸡骨的粉末或其浓缩抽提物、味精、食用盐、呈味核苷酸二钠及其辅料。鸡精中是否有“鸡”也成为消费者关注的焦点。
PCR技术是一种分子生物技术,与色谱法、化学方法等相比较,PCR技术因其特异性强,检测时间较短,灵敏度高,已在检测动物源性成分中受到了广泛应用[1-4]。实时荧光PCR是利用对PCR反应体系中的荧光信号的实时监测,实现对样品模板的定性分析[5]。本实验采用实时荧光PCR对鸡精样品进行检测,旨在了解市面上鸡精中鸡源性成分情况。
2 材料与方法
2.1 材料与试剂
2.1.1 鸡精
本次实验中30个批次的鸡精样品(编号:1-30)均购自商超、农贸市场等。鸡骨、鸡肉、猪肉和牛肉均购自农贸市场。
2.1.2 引物、探针的设计和合成
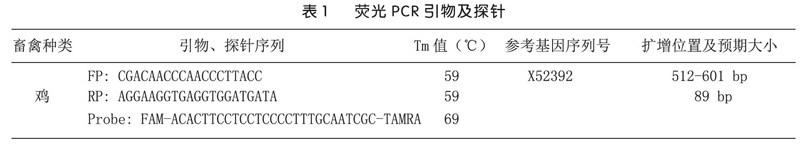
设计的引物和探针序列见表1。引物和探针均由深圳华大基因合成。
2.1.3 试剂
通用基因组DNA提取试剂盒(厂家:TaKaRa 货号:9765),Premix Ex Taq(廠家:TaKaRa 货号:RR390)。
2.1.4 实验仪器
实时荧光PCR系统(厂家:瑞士罗氏公司 型号:LightCycler96),微量核算蛋白分析仪(厂家:Thermo 型号:NanoDrop ONEc),恒温水浴锅(厂家:上海森信实验仪器 型号:DK-8D),高速冷冻离心机(厂家:Thermo 型号:Legend Micro21R)。
2.2 方法
2.2.1 鸡精中DNA的提取
按DNA提取试剂盒的说明书,对鸡精样品进行DNA提取。取20mg~25mg的鸡精,置于离心管中,加入10?L的RNA酶(10mg/mL),180?L的GL缓冲液和20?L的蛋白酶K,于56℃水浴温浴约3小时。将上述裂解液12000rpm离心2min,取上清200?L,加入1:1的无水乙醇和GB缓冲液充分吸打混匀。将混匀的液体移至安置在收集管上的吸附柱中,离心两分钟后,倒掉滤液。接着用WA缓冲液和WB缓冲液分别进行洗脱,并倒掉滤液。最后将洗脱后的吸附柱安置于新离心管上,用Elution Buffer(需提前预热到65℃)洗脱DNA,得到鸡精样品的DNA。
2.2.2 鸡骨、鸡肉、牛肉和猪肉DNA的提取
按照DNA提取试剂盒的说明书,对鸡骨、鸡肉、牛肉和猪肉进行DNA提取。分别取20mg-25mg的鸡骨、鸡肉、牛肉和猪肉,将鸡肉、猪肉和牛肉剪碎,鸡骨用液氮研磨后,置于离心管中,加入10?L的RNA酶(10mg/mL),180?L的 GL缓冲液和20?L的蛋白酶K,于56℃水浴温浴5小时。其他步骤同2.2.1 鸡精中基因组DNA的提取。
2.2.3 荧光PCR检测
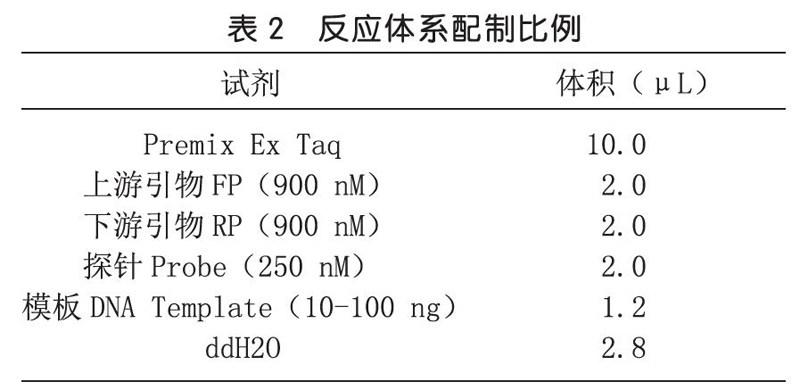
反应体系配制比例见表2。
向每个实时荧光PCR反应管中加入以上反应混合液,转移至样品制备区。提取鸡肉,鸡骨中的DNA用于阳性对照,提取猪肉和牛肉中的DNA作为阴性对照,等体积的去离子水用于空白对照。分别将制备好的模板DNA溶液加入装有反应混合液的实时荧光PCR反应管中,进行实验。
扩增条件见表3。
3 结果与分析
3.1 模板DNA质量
将获得的DNA提取液用微量核算蛋白分析仪测定。其OD260/280的值为1.8-2.0,能满足实时荧光PCR的要求。
3.2 质控
为防止出现假阳性或假阴性,将猪肉和牛肉中提取的DNA作为阴性对照,鸡肉和鸡骨头中提取的DNA作为阳性对照,等体积去离子水作为模板空白对照。对照组均设置2个重复,样品组均设置3个重复。结果显示,空白、阴性对照的2组重复均无FAM荧光信号检出;阳性对照2组重复均有FAM荧光信号检出,Ct值均<30.0,呈现典型的扩增曲线。
3.3 结果
经过实时荧光PCR检测,发现30个鸡精样品中,有28个鸡精样品检测出鸡源性成分,有2个鸡精样品未检测出鸡源性成分。根据每个鸡精样品的配料表中与鸡源性相关的成分的标识,未检出鸡源性的样品分别标识了食用鸡油和鸡肉香精,而检出鸡源性成分的样品则标识了鸡肉粉、鸡肉蛋白粉、鸡肉等,见表4。
4 讨论
本实验采用的实时荧光PCR技术相比传统PCR技术具有少污染、高通量、更便捷的优点,在鸡精中鸡源性的检测具有一定的优势。然而荧光PCR也有其局限性,容易受残留的DNA提取试剂和加工原料的影响[6],鸡精中的成分复杂,对于荧光PCR的干扰因子也较多。本实验以猪肉和牛肉的DNA提取物作为阴性对照,鸡肉和鸡骨的DNA提取物作为阳性对照,且阳性对照均为阳性,空白对照和阴性对照的结果均为阴性,说明建立的实时荧光PCR实验是具有可信度的。本实验对30个鸡精样品进行鸡源性检测,从实验结果可以看出检测的28个鸡精样品添加了含有鸡源性成分的配料,且都检出了鸡源性成分。一个鸡精样品未添加鸡源性成分配料,未检测出鸡源性成分。另一个鸡精样品虽然添加了食用鸡油,但并未检出鸡源性成分。含有鸡源性成分的配料必然会比仅添加香精的产品成本高,且现行的国家标准和行业标准并未对鸡精中鸡源性检测做出规定,势必造成某些商家为了节约成本,欺骗消费者。目前,国内关于鸡精中鸡源性检测的研究较少,本实验可为鸡精质量监管提供可行的检测鉴定参考。
参考文献
[1]Saini M, Das D K, Dhara A, et al. Characterisation of peacock (Pavo cristatus) mitochondrial 12S rRNA sequence and its use in differentiation from closely related poultry species[J].British Poultry Science, 2007, 48(2):162-166.
[2]李婷婷,张桂兰,赵杰,朱超,王之莹,陈爱亮.肉及肉制品掺假鉴别技术研究进展[J].食品安全质量检测学报,2018,9(02):409-415.
[3]陈晓宇,陆利霞,熊雄,等.实时荧光PCR技术鉴别流通环节的掺假牛肉及其制品[J].生物加工过程,2021,19(2):214-226.
[4]Dooley J J, Paine K E, Garrett S D, et al. Detection of meat species using TaqMan real-time PCR assays[J].Meat Science,2004, 68(3):431-438.
[5]周云龙.转基因生物标准物质研制与应用[M].中国质检出版社,2014:51-52.
[6]程欣.应用实时荧光PCR方法鉴别食品中的鸭源性成分[D]. 南京农业大学,2015.
