不同光照对脊尾白虾生长、消化和非特异性免疫相关酶活力的影响
2022-04-29江海仪胡吉卉赖晓芳张庆起
柳 森, 江海仪, 秦 峰, 胡吉卉, 赖晓芳, 2, 3, 张庆起, 高 焕, 2, 3
不同光照对脊尾白虾生长、消化和非特异性免疫相关酶活力的影响
柳 森1, 江海仪1, 秦 峰1, 胡吉卉1, 赖晓芳1, 2, 3, 张庆起4, 高 焕1, 2, 3
(1. 海洋科学与水产学院 江苏省海洋生物资源与环境重点实验室, 江苏海洋大学, 江苏 连云港 222005; 2.江苏省海洋生物产业技术协同创新中心, 江苏 连云港 222005; 3. 江苏省农业种质资源保护与利用平台, 江苏 南京 210014; 4. 连云港赣榆佳信水产开发有限公司, 江苏 连云港 222100)
为了探讨光色对水生生物生长和免疫的影响, 本实验研究了5种光照环境对脊尾白虾()生长、消化和非特异性免疫相关酶活力的影响。结果显示: (1) 全光谱组的增重率(WGR)(63.76% ± 0.34%)、特定生长率(SGR)(1.63% ± 0.03%)和存活率(SR)(61.11% ± 1.92%)均显著高于其他4种光色(<0.05); (2) 绿光组的糜蛋白酶活力(4.02 U/mgprot ± 0.38 U/mgprot)最高; 全光谱组的α-淀粉酶(α-AMS)活力(213.95 U/mgprot ± 16.30 U/mgprot)最高, 与绿光组和黑暗组之间差异不显著(>0.05); 黄光组的脂肪酶(LPS)活力(19.21 U/gprot ± 2.53 U/gprot)最高, 与黑暗组、绿光组和蓝光组之间差异不显著(>0.05); (3) 绿光组的总超氧化物歧化酶(T-SOD)活力(33.26 U/mgprot ± 7.08 U/mgprot)和总抗氧化能力(T-AOC)活力(2.31 单位/mgprot ± 0.23 单位/mgprot)均最高, 与全光谱组之间差异不显著(>0.05); 全光谱组的过氧化氢酶(CAT)活力(17.27 U/mgprot ± 1.58 U/mgprot)、酸性磷酸酶(ACP)活力(27.10金氏单位/gprot ± 3.25金氏单位/gprot)和碱性磷酸酶(AKP)活力(74.26金氏单位/gprot ± 5.16金氏单位/gprot)均最高; 黄光组的溶菌酶(LZM)活力(485.48 U/mL ± 36.85 U/mL)最高。结果表明: 本试验规格的脊尾白虾生长和非特异性免疫能力在全光谱下最好, 消化能力在绿光下较好。本研究可为脊尾白虾生长与免疫机制的基础理论研究提供参考依据。
脊尾白虾(); 光色; 生长; 消化; 非特异性免疫
光是影响水生生物生长、摄食和存活的重要环境因素[1], 包括光色、光照强度和光照周期。水生生物的趋光性与其感光器官的构成以及发育程度密切相关, 不同物种及其不同发育阶段, 趋光性也有所不同[2-4]。有研究表明, 绝大多数虾蟹类幼体阶段对光呈正反应, 成体阶段对光呈负反应[5], 且与光照强度也密切相关。目前已有研究证明光对虾的生长、发育、摄食、存活等有着直接或间接的影响[6-7]。Wang等[7]研究表明不同的光照条件对中国对虾()的生长和蜕皮有显著性影响, 且在蓝光条件下最显著。Guo等[8-9]研究发现凡纳滨对虾()在从蓝光到绿光周期性变化或规律变化的照明条件下, 展现出了最大的特定生长率(SGR)。Upadhyay等[10]研究发现罗氏沼虾()的行动能力, 在红光、蓝光和绿光组合下高于在黄光、白光或乳白光组合下。也有研究发现罗氏沼虾幼体对颜色感知阈值在0.07 CD/m2和0.02 CD/m2之间, 更倾向于蓝光和白光, 而不是红光和黄光[11]。可见, 不同的虾对不同光色的感受能力是有差异的。
脊尾白虾()作为我国重要的经济虾类之一, 在生长、生理、生态、免疫等方面也是较好的模式生物, 目前在温度[12]、盐度[13-14]、养殖密度[15]等方面的研究已有诸多报道, 但未见光照条件(光色、光照强度和光照周期)对脊尾白虾的影响的研究。因此, 本研究以脊尾白虾为研究对象, 研究了不同光色对其生长、消化和非特异性免疫相关酶活力的影响, 以期了解脊尾白虾生长与免疫学特征并为揭示其机制提供理论基础, 对未来开展脊尾白虾集约化(工厂化)养殖光照条件参数的选择也具有重要参考意义。
1 材料和方法
1.1 试验材料
脊尾白虾取自连云港市赣榆区养殖塘口, 在实验室暂养一周, 再进行光照试验(2020年10月23日至11月22日)。挑选(体长4.34 cm±0.07 cm, 体质量1.066 g±0.002 g)活泼、健康、无创伤的脊尾白虾用于试验。
1.2 试验设计
设计了5组不同光照环境(黑暗; 全光谱, 波长390~780 nm; 绿光, 波长510~520 nm; 蓝光, 波长450~480 nm和黄光, 波长585~595 nm; 水面光照强度800 lx±50 lx, 箱底光照强度250 lx±50 lx, 光照周期L︰D=12︰12), 黑暗组作为对照, 每组3个重复。试验在白色养殖箱(55 cm×45 cm×35 cm, 水体积: 62 L)中进行, 每组30尾虾, 按照体重2%投喂配合饲料(粗蛋白: 35%, 粗脂肪: 6%), 并搭配冰鲜卤虫配合投喂, 每天8: 00(占30%~40%)和18: 00(占60%~70%)各喂1次, 根据其摄食情况进行适当增减。2 h之内, 将剩余饵料和粪便清除。每隔2 d换水1次, 换水量为1/3。水质各项指标: 温度25 ℃±1 ℃(使用加热棒增温、控温), 盐度27±1, pH值8.0±0.2。定期检测溶解氧、氨氮和亚硝酸盐氮等浓度, 确保虾的生存环境符合安全标准。养殖30 d后进行生长、消化和非特异性免疫相关指标的测定。
1.3 生长指标的测定
试验开始时, 每组随机取10尾虾, 测量体长和体重并记录。试验结束时, 各组随机选取5尾虾, 测量体长和体重并记录, 用于增重率(WGR)、特定生长率(SGR)和存活率(SR)的计算。
计算公式如下:
WGR(%)=[(–0)/0]×100, (1)
SGR(%/d)=(ln– ln0)/×100, (2)
SR(%)=[(2–1)/1]×100, (3)
其中,0为脊尾白虾试验初重,为脊尾白虾试验末重,为试验天数;1和2分别为试验前和试验后虾的尾数。
1.4 样本收集和酶活测定
每组分别取适量的脊尾白虾胃和肝胰腺组织于试管中, 加入9倍的预冷生理盐水并加入破碎珠, 用封口膜包紧管口, 用组织样品捣碎仪FastPrep-24粉碎, 4 ℃下2 000 r/min离心10~15 min, 上清液保存于–20 ℃冰箱中待测。胃部组织用于测定消化酶, 包括: 糜蛋白酶、α-淀粉酶(α-AMS)和脂肪酶(LPS); 肝胰腺组织用于测定非特异性免疫酶, 包括: 总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和溶菌酶(LZM)。所有酶活力测定均严格按照由南京建成生物工程研究所生产的试剂盒说明书进行。
1.5 数据分析
采用SPSS 26.0软件进行单因素方差分析(One- way ANOVA), 比较组间的差异性,<0.05表示差异显著。所有试验数据采用平均值±标准差(Mean±SD)表示, 酶活指标相关数据采用Origin 2017软件制作图表。
2 结果与分析
2.1 不同光色对脊尾白虾生长的影响
不同光色对脊尾白虾生长和存活的影响存在显著差异(<0.05)(表1)。最终表现为全光谱组>绿光组>黑暗组>蓝光组>黄光组, 全光谱组的(1.743 g±0.004 g)为最高, 显著高于其他4种光色(< 0.05); 黄光组的(1.230 g±0.003 g)为最低。WGR、SGR和SR均表现为全光谱组>绿光组>黑暗组>蓝光组>黄光组, 全光谱组的WGR(63.76%±0.34%)、SGR(1.63%±0.03%)和SR(61.11%±1.92%)为最高, 均显著高于其他4种光色(<0.05); 黄光组的WGR (14.97%±0.26%)、SGR(0.47%±0.01%)和SR(37.78%± 1.92%)为最低。
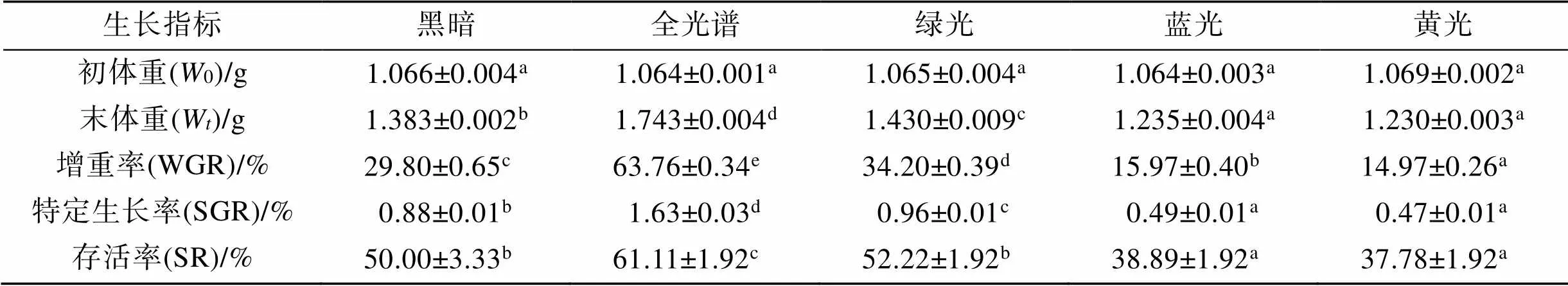
表1 不同光色对脊尾白虾生长的影响
注: 同一行上标不同字母表示不同光照下该指标差异显著(<0.05), 相同字母表示差异不显著(>0.05)。
2.2 不同光色对脊尾白虾消化酶相关活力的影响
不同光色对脊尾白虾消化相关酶活力的影响存在显著差异(<0.05)(图1~图3)。糜蛋白酶活力表现为绿光组>黄光组>蓝光组>黑暗组>全光谱组, 绿光组的糜蛋白酶活力(4.02 U/mgprot ± 0.38 U/mgprot)显著高于其他4种光色; 全光谱组的糜蛋白酶活力(1.17 U/mgprot ± 0.17 U/mgprot)为最低。α-AMS活力表现为全光谱组>绿光组>黑暗组>黄光组>蓝光组, 全光谱组的α-AMS活力(213.95 U/mgprot±16.30 U/mgprot)为最高, 与黑暗组和绿光组之间差异不显著(> 0.05)。LPS活力表现为黄光组>绿光组>黑暗组>蓝光组>全光谱组, 黄光组的LPS活力(19.21 U/gprot ±2.53 U/gprot)为最高, 与黑暗组、绿光组和蓝光组之间差异不显著(>0.05)。全光谱组的LPS活力(13.36 U/gprot ± 2.57 U/gprot)为最低, 与黑暗组和蓝光组之间差异也不显著(>0.05)。

图1 不同光色对脊尾白虾糜蛋白酶活力的影响
注: 图中柱上标不同字母表示不同光照下酶活力差异显著(< 0.05), 相同字母表示差异不显著(>0.05), 下同。

图2 不同光色对脊尾白虾α-AMS活力的影响

图3 不同光色对脊尾白虾LPS活力的影响
2.3 不同光色对脊尾白虾非特异性免疫指标的影响
不同光色对脊尾白虾肝胰腺组织中的抗氧化酶活力的影响存在显著差异(<0.05)(图4~图6)。T-SOD活力表现为绿光组>全光谱组>黄光组>黑暗组>蓝光组, 绿光组的T-SOD活力(33.26 U/mgprot ± 7.08 U/mgprot)为最高, 与黑暗组、全光谱组和黄光组之间差异不显著(>0.05); 蓝光组的T-SOD活力(20.56 U/mgprot ± 2.36 U/mgprot)为最低, 且其他4种光色组差异显著(<0.05)。CAT活力表现为全光谱组>绿光组>黑暗组>黄光组>蓝光组, 全光谱组的CAT活力(17.27 U/mgprot ± 1.58 U/mgprot)为最高, 显著高于其他4种光色(<0.05); 蓝光组的CAT活力(5.43 U/mgprot ± 1.18 U/mgprot)为最低。T-AOC活力表现为绿光组>全光谱组>黑暗组>蓝光组>黄光组, 绿光组的T-AOC活力(2.31单位/ mgprot ± 0.23单位/mgprot)为最高, 与全光谱组差异不显著(>0.05); 黄光组的T-AOC活力(0.65单位/mgprot ± 0.13单位/mgprot)为最低。

图4 不同光色对脊尾白虾T-SOD活力的影响

图5 不同光色对脊尾白虾CAT活力的影响

图6 不同光色对脊尾白虾T-AOC活力的影响
不同光色对脊尾白虾肝胰腺组织中的免疫防御(抗菌)酶活力的影响也存在显著差异(<0.05)(图7~图9)。ACP活力表现为全光谱组>绿光组>黑暗组>蓝光组>黄光组, 全光谱组的ACP活力(27.10金氏单位/ gprot ± 3.25金氏单位/gprot)为最高, 显著高于其他4种光色(<0.05); 黄光组的ACP活力(8.65金氏单位/ gprot ± 0.38金氏单位/gprot)为最低。AKP活力表现为全光谱组>绿光组>蓝光组>黄光组>黑暗组, 全光谱组的AKP活力(74.26金氏单位/gprot ± 5.16金氏单位/ gprot)为最高, 显著高于其他4种光色(<0.05); 黑暗组的AKP活力(20.65金氏单位/gprot ± 5.60金氏单位/gprot)为最低。LZM活力表现为黄光组>绿光组>全光谱组>黑暗组>蓝光组(280.20 U/mL ± 24.00 U/mL), 黄光组的LZM活力(485.48 U/mL ± 36.85 U/mL)为最高, 显著高于其他4种光色(<0.05); 蓝光组的LZM活力(280.20 U/mL ± 24.00 U/mL)为最低。
3 讨论
3.1 不同光色对脊尾白虾生长的影响
在实际的养殖生产中, 特别是集约化(工厂化)养殖, 光的变化必然会影响水产动物的生长[7]。Wang等[7]在中国对虾、邓慧芳[16]在克氏原鳌虾()和游奎[17]在凡纳滨对虾的研究中以及本研究在脊尾白虾中均发现, 在全光谱下虾的WGR和SGR最好。但是有学者研究发现, 日本囊对虾()的SGR和蜕壳率(MF)在全黑暗条件下最好[18], 凡纳滨对虾的WGR和SGR在绿光水体(通过添加色素改变水色)中最好[19]。本研究还发现, 脊尾白虾在蓝光下生长表现较差, Wang等[7]和管崇武等[19]在凡纳滨对虾的研究中也得到了相似的结果。由此可见, 不同虾类的生长受不同光色的影响具有差异性, 并且也受不同生长发育阶段、养殖环境等条件的影响。有研究指出, 养虾池海水中的高浮游生物密度和高溶解有机水平导致透光率下降, 尤其是蓝光, 并且有机贫乏池塘的底部可能比有机丰富池塘的水具有更高的蓝光水平, 因此导致了虾在有机丰富池塘水中更好的生长[7], 这也说明了本研究中在蓝光下的虾生长表现和存活率较低的原因。

图7 不同光色对脊尾白虾ACP活力的影响

图8 不同光色对脊尾白虾AKP活力的影响

图9 不同光色对脊尾白虾LZM活力的影响
3.2 不同光色对脊尾白虾消化相关酶活力的影响
水生生物消化相关酶活力与其生活环境以及食性密切相关。有研究指出, 虾蟹类的X器官-窦腺复合体和眼柄会受到外界环境的影响, 进而调控消化酶的活力[20-21]。而不同的光照环境必然会对水生生物的生活习性产生影响, 影响其消化酶的活力。消化酶包括蛋白酶、AMS和LPS等, 蛋白酶可以水解蛋白质产生氨基酸, 促进水生生物吸收养分[22]; AMS主要催化水解淀粉和糖原[23]; LPS可以帮助水生生物催化水解脂肪, 转化为生长所需的能量[24]。
本试验结果显示, 脊尾白虾在绿光下糜蛋白酶活力最高, 有学者在豹纹鳃棘鲈()幼鱼[25]的研究中得到了相似的结果。有研究发现, 中国对虾稚虾的AMS活力在不同光照下差异不显著[26], 豹纹鳃棘鲈幼鱼的AMS在白光(全光谱)组中最高[25], 这些研究结果的变化规律均与本研究相似。然而, 本试验结果中的脊尾白虾的LPS活力在全光谱下最低, 有研究表明, 南美白对虾()的LPS活性受组织pH的影响[27], 故推测在全光谱下, 虾胃部pH发生了变化, 导致了LPS活性降低。同时, 本研究中各试验组的脊尾白虾消化相关酶活力大小差异规律, 与其生长结果并不完全一致, 其他学者在克氏原鳌虾[28]、军曹鱼()仔鱼[29]的研究也得到了相同的结论。结果表明不同酶的合成和分泌机制可能不同。
3.3 不同光色对脊尾白虾非特异性免疫指标的影响
脊尾白虾因缺乏特异性免疫能力, 只能通过自身非特异性免疫系统识别和消除病原体[12]。非特异性免疫系统中抗氧化酶的活力水平是水生生物氧化应激的潜在指标[30]。已有研究表明, 甲壳类动物机体的内在生理机制极易受到外界因素的影响[31]。水生生物在规模化、集约化等养殖过程中受到环境胁迫, 活性氧(ROS)水平就会增加, 机体会增加超氧化物歧化酶(SOD)、CAT等抗氧化酶以分解过多的ROS, 避免或减少其对机体的氧化损伤[32]。本试验结果显示, 绿光组的T-SOD和T-AOC活力最高, 全光谱组的CAT活力最高, 这与秦菲在凡纳滨对虾中的研究结果相似[33]。而黄光组T-SOD、CAT和T-AOC活力均较低, 可能是因为机体受损程度较大, 用于歧化过量产生的超氧根离子(O2–)的能量不足, 进而导致了活力降低[34]。然而, 也有研究指出, 机体组织ROS的过量产生会导致非特异性免疫酶活性的增加[35], 具体的内在机制需要进一步研究和探讨。
磷酸酶(AKP和ACP)和LZM也是非特异性免疫因子中的重要成员, 是动物体内重要的解毒免疫酶, 在免疫防御中具有重要作用。磷酸酶通过改变侵入性病原体的表面分子结构, 加速吞噬细胞的吞噬作用, 最终杀死侵入性病原体[36]; 同时还具有消化作用[37], 与水生生物的生长表现密切相关[38]。而LZM则是在免疫过程中催化细菌细胞壁的水解和诱导其他免疫因子的合成和分泌[39]。本研究在脊尾白虾和秦菲在凡纳滨对虾[34]的研究中均发现ACP和AKP活力在全光谱下最高, 而且WGR和SGR也最好, 说明磷酸酶活性的增加也促进了虾的生长。目前有最新研究指出, 海水对可见光光谱波段中的红色、黄色和淡绿色光谱的吸收十分显著[40], 这可以说明在黄光照射下的脊尾白虾受到了较大的环境胁迫, 故导致黄光组的虾LZM活力较高, 而磷酸酶活力较低, 这也可能是黄光组虾生长表现和存活率较低的原因, 具体影响机制有待进一步研究和探讨。
4 结论
综上所述, 不同光色对脊尾白虾的生长、消化和非特异性免疫相关指标均有显著影响, 在全光谱条件下脊尾白虾生长表现和非特异性免疫能力最好, 而消化能力绿光下较好。而绿光在养殖过程中是否可以作为补充光源以及如何补充, 并且不同的光色、光照强度和光照周期对其不同生长发育阶段的生长、消化和非特异性免疫机制的影响如何, 后期需要做进一步研究。
[1] GAO X L, LI X, ZHANG M, et al. Effects of LED light quality on the growth, survival and metamorphosis oflarvae[J]. Aquaculture Research, 2016, 47(12): 3705-3717.
[2] 王孟孟, 王慧欣, 郭林豪, 等. 甲壳动物免疫系统网络关系模型[J]. 河北大学学报(自然科学版), 2017, 37(3): 281-286, 321.
WANG Mengmeng, WANG Huixin, GUO Linhao, et al. Network relationship model of crustacean immune system[J]. Journal of Hebei University (Natural Science Edition), 2017, 37(3): 281-286, 321.
[3] FANJUL-MOLES M L, MIRANDA-ANAYA M, FUENTES-PARDO B. Effect of monochromatic light upon the erg crcadian rhythm during ontogeny in crayfish ()[J]. Comparative Biochemistry & Physiology Part A Physiology, 1992, 102(1): 99- 106.
[4] 魏开建, 张桂蓉, 张海明. 鳜鱼不同生长阶段中趋光特性的研究[J]. 华中农业大学学报, 2001(2): 164-168.
WEI Kaijian, ZHANG Guirong, ZHANG Haiming. Phototaxis ofin different growth stages[J]. Journal of Huazhong Agricultural University, 2001, 2: 164-168.
[5] FUSS C M. Observations on Burrowing Behavior of the Pink Shrimp,Burkenroad[J]. Bulletin of Marine Science (Miami), 1964, 14(1): 62-73.
[6] COYLE S D, BRIGHT LA, WOOD D R, et al. Performance of Pacific white shrimp,, reared in zero-exchange tank systems exposed to different light sources and intensities[J]. Journal of The World Aquaculture Society, 2011, 42(5): 687-695.
[7] WANG F, DONG S L, HUANG G Q, et al. The effect of light color on the growth of Chinese shrimp[J]. Aquaculture, 2003, 228(1): 351- 360.
[8] GUO B, WANG F, DONG S L, et al. The effect of rhythmic light color fluctuation on the molting and growth of[J]. Aquaculture, 2011, 314(1): 210-214.
[9] GUO B, MU Y C, WANG F, et al. Effect of periodic light color change on the molting frequency and growth of[J]. Aquaculture, 2012, 362/363: 67-71.
[10] UPADHYAY A S, KULKARNI B G, PANDEY A K. Migration in prawns with special reference to light and water current as inducers in[J]. Journal of Experimental Zoology India, 2014, 17(1): 33-48.
[11] DOWNS C A, FAUTH J E, WOODLEY C M. Assessing the health of grass shrimp () exposed to natural and anthropogenic stressors: A Molecular biomarker system[J]. Mar Biotechnol, 2001, 3(4): 380-397.
[12] 李志辉, 王玉, 李光光, 等. 温度和盐度对脊尾白虾生长和非特异性免疫的影响[J]. 海洋湖沼通报, 2019, 6: 78-82.
LI Zhihui, WANG Yu, LI Guangguang, et al. Effects of temperature and salinity on growth and nonspecific immunity of[J]. Transactions of Oceanology and Limnology, 2019, 6: 78-82.
[13] 李玉全, 李永生, 赵法箴. 盐度渐变与骤变对脊尾白虾渗透、代谢及免疫相关酶活力的影响[J]. 生态学报, 2015, 35(21): 7229-7235.
LI Yuquan, LI Yongsheng, ZHAO Fazhen. Effects of salinity gradients and abrupt changes on osmotic, metabolic and immune related enzyme activities of[J]. Acta Ecologica Sinica, 2015, 35(21): 7229-7235.
[14] 王庚申, 谢建军, 施慧, 等. 盐度对脊尾白虾生长及肝胰腺消化酶活力的影响[J]. 水产科学, 2014, 33(7): 451-454.
WANG Gengshen, XIE Jianjun, SHI Hui, et al. Effects of salinity on growth and hepatopancreatic digestive enzyme activities of[J]. Fisheries Science, 2014, 33(7): 451-454.
[15] 李志辉, 马杭柯, 张培, 等. 不同养殖密度对脊尾白虾生长和水体氨氮含量的影响[J]. 海洋渔业, 2018, 40(5): 581-586.
LI Zhihui, MA Hangke, ZHANG Pei, et al. Effects of different culture densities on growth and ammonia nitrogen content of[J]. Marine fisheries, 2018, 40(5): 581-586.
[16] 邓慧芳. 不同光照和饲料对克氏原螯虾生长、非特异性免疫酶及体成分的影响[D]. 荆州: 长江大学, 2018.
DENG Huifang. Effects of different light and feed on growth, non-specific immune enzymes and body composition of[D]. Jingzhou: Changjiang University, 2018.
[17] 游奎, 杨红生, 刘鹰, 等.不同光源及光照时间对凡纳滨对虾()游离虾青素含量及生长的影响[J]. 海洋与湖沼, 2005, 36(4): 296-301.
YOU Kui, YANG Hongsheng, LIU Ying, et al. Effects of different light sources and illumination time on free astaxanthin content and growth of[J]. Oceanologia Et Limnologia Sinica, 2005, 36(4): 296-301.
[18] 王想, 任宪云, 绳秀珍, 等. 不同光照周期对日本囊对虾生长、蜕皮和糖代谢的影响[J]. 渔业科学进展, 2020, 41(6): 66-73.
WANG Xiang, REN Xianyun, SHENG Xiuzhen, et al. Effects of different light cycles on growth, molting and sugar metabolism of[J]. Progress in Fishery Sciences, 2020, 41(6): 66-73.
[19] 管崇武, 宋红桥, 杨菁, 等. 水色和透明度对循环水养殖凡纳滨对虾生长及生理指标的影响[J]. 渔业现代化, 2019, 46(5): 35-40.
GUAN Chongwu, SONG Hongqiao, YANG Jing, et al. Effects of water color and transparency on growth and physiological indexes of[J]. Fishery Modernization, 2019, 46(5): 35-40.
[20] HOANG T, LEE S Y, KEENAN C P, et al. Ovarian maturation of the banana prawn,de Man under different light intensities[J]. Aquaculture, 2002, 208(1/2): 159-168.
[21] HOANG T, LEE S Y, KEENAN C P, et al. Effects of light intensity onmaturation and spawning of ablated female[J]. Aquaculture, 2002, 209(1): 347- 358.
[22] 于书坤. 饲料蛋白酶的最新研究与应用进展[J]. 饲料工业, 2019, 40(10): 22-26.
YU Shukun. The latest research and application progress of feed protease[J]. Feed Industry, 2019, 40(10): 22-26.
[23] 罗春雷, 韦宇拓. 淀粉酶的分类及应用研究进展[J]. 广西科学, 2018, 25(3): 248-252.
LUO Chunlei, WEI Yutuo. Research progress on classification and application of amylase[J]. Guangxi Science, 2018, 25(3): 248-252.
[24] 王自社, 张继, 马君义, 等. 脂肪酶的研究及应用进展[J]. 安徽农业科学, 2011, 39(7): 3798-3800, 3855.
WANG Zishe, ZHANG Ji, MA Junyi, et al. Research and application progress of lipase[J]. Journal of Anhui Agricultural Sciences, 2011, 39(7): 3798-3800, 3855.
[25] 陈婉情. 5种光色对豹纹鳃棘鲈幼鱼生长特征及生理生化功能的影响[D]. 上海: 上海海洋大学, 2016.
CHEN Wanqing. Effects of five light colors on growth characteristics and physiological and biochemical functions of juvenile[D]. Shanghai: Shanghai Ocean University, 2016.
[26] 王芳, 宋传民, 丁森, 等. 光照对中国对虾稚虾3种消化酶活力的影响[J]. 中国水产科学, 2006, 6: 1028- 1032.
WANG Fang, SONG Chuanmin, DING Sen, et al. Effects of light on the activities of three digestive enzymes in juvenile[J]. Journal of Fishery Sciences of China, 2006, 6: 1028-1032.
[27] 黄燕华, 王国霞, 刘襄河, 等. 温度和pH对南美白对虾主要消化酶活性的影响[J]. 华南农业大学学报, 2008, 29(4): 87-90, 94.
HUANG Yanhua, WANG Guoxia, LIU Xianghe, et al. Effects of temperature and pH on digestive enzyme activity of[J]. Journal of South China Agricultural Univerdity, 2008, 29(4): 87-90, 94.
[28] 何吉祥. 不同能量蛋白比饲料对克氏螯虾生长及消化酶活力的影响[D]. 合肥: 安徽农业大学, 2008.
HE Jixiang. Effects of diets with different energy protein ratios on growth and digestive enzyme activities of[D]. Hefei: Anhui Agricultural University, 2008.
[29] 汤保贵, 陈刚, 张健东, 等. 饵料系列对军曹鱼仔鱼生长、消化酶活力和体成分的影响[J]. 水生生物学报, 2007, 31(4): 479-484.
TANG Baogui, CHEN Gang, ZHANG Jiandong, et al. Effects of diets on growth, digestive enzyme activities and body composition oflarvae[J]. Acta hydrobiologica Sinica, 2007, 31(4): 479- 484.
[30] CAMPA-CORDOVA A I, NUNEZ-VAZQUEZ E J, LUNA-GONZALEZ A, et al. Superoxide dismutase activity in juvenileandexposed to the toxic dinoflagellate Prorocentrum lima[J]. Comparative biochemistry and physiology. Toxicology & pharmacology: CBP, 2009, 149(3): 317-322.
[31] LIMON-PACHECO J, GONSEBATT M. The role of antioxidants and antioxidant-related enzymes in protective responses to environmentally induced oxidative stress[J]. Mutation research, 2009, 674(1): 137-147.
[32] TASSANAKAJON A, SOMBOONWIWAT K, SUPUNGUL P, et al. Discovery of immune molecules and their crucial functions in shrimp immunity[J]. Fish & Shellfish Immunology, 2012, 34(4): 954-967.
[33] 秦菲. 凡纳滨对虾工厂化养殖光照环境优化技术研究[D]. 青岛: 青岛理工大学, 2018.
QIN Fei. Study on Optimization Technology of illumination environment for industrial culture of[D]. Qingdao: Qingdao University of technology, 2018.
[34] 张胜负, 乔振国. 光照条件对养殖虾蟹类幼体生长发育影响的研究进展[J]. 现代渔业信息, 2009, 24(9): 25-27.
ZHANG Shengfu, QIAO Zhenguo. Research progress on the effects of light conditions on the growth and development of cultured shrimp and crab larvae[J]. Fishery Information and Stratery, 2009, 24(9): 25-27.
[35] 李效宇, 刘永定, 宋立荣, 等. 鲤肝细胞抗氧化系统对微囊藻毒素毒性的反应[J]. 水生生物学报, 2003, 27(5): 472-475.
LI Xiaoyu, LIU Yongding, SONG Lirong, et al. Response of antioxidant system in carp hepatocytes to microcystin toxicity[J]. Acta Hydrobiologica Sinica, 2003, 27(5): 472-475.
[36] 邓慧芳. 不同光照和饲料对克氏原螯虾生长、非特异性免疫酶及体成分的影响[D]. 武汉: 长江大学, 2018.
DENG Huifang. Effects of different light and feed on growth, non-specific immune enzymes and body composition of[D]. Wuhan: Changjiang University, 2018.
[37] 周永灿. 海洋贝类病害及其研究进展[J]. 海南大学学报(自然科学版), 2000, 2: 207-212.
ZHOU Yongcan. Marine shellfish diseases and their research progress[J]. Journal of Hainan University (Natural Science Edition), 2000, 2: 207-212.
[38] 胡利华, 闫茂仓, 郑金和, 等. 盐度对日本鳗鲡生长及非特异性免疫酶活性的影响[J]. 台湾海峡, 2011, 30(4): 528-532.
HU Lihua, YAN Maocang, ZHENG Jinhe, et al. Effects of salinity on growth and non-specific immune enzyme activity of Anguilla japonica[J]. Taiwan Strait, 2011, 30(4): 528-532.
[39] 郑清梅, 吴锐全, 叶星. 水生动物溶菌酶的研究进展[J]. 上海水产大学学报, 2006, 15(4): 483-487.
ZHENG Qingmei, WU Ruiquan, YE Xing. Research progress of lysozyme in aquatic animals[J]. Journal of Shanghai Ocean University, 2006, 15(4): 483-487.
[40] 张延青, 秦菲, 费凡, 等. LED光源在海水养殖水体中传播特征解析[J]. 渔业科学进展, 2020, 41(1): 153-161.
ZHANG Yanqing, QIN Fei, FEI Fan, et al. Analysis on propagation characteristics of LED light source in mariculture water[J]. Progress in Fishery Sciences, 2020, 41(1): 153-161.
Effects of different illumination on the growth, digestion, and nonspecific immune-related enzyme activities of
LIU Sen1, JIANG Hai-yi1, QIN Feng1, HU Ji-hui1, LAI Xiao-fang1, 2, 3,ZHANG Qing-qi4, GAO Huan1, 2, 3
(1. College of Marine Science and Fisheries/Key Laboratory of Marine Biological Resources and Environment of Jiangsu Province, Jiangsu Ocean University, Lianyungang 222005, China; 2. Jiangsu Marine Biological Industry Technology Collaborative Innovation Center, Lianyungang 222005, China; 3. Jiangsu Provincial Agricultural Germplasm Resources Protection and Utilization Platform, Nanjing 210014, China; 4. Lianyungang Ganyu Jiaxin Aquatic Products Development Co., Ltd., Lianyungang 222100, China)
To investigate the effects of light color on the growth and immunity of aquatic organisms, the effects of five light colors on the growth, digestion, and nonspecific immune related enzyme activities ofwere studied. The results showed that the (1) The weight gain rate (63.76% ± 0.34%), specific growth rate (1.63% ± 0.03%) and survival rate (61.11% ± 1.92%) of the full spectrum group were significantly higher than those of other groups exposed to other four light colors (<0.05). (2) The chymotrypsin activity (4.02 ± 0.38 U/mgprot) of the green light group was the highest. The α-amylase (α-AMS) activity ((213.95 ± 16.30) U/mgprot) of the full spectrum group was the highest and was not significantly different from that of the dark group (>0.05). The lipase activity (19.21 ± 2.53 U/gprot) of the yellow light group was the highest and had no significant difference with that of the dark group, green light group, and blue light group (>0.05). (3) The total superoxide dismutase activity (33.26 ± 7.08 U/mgprot) and total antioxidant capacity activity (2.31 ± 0.23 units/mgprot) of the green light group were the highest and had no significant difference with those of the full spectrum group (>0.05). The activities of catalase (17.27 ± 1.58 U/mgprot), acid phosphatase (27.10 ± 3.25 Kim’s units/gprot), and alkaline phosphatase (74.26 ± 5.16 Kim’s units/gprot) of the full spectrum group were the highest. The lysozyme activity (485.48 ± 36.85 U/mL) of the yellow light group was the highest. The results indicate that a full spectrum is the best for growth and nonspecific immunity, and the green light is the best for the digestion ability of. This study can be a reference for basic theoretical research on the growth and immune mechanism of.
; light color; growth; digestion; nonspecific immunity
Feb. 9, 2021
S968.22
A
1000-3096(2022)04-0114-09
10.11759/hykx20210209001
2021-02-09;
2021-04-08
国家重点研发计划资助(“蓝色粮仓”) (2018YFD0901302); 江苏省优势学科建设工程资助项目; 江苏海洋大学江苏省海洋生物资源与环境重点实验室开放课题基金资助(SH20191203); 江苏省研究生科研与实践创新计划项目(SJCX20_1271)
[National Key R & D Program of China, No. 2018YFD0901302;A Project Funded by the Priority Academic Program Development of Jiangsu Higher Education Institutions No. PAPD; Open-end Funds of Jiangsu Key Laboratory of Marine Bioresources and Environment No. SH20191203; Postgraduate Research & Practice Innovation Program of Jiangsu Province No. SJCX20_1271]
柳森(1996—), 男, 黑龙江哈尔滨人, 硕士研究生, 主要从事水产养殖研究, E-mail: liusen0220@163.com; 高焕(1976—), 男,通信作者, 江苏连云港人, 博士, 教授, 主要从事海洋甲壳类种质资源研究, E-mail: huanmr@163.com
(本文编辑: 康亦兼)
