人参皂苷Rh2调控微小RNA-133a-3p对瘢痕疙瘩成纤维细胞凋亡的影响
2022-04-29周自广
周自广
瘢痕疙瘩是一种以纤维增生为特征的皮肤病,通常难以治愈,如果治疗不当,会导致病人出现严重的情绪和身体痛苦;其手术切除极易复发,现在多用药物进行治疗[1]。瘢痕疙瘩成纤维细胞(keloid fibroblasts,KF)的异常增殖和凋亡是导致瘢痕疙瘩的主要原因[2]。研究表明中药可以抑制瘢痕疙瘩成纤维细胞增殖,有效防治瘢痕疙瘩[3]。人参皂苷有多种有效单体成分,研究发现人参皂苷Rb1 能抑制活性细胞增殖,血管生成减少,胶原合成减少,有效改善兔耳瘢痕的增生[4]。人参皂苷R3 可诱导成纤维细胞凋亡,抑制病理学瘢痕的形成[5]。人参皂苷Rh2 能抑制肝癌细胞生长并促进其凋亡[6]。而人参皂苷Rh2对瘢痕疙瘩成纤维细胞凋亡的影响及其机制尚不清楚。miRNA 在瘢痕疙瘩的发展中发挥着不可替代的作用[7]。研究发现,miR-133a-3p 对胃癌细胞增殖[8]、结直肠癌细胞增殖[9]具有抑制作用,还能促进结直肠癌细胞凋亡[9]。然而miR-133a-3p 对瘢痕疙瘩成纤维细胞凋亡的影响也不清楚。本研究自2019年3—9月研究人参皂苷Rh2和miR-133a-3p对瘢痕疙瘩成纤维细胞凋亡的影响及其机制。
1 材料与方法
1.1 材料人参皂苷Rh2 购自西安瑞林生物科技有限公司;RNA 提取试剂盒、荧光定量试剂盒购自美国Progema 公司;miScript Reverse Transcription Ⅱ试剂盒购自上海Qiagen;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒购自江苏Beyotime Biotechnology;蛋白提取试剂盒、二辛可宁酸(bicinchoninic acid,BCA)试剂盒、RIPA 蛋白裂解液、膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙锭(PI)试剂盒购自北京Solarbio 公司;抗体购自北京博奥森生物科技有限公司。
1.2 方法
1.2.1 人瘢痕疙瘩成纤维细胞的分离培养无菌条件下将手术切除的人瘢痕疙瘩组织去除表皮及脂肪组织,用含100 U/mL 青霉素和100 g/L 链霉素的PBS洗涤3次,剪碎成组织微粒,后用DMEM 培养基置于37 ℃,含5%二氧化碳恒温箱培养,每2~3天换液一次,1 周后在显微镜下观察,待组织微粒周围有梭形细胞游出后,吸去组织块和培养液,换新鲜培养液继续培养,用苏木精-伊红染色鉴定确为瘢痕疙瘩成纤维细胞后继续继代培养,取对数生长期细胞用于实验。
1.2.2 细胞处理与分组取对数生长期KF,分别用浓度为50、100、200 mg/L的人参皂苷Rh2培养,未给人参皂苷Rh2 记为对照(NC)组;将miR-NC、miR-133a-3p 分别转染至KF 中记为miR-NC 组、miR-133a-3p组;将anti-miR-NC、anti-miR-133a-3p分别转染至KF 再用200 mg/L 的人参皂苷Rh2处理记为anti-miR-NC+人参皂苷Rh2 组、anti-miR-133a-3p+人参皂苷Rh2组。
1.2.3 流式细胞术检测细胞凋亡 Annexin V-FITC/PI 试剂盒用于检测KF 凋亡。各组KF 在25 ℃的黑暗环境中用Annexin V-FITC 和PI 染色10 min。在FACSCantoⅡ流式细胞仪上分析细胞凋亡率。
1.2.4 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测miR-133a-3p表达水平各组KF 培养48 h 后提取细胞总RNA,在RNA 被miScript Reverse Transcription Ⅱ试剂盒逆转录后,miRNA qRT-PCR 试剂盒用于测量miR-133a-3p 表达,PCR扩增反应在95 ℃30 s,60 ℃30 s;72 ℃30 s,40 cycles;60 ℃延长5 min的循环条件下进行。采用2-△△Ct法计算结果。引物序列为(5'-3'):miR-133a-3p 正向:ACACTCCAGCTGGGTTGGTCCCCTTCAACC,反向:CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACA;U6(内参)正向:CTCGCTTCGGCAGCACA, 反向 : AACGCTTCACGAATTTGCGT。
1.2.5 蛋白质印迹(Western blotting)法检测裂解的半胱氨酸天冬氨酸蛋白酶-3(Cleaved caspase-3)、β-连环素(β-catenin)蛋白表达各组KF 培养48 h后,将RIPA 裂解溶液在冰上裂解KF 20 min。使用BCA 试剂盒测量样品蛋白质浓度水平。将蛋白样品进行聚丙烯酰胺凝胶电泳后立即将其转移到聚偏二氟乙烯膜上,在25℃下,将蛋白与5%脱脂奶粉一起孵育1 h,在4 ℃下,使用一抗(1∶1 000)孵育蛋白12 h,然后与二抗(1∶2 000)室温孵育1.5 h,用ECL 发光液显影,用ChemiDoc XRS+系统成像,用Quantity One 凝胶分析以β 肌动蛋白(β-actin)为内参分析蛋白条带的灰度以检测表达差异。
1.3 统计学方法实验数据经SPSS 20.0 分析,计量资料用±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法,以P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度人参皂苷Rh2对KF凋亡的影响与对照组相比,50、100、200 mg/L 的人参皂苷Rh2培养KF 中细胞凋亡率升高[(9.08±0.91)%、(16.28±1.63)%、(23.18±2.32)%比(4.29±0.43)%,P<0.05]。
2.2 人参皂苷Rh2 对miR-133a-3p 表达的影响与对照组(1.00±0.10)相比,200 mg/L 人参皂苷Rh2组miR-133a-3p 表达水平(3.64±0.36)升高(t=12.24,P<0.05)。
2.3 高表达miR-133a-3p 对KF 凋亡的影响 miR-133a-3p组KF中miR-133a-3p表达水平比miR-NC组升高,Cleaved caspase-3 表达水平也比miR-NC 组升高,细胞凋亡率比miR-NC 组升高(P<0.05)。见图1,表1。
表1 高表达miR-133a-3p对KF凋亡的影响/±s

表1 高表达miR-133a-3p对KF凋亡的影响/±s
注:Cleaved caspase-3为裂解的半胱氨酸天冬氨酸蛋白酶-3。
组别miR-NC miR-133a-3p t值P值重复次数33 miR-133a-3p 1.00±0.11 2.76±0.28 10.13 0.001 Cleaved caspase-3 0.32±0.03 0.86±0.09 9.86 0.001凋亡率/%4.37±0.44 15.72±1.57 12.06<0.001

图1 Western blotting检测高表达miR-133a-3p后Cleaved caspase-3蛋白表达
2.4 低表达miR-133a-3p 可以部分逆转人参皂苷Rh2 对KF 凋亡的影响与anti-miR-NC 组相比,anti-miR-133a-3p 组KF 中Cleaved caspase-3 表达水平降低,细胞凋亡率降低(P<0.05);anti-miR-133a-3p+人参皂苷Rh2组KF中miR-133a-3p表达水平比antimiR-NC+人参皂苷Rh2 组降低,Cleaved caspase-3 表达水平也比anti-miR-NC+人参皂苷Rh2 组降低,细胞凋亡率降低(P<0.05)(图2,表2)。
表2 低表达miR-133a-3p可以部分逆转人参皂苷Rh2对KF凋亡的影响/±s
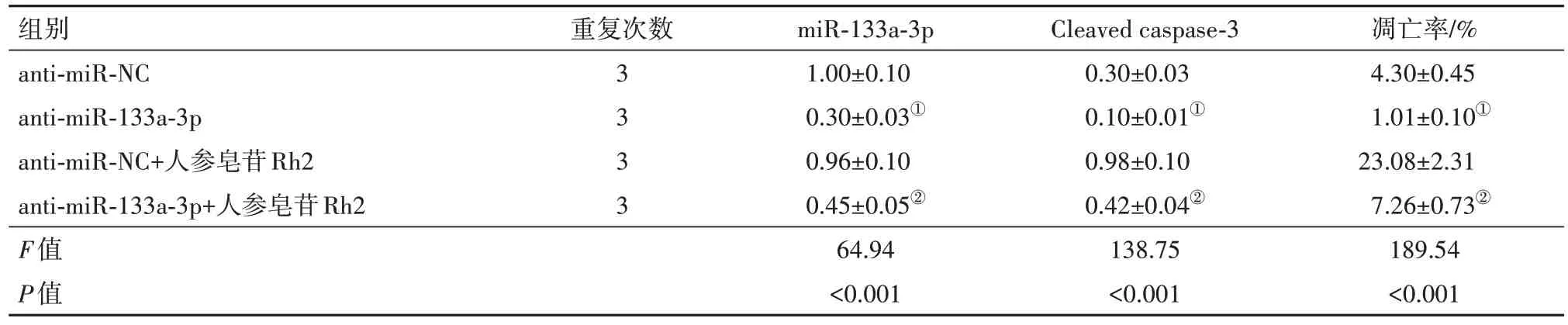
表2 低表达miR-133a-3p可以部分逆转人参皂苷Rh2对KF凋亡的影响/±s
注:Cleaved caspase-3为裂解的半胱氨酸天冬氨酸蛋白酶-3。①与anti-miR-NC比较,P<0.05。②与anti-miR-NC+人参皂苷Rh2比较,P<0.05。
组别anti-miR-NC anti-miR-133a-3p anti-miR-NC+人参皂苷Rh2 anti-miR-133a-3p+人参皂苷Rh2 F值P值重复次数3333 miR-133a-3p 1.00±0.10 0.30±0.03①0.96±0.10 0.45±0.05②64.94<0.001 Cleaved caspase-3 0.30±0.03 0.10±0.01①0.98±0.10 0.42±0.04②138.75<0.001凋亡率/%4.30±0.45 1.01±0.10①23.08±2.31 7.26±0.73②189.54<0.001

图2 低表达miR-133a-3p可以部分逆转人参皂苷Rh2对KF中Cleaved caspase-3蛋白的影响
2.5 Wnt/β-catenin 信号通路相关蛋白的表达人参皂苷Rh2 组KF 中β-catenin 表达水平低于NC 组[(0.38±0.04)比(0.80±0.08),P<0.05];anti-miR-133a-3p+人参皂苷Rh2 组KF 中β-catenin 高于antimiR-NC+人参皂苷Rh2 组[(0.71±0.07)比(0.42±0.05),P<0.05]。见图3。

图3 Western blotting检测β-catenin蛋白的表达
3 讨论
瘢痕疙瘩的治疗选择范围广泛,这些治疗方案都有各自优势,但副作用和复发的高风险仍然存在[10]。因此,确定用于治疗瘢痕疙瘩的改进的治疗方法或药物是紧迫且非常重要的。研究发现人参皂苷Rg3 处理后,KF 的增殖、迁移、侵袭、血管生成和胶原合成受到显著抑制,人参皂苷Rg3 可作为治疗瘢痕疙瘩病人的可靠药物[11]。人参皂苷Rg1能抑制心肌成纤维细胞的增殖,减少高糖培养心肌成纤维细胞胶原和TGF-β1的分泌,抑制Wnt信号通路的异常表达[12]。说明人参皂苷具有抑制瘢痕形成的作用,且可能与部分信号通路有关。还有研究发现人参皂苷Rh2通过下调Wnt/β-catenin信号通路抑制SHG44 细胞增殖,诱导细胞凋亡[13]。本研究结果显示,不同浓度人参皂苷Rh2处理的KF中细胞凋亡率升高。说明人参皂苷Rh2可促进瘢痕疙瘩成纤维细胞凋亡,也具有抑制瘢痕形成的作用。
研究发现上调miR-133a-3p 抑制食管鳞状细胞癌细胞增殖、迁移和侵袭,并促进细胞凋亡[14]。miR-133a-3p 过表达通过调控糖原磷酸化酶B(glycogen phosphorylase B,PYGB)/Wnt/β-catenin信号通路抑制卵巢癌细胞的增殖,侵袭和迁移[15]。本研究结果显示,过表达miR-133a-3p,Cleaved caspase-3表达水平升高,细胞凋亡率升高。说明过表达miR-133a-3p 可促进瘢痕疙瘩成纤维细胞凋亡。且人参皂苷Rh2培养KF 后,miR-133a-3p表达增强,人参皂苷Rh2对KF 凋亡的促进作用被低表达miR-133a-3p所部分逆转。表明人参皂苷Rh2 可能通过上调miR-133a-3p表达促进瘢痕疙瘩成纤维细胞凋亡。
Wnt/β-catenin 信号通路在细胞增殖、迁移和凋亡中起重要作用,β-catenin 是该信号通路发关键因子,β-catenin 高表达可激活Wnt/β-catenin 信号通路,进而促进细胞增殖,抑制细胞凋亡[16]。Wnt/βcatenin 信号通路与病理性瘢痕的形成密切相关[17]。研究发现沉默β-catenin 能够抑制瘢痕疙瘩成纤维细胞增殖并促进其凋亡[18]。本研究数据表明,人参皂苷Rh2 处理的KF 中β-catenin 表达水平降低,低表达miR-133a-3p 部分逆转了人参皂苷Rh2 对βcatenin 的抑制作用。以上结果表明,人参皂苷Rh2可抑制Wnt/β-catenin 信号通路激活,其可能是通过调控miR-133a-3p实现的。
综上所述,人参皂苷Rh2 可促进瘢痕疙瘩成纤维细胞凋亡,其机制可能与miR-133a-3p 和Wnt/βcatenin信号通路有关。
