鉴别烟草属植物的特异PCR引物研究
2022-04-29童治军张轲孙浩巍张晓伟方敦煌曾建敏陈学军陈丹龙杰张冀武蔡洁云王春琼肖炳光
童治军,张轲,孙浩巍,张晓伟,方敦煌,曾建敏,陈学军,陈丹,龙杰,张冀武,蔡洁云,王春琼,肖炳光*
生物技术
鉴别烟草属植物的特异PCR引物研究
童治军1,张轲2,孙浩巍2,张晓伟2,方敦煌1,曾建敏1,陈学军1,陈丹2,龙杰2,张冀武2,蔡洁云2,王春琼2,肖炳光1*
1云南省烟草农业科学研究院/烟草行业烟草生物技术育种重点实验室/国家烟草基因工程研究中心,云南昆明 650021;2云南省烟草质量监督检测站,云南昆明 650106
【】为科学、高效鉴别检测涉案制烟原料中是否含有烟草材料。利用公共数据库中烟碱代谢途径相关基因序列和茄科基因组数据(含烟草未公开数据)开发分子标记,通过对3个烟草亚属11个组的91份烟草材料和17份非烟草材料进行实验验证,获得烟草属特异性扩增分子标记。从209对新开发的引物中筛选出2对稳定、可靠且具有烟草属特异性的标记,在91份烟草材料中均有目的扩增片段,而在17份非烟草材料中无扩增产物。上述2对烟草属特异性标记实现了烟草与非烟草材料的快速、有效鉴别检测,且方法简便易行、操作性强,可应用于烟草行业打假缉私工作中涉案制烟原料的鉴别检验。
涉案制烟原料;烟碱;烟草属特异性标记
随着我国中式卷烟的发展,制烟原料的基础性地位日益凸显,在巨额利益的驱使下,大量涉及制烟原料的打假缉私案件(即涉案原料中含有烟草材料)仍层出不穷,给现行的涉案制烟原料[2]鉴别检验工作带来了新的挑战。
目前,在分子水平上对烟草资源(品种)鉴别检测的研究报道较多,如利用RFLP[3-5]、RAPD[6-7]、SSR[8-12]、ISSR[13]、DArT[14]、SNP[15-16]等标记对烟草资源(品种)开展遗传多样性分析、指纹图谱构建。对已知待测样品属于烟草材料的鉴别检测也有少量报道,如利用SSR[17],SCAR和RAPD标记[18]对初烤烟叶进行品种的快速鉴别。然而在分子水平上对涉案制烟原料的鉴别检测研究在国内外尚无报道。国内烟草行业针对涉案制烟原料的鉴别检验工作主要采用感观检验法[19-21]和化学检验法[22-24],但这两种方法均存在较明显的缺陷。感观检验法主要依赖检验人员对涉案制烟原料的感观感受和检验经验,易受到检验人员主观感受和经验的影响,存在较高比例的误判性;化学检验法通过测定待测样品是否含有烟碱进而判定样品是否为烟草专卖品,该方法虽极大地弥补了感观检验法的不足,能对烟碱进行科学而灵敏的定量分析,但因烟碱并非只是烟草独有,有些茄科植物也能产生烟碱,故此,也存在一定的误判风险。行业烟草基因组计划重大专项的持续推进及大量烟草品种基因组数据的获得,为利用烟草属特异的分子标记开展涉案制烟原料鉴定检验工作奠定了坚实的理论和技术基础。基于此,本研究利用生物信息学对公共数据库中烟碱代谢途径的相关基因序列数据、烟草基因组数据(包含行业内未公开数据)和其它茄科基因组数据进行分析并开发标记,经过对91份烟草材料和17份非烟草材料进行实验验证,获得了能鉴别检测涉案制烟原料中是否含有烟草材料的烟草属特异性分子标记,旨在为烟草行业打假缉私工作提供一种快速、高效、简易的分子水平检验技术,为科学、准确地进行涉案制烟原料鉴别检验提供支持。
1 材料与方法
1.1 植物材料
参试的植物材料共计108份,其中,烟草材料91份(见表1),非烟草材料17份(见表2)。91份烟草材料中,属于3个烟草亚属11个组的野生烟草材料(种)83份,属于4种不同类型的栽培烟草材料8份;17份非烟草材料中,十字花科材料1份,豆科材料2份,山茶科材料2份,禾本科材料4份,茄科材料8份。108份材料的选择是在充分考虑了植物材料中是否含有烟碱、涉案制烟原料中常用的主要植物材料及对已开发标记的烟草属特异性实验验证等因素下进行的。此外,为了符合涉案制烟原料的烘干状态,上述材料分成两部分进行DNA提取、纯化,一部分为不经过任何处理的新鲜叶片,另一部分经烘箱内高温杀青处理至类似初烤烟叶的烘干状态。
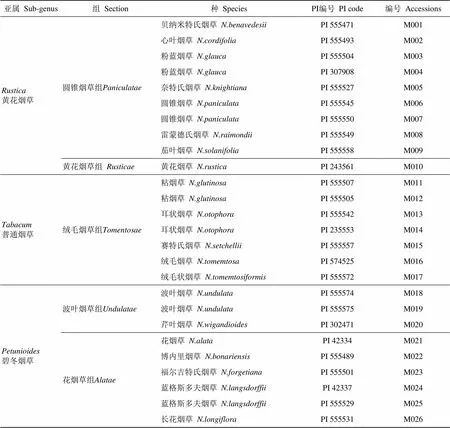
表1 91份烟草属材料详细信息
续表1

亚属 Sub-genus组 Section种 SpeciesPI编号 PI code编号 Accessions 花烟草组Alatae长花烟草 N.longifloraPI 555532M027 长花烟草 N.longifloraPI 555533M028 蓝茉莉烟草 N.plumbaginifoliaPI 555548M029 蓝茉莉烟草 N.plumbaginifoliaPI 302476M030 蓝茉莉烟草 N.plumbaginifoliaPI 302478M031 林烟草 N.sylvestrisPI 555569M032 林烟草 N.sylvestrisPI 555570M033 林烟草 N.sylvestrisPI 555571M034 裸茎烟草组 Nudicaulisae裸茎烟草 N.nudicaulisPI 555540M035 匍匐烟草组Repandae匍匐烟草 N.repandaPI 555552M036 匍匐烟草 N.repandaPI 555551M037 斯托克通氏烟草 N.stocktoniiPI 555538M038 斯托克通氏烟草 N.stocktoniiPI 555539M039 斯托克通氏烟草 N.stocktoniiPI 555560M040 夜花烟草组Noctiflorae夜花烟草 N.noctifloraPI 417918M041 夜花烟草 N.noctifloraPI 475832M042 Petunioides碧冬烟草碧冬烟草 N.petunioidesPI 555547M043 渐尖叶烟草组Acuminatae渐尖叶烟草 N.acuminataPI 555477M044 渐狭叶烟草 N.attenuataPI 555476M045 伞床烟草 N.corymbosaPI 114824M046 少花烟草 N.paucifloraPI 555546M047 印度烟草组Bigelovianae印度烟草 N.bigeloviiPI 555485M048 克里夫兰氏烟草 N.clavelandiiPI 555491M049 香甜烟草组Suaveolensae非洲烟草 N.africanaPI 555472M050 抱茎烟草 N.amplxicaulisPI 271989M051 抱茎烟草 N.amplxicaulisPI 555682M052 本氏烟草 N.benthamianaPI 555478M053 凯维科拉烟草 N.cavicolaPI 271990M054 迪勃纳氏烟草 N. debneyiPI 503320M055 高烟草 N.excelsiorPI 224063M056 高烟草 N.excelsiorPI 555685M057 古特斯皮氏烟草 N.goodspeediiPI 241012M058 哥西氏烟草 N.gosseiPI 230953M059 狭叶烟草 N.linearisPI 555530M060 摩西氏烟草 N.miersiiPI 555537M061 海滨烟草 N.maritimaPI 555535M062 特大管烟草 N.megalosiphonPI 555536M063 特大管烟草 N.megalosiphonPI 555688M064 西方烟草 N.occidentalisPI 271991M065
续表1

亚属 Sub-genus组 Section种 SpeciesPI编号 PI code编号 Accessions Petunioides碧冬烟草香甜烟草组Suaveolensae西方烟草 N.occidentalisPI 555687M066 西方烟草 N.occidentalisPI 555541M067 西方烟草 N.occidentalisPI 555690M068 莲座叶烟草 N.rosulataPI 244635M069 莲座叶烟草 N.rosulataPI 244624M070 莲座叶烟草 N.rosulataPI 244628M071 圆叶烟草 N.rotundifoliaPI 555553M072 圆叶烟草 N.rotundifoliaPI 555691M073 香甜烟草 N.suaveolensPI 555500M074 香甜烟草 N.suaveolensPI 555565M075 香甜烟草 N.suaveolensPI 230960M076 簇叶烟草 N.umbraticaPI 271993M077 颤毛烟草 N.velutinaPI 244638M078 颤毛烟草 N.velutinaPI 244630M079 颤毛烟草 N.velutinaPI 244631M080 渐尖叶烟草 N.acuminataPI 555469M081 渐尖叶烟草 N.acuminataPI 42347M082 本氏烟草 N.benthamianaPI 555684M083 名称 Names类型 Types编号 Accessions K326烤烟 Flue-curedM084 红花大金元 HD烤烟 Flue-curedM085 TN90白肋烟 BurleyM086 Burley 21白肋烟 BurleyM087 Basma Xanthi香料烟 OrientalM088 Sumsun NN香料烟 OrientalM089 Beinhart1000-1雪茄烟 CigarM090 Florida301雪茄烟 CigarM091
注:83份烟草野生种的编号是以PI编号进行统计的,即存在同名不同PI编号的野生烟草种。
Note: 83 wild tobacco species were numbered with PI accessions, i.e., some wild tobacco species have the same name but different PI accessions.
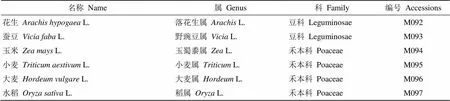
表2 17份非烟草属材料信息
续表2

名称 Name属 Genus科 Family编号 Accessions 辣椒 Capsicum annuum L.辣椒属 Capsicum L.茄科 SolanaceaeM098 茄子 Solanum melongena L.茄属Solanum L.茄科 SolanaceaeM099 马铃薯Solanum tuberosum L.茄属Solanum L.茄科 SolanaceaeM100 番茄Solanum lycopersicum L.番茄属 Lycopersicon L.茄科 SolanaceaeM101 矮牵牛/碧冬茄 Petunia hybrida Vil.碧冬茄属Petunia Juss.茄科 SolanaceaeM102 曼陀罗Datura stramonium L.曼陀罗属Datura L.茄科 SolanaceaeM103 枸杞Lycium chinense Mill.枸杞属 Lycium L.茄科 SolanaceaeM104 紫夜香花Cestrum purpureum夜香树属 Cestrum L.茄科 SolanaceaeM105 油菜Brassica napus L.芸薹属Brassica L.十字花科 BrassicaceaeM106 绿茶Camellia sinensis (L.) O.Kuntze山茶属Camellia L.山茶科 Theaceae Mirb.M107 普洱茶Camellia sinensis var. assamica山茶属Camellia L.山茶科 Theaceae Mirb.M108
1.2 基因组数据
共计46个与烟碱合成、转运、转化及代谢等相关基因组序列数据以FASTA文件格式下载自公共数据库NCBI(National Center for Biotechnology Information;https://www.ncbi.nlm.nih.gov/)[1, 25],其中,结构基因32个,转录因子14个,其详细信息见表3。番茄、马铃薯、辣椒、胡椒等基因组数据以FASTA文件格式下载自茄科数据库(https://www.sgn.cornell.edu/),已公开的烟草基因组数据下载自https://www.sgn.cornell. edu/organism/Nicotiana_tabacum/genome[26],未公开的烟草全基因组数据(红花大金元、云烟87、Beinhart1000-1、云晒1号及黄花烟G366等)和重测序数据(369份烟草核心资源的10-15×基因组重测序数据)由本实验室提供。

表3 烟草烟碱(尼古丁)代谢途径中的部分基因信息
续表3

名称Abbr. Name注释/描述DescriptionNCBI编号NCBI Accession A662LA622L mRNA for isoflavone reductase-like proteinAB445396.1 MPOmethylputrescine oxidaseDQ873385.1 MPO1NtMPO1 mRNA for N-methylputrescine oxidaseAB289456.1 MPO2NtMPO2 mRNA for N-methylputrescine oxidaseAB289457.1 QPTquinolinate phosphoribosyl transferaseAB038494.1 MATEmulti antimicrobial extrusion family proteinAB286961.1 MATE1NtMATE1 gene for multi antimicrobial extrusion family proteinAB286963.1 MATE2NtMATE2 mRNA for multi antimicrobial extrusion family proteinAB286962.1 NUP1nicotine uptake permease 1GU174267.1 NUP2nicotine uptake permease 2GU174268.1 BBLaBBLa mRNA for berberine bridge enzyme-like proteinAB604219.1 BBLbberberine bridge enzyme like protein (T440 gene)AM851017.1 BBLcBBLc mRNA for berberine bridge enzyme-like proteinAB604220.1 BBLdBBLd mRNA for berberine bridge enzyme-like proteinAB604221.1 SPDSspermidine synthaseAF321139.1 AOKR3B.001A05DW001381.1 QSPR48AF154657.1 SAMDCS-adenosylmethionine decarboxylaseU91924.1 JAT1putative MATE transporter (T401 gene)AM991692.1 EFaelongation factor-1 alphaD63396.1 转录因子 Transcription Factors NtERF189Nicotiana tabacum ERF189 mRNA for ethylene response factor 189AB827951.1 NtERF115Nicotiana tabacum ERF115 mRNA for ethylene response factor 115AB828149.1 NtERF221Nicotiana tabacum ethylene-responsive transcription factor 1-likeXM_016622819.1 NtERF104Nicotiana tabacum ethylene-responsive transcription factor 2-likeXM_016625526.1 NtERF179Nicotiana tabacum ERF179 mRNA for ethylene response factor 179AB828150.1 NtERF17Nicotiana attenuata ethylene-responsive transcription factor 1-likeXM_019377263.1 NtERF168Nicotiana tabacum ERF168 mRNA for ethylene response factor 168AB828151.1 NtMYC2aNicotiana tabacum MYC2a transcription factorHM466974.1 NtMYC2bNicotiana tabacum MYC2b transcription factorHM466975.1 NtMYC2cNicotiana tabacum MYC2c transcription factorHM466976.1 NtERF10Nicotiana tabacum ethylene-responsive transcription factor 2-likeXM_016623277.1 NtERF91Nicotiana tabacum ERF91 mRNA for ethylene response factor 91AB828153.1 NtERF32Nicotiana tomentosiformis ethylene-responsive transcription factor 2XM_009608650.3 ERFSNVNicotiana tomentosiformis AP2-like ethylene-responsive transcription factor AIL5XM_009591706.3
1.3 引物设计与验证
利用Primer3(http://www.frodo.wi.mit.edu)软件对已下载获得的46个烟碱代谢途径中的基因序列设计引物。原则上,针对每个基因的DNA序列设计3对引物,即在每个基因的起始、结尾及中间位置截取500 bp的核酸序列进行引物开发;若基因的DNA序列较大(3 kb以上)时,可适当在基因序列的中部位置增加2~3对引物,最终,针对每个基因设计出3~6对引物。引物设计时,相关参数的设定参照童治军等[27]方法。
利用生物信息学并结合已公布的烟草(包含行业内尚未公开)基因组数据、茄科植物(烟草除外)基因组数据及公共数据库(如NCBI、EMBL等)中目前已公开的基因组数据,对已开发获得的引物进行烟草属特异性的初步分析。即,将已开发的全部引物序列比对到上述基因组数据中,比对的结果必须同时满足:1)引物序列与烟草基因组序列完全比对(Forward & Reverse Ident. %,Forward & Reverse Cvg. %:正反向引物序列100%比对)且比对结果唯一;2)引物序列与除烟草外其他已知基因组序列不能比对。满足上述两个条件的引物为候选烟草属特异性标记。
利用候选烟草属特异性标记对参试的108份材料基因组进行PCR扩增,依据PCR扩增产物结果进行烟草属特异性标记实验验证。
1.4 PCR扩增及产物检测
基因DNA提取及纯化:分别取上述参试实验材料的新鲜叶片及高温杀青处理后叶片100 mg和30 mg置于直径为8 cm 研钵中,倒入液氮迅速研磨成粉末,然后利用滤柱法(DNeasy Plant Mini Kit (250)试剂盒,QIAGEN公司)提取并纯化参试材料的基因组DNA,操作过程及试剂用量均按试剂盒说明书进行。
PCR扩增体系:扩增体系为20 μL,其中包含2.0 μL的10×Buffer(10 mmol/L Tris-HCl,PH 8.4,50 mmol/LKCl,1.5 mmol/L MgCl2),200 μmol/L的 dNTPs(Takara Biotechnology Co. Ltd., Dalian, China),0.5 μmol/L的上下游引物(Takara),0.75 U的rTaq聚合酶(Takara),30~50 ng模板DNA,用ddH2O补齐20 μL。PCR反应程序为:95℃预变性5 min,30个循环(95℃变性30 s,60℃复性30 s,72℃延伸30 s),72℃延伸5 min,4℃保存。
PCR扩增产物检测:PCR扩增产物加1/6体积的6×Loading Buffer,取2.5 μL利用6%的非变性聚丙烯酰胺凝胶(non-denaturing PAGE,550 V,2.5 h)在DYY-8型电泳仪(北京六一厂)上电泳分离,然后将电泳后的凝胶参照童治军等[28]的方法进行固定、银染、漂洗、显色、漂洗等银染检测步骤,最后拍照及胶片数据处理。
2 结果与分析
2.1 烟草属特异性标记分析
基于46个与烟草烟碱合成、转运、转化及代谢等相关基因的全长DNA序列,共开发获得符合设计要求的引物209对,每个基因开发获得3~6对引物,平均4.5(209/46)对。将上述209对引物序列比对至公共数据库中已公开的基因组数据(含烟草)及烟草行业内未公开的烟草基因组数据,最终获得5对候选烟草属特异性引物。由此可知,候选烟草属特异性引物的获得率极低,仅有约2.39%。
2.2 烟草属特异性标记验证
利用参试的108份材料对5对候选烟草属特异性引物进行实验验证,最终获得2对引物具有烟草属特异性(表4)。引物Ntsp027在91份烟草材料中均能扩增出大小为303 bp的特异性条带(部分烟草材料有大于303 bp的非特异PCR扩增产物),而在17份非烟草材料中均无PCR扩增产物(图1)。引物Ntsp151在91份烟草材料中均能扩增出大小为300 bp的特异性条带(部分烟草材料有大于300 bp的非特异PCR扩增产物),而在17份非烟草材料中无PCR扩增产物获得(图2)。上述2对引物均能在91份烟草材料中扩增出有效的目标PCR产物条带,而在17份非烟草材料中无PCR扩增产物检测出,表明该2对引物具有烟草属特异性。

表4 烟草属特异性标记信息

注:编号M001-M091为烟草属材料,其中M001-M083属于3个烟草亚属11个组的野生烟草材料,M084-M091为4种不同类型的栽培烟草材料;编号M092-M108为非烟草属材料,其中M098-M105是7个属的茄科材料。最右边泳道为500 bp DNA marker,从下往上分别为300 bp 和400 bp。

图2 烟草属特异标记Ntsp151在108份参试材料中的PCR扩增结果。最右边泳道为300 bp DNA marker
3 讨论
茄科中的绝大部分植物,尤其是烟草属植物,均含有一种特殊的生物碱-烟碱,故此,烟碱也就成为茄科植物区分其他植物的显著性标志物[29]。为了进一步验证本文所选择的46个与烟碱相关基因的烟草属特异性,利用生物信息学方法将上述46个基因的DNA序列分别在美国国家生物信息中心库(NCBI)、欧洲分子生物学实验室数据库(EMBL)、植物基因组与系统生物学库(PGSB)、茄科基因组数据(Sol Genomics Network)及行业未公开的烟草基因组数据进行比对(BLASTn)。当匹配一致性(Ident. %)和覆盖率(Cvg. %)设置为≥75%时,BLASTn结果中除烟草外,也存在其他茄科植物、茶叶甚至少量的微生物;但有9个与烟碱相关基因的DNA序列(包含NtADC、NtA662和Nt ERF189三个基因)只能在烟草基因组数据获得比对结果。当进行严格的BLASTn(Ident. & Cvg. ≥95%)后,比对结果中虽仍然含有烟草、其他茄科植物及微生物,但仅在烟草基因组中获得比对结果的基因数量则降低至5个。另一方面,通过利用候选烟草属特异性标记对108份材料的实验验证可知,最终仅有2个基因(1个结构基因,NtADC:arginine decarboxylase和1个转录因子,Nt ERF189:Nicotiana tabacum ERF189 mRNA for ethylene response factor 189)在匹配一致性和覆盖率同时满足≥95%时,具有烟草属特异性。因此,基于上述2个基因DNA序列开发的标记具有烟草属特异性。
本研究开发的2个烟草属特异性标记,理论上应符合在烟草属植物中能扩增出特异的目标PCR产物,而在除烟草外的其他生物(尤其是植物)中无法扩增出特异性目标PCR产物或无法获得PCR扩增产物。为实现上述2个标记的烟草属特异性并尽可能的消除假阳性,本研究的核心工作聚焦在大量基因组数据的生物信息学分析、实验材料选择和烟碱相关基因的标记开发上,其中实验材料的合理选择是关键:既充分考虑选材的代表性和数量又兼顾涉案制烟样品中常用的非烟草材料。具体做法为:首先,利用生物信息学开发烟碱相关基因的标记并严格比对到大量已公开和未公开的基因组数据上,筛选出候选烟草属特异性标记;其次,选用数目尽量多且覆盖度尽可能全的烟草属材料(3个烟草亚属11个组的83个野生种和4种类型8个栽培烟草品种);然后,针对含烟碱的茄科(除烟草属外)植物,选择辣椒属、茄属、蕃茄属、碧冬茄属、曼陀罗属、枸杞属和夜香树属等7个属的8种代表性材料;接着,针对不含烟碱的植物材料,选择日常生活中常见(主栽)且涉案样品中常用的8属4科共计9份非烟草材料;最后,利用优化后的植物组织基因组提取试剂盒排除微生物DNA,同时,提高PCR扩增时的退火温度,促进特异性PCR扩增。经过上述生物信息学分析、筛选及实验优化、验证后,获得了2个标记,可快速、简易、高效鉴别检测烟草与非烟草材料,实现了烟草属特异性标记的开发。
本研究属于烟草行业内首次基于分子(DNA)水平鉴别检测涉案制烟原料的研究,国内外虽无相关报道可供参考与比较,但相较于感观检验法和化学检验法具有一定的优势。因该方法中所涉及的标记及PCR扩增产物序列具有烟草属特异性,且上述DNA序列在生物体内具有较高的稳定性和保守性,其可有效避免外部因素(人为、环境、仪器设备等)的影响,是一种科学、高效,且简便易行、可操作性强的烟草与非烟草材料鉴别检测方法。为了有效弥补行业内打假缉私工作中存在的缺陷,丰富涉案制烟原料的鉴别检测方法,本文从分子(DNA)水平上开发烟草属特异性标记,并用于涉案制烟原料的鉴别检测,以期进一步提高行业专卖打假缉私工作的科学性和准确性。
4 结论
本研究聚焦基因组DNA水平上的涉案制烟原料鉴别检测,利用生物信息学对公共数据库中烟碱代谢途径相关基因序列数据和其他生物基因组数据进行分析并开发分子标记,经实验验证后获得2对具有烟草属特异性的分子标记,实现了烟草与非烟草材料的快速、有效鉴别检测,提高了涉案制烟原料鉴别检测工作的科学性和准确性,为行业专卖打假缉私工作提供基因组水平上的分子证据。
[1] Xu S Q, Thomas B, Aura N Q, et al. Wild tobacco genomes reveal the evolution of nicotine biosynthesis[J]. PNAS, 2017, 114(23): 6133-6138.
[2] 国家发展和改革委员会价格认证中心. 国家发展和改革委员会价格认证中心关于印发《涉烟案件物品价格鉴定操作规范》的通知发改价证办[2013]104号[EB/OL]. http://jgrd.ndrc.gov.cn/c/ 2014-06-04/39637.shtml, 2014-06-04/2021- 02-04.
Price Certification Center of the National Development and Reform Commission (PCC-NDRC, PRC). Notice of PCC-NDRC on printing and distributing the operating procedure of tobacco-related case price certification [EB/OL]. http://jgrd.ndrc. gov.cn/c/2014-06-04/39637.shtml, 2014-06-04/2021-02-04.
[3] Nan R, Michael P T. AFLP analysis of genetic polymorphism and evolutionary relationships among cultivated and wild Nicotiana species[J]. Genome, 2001, 44: 559-571.
[4] LIU X Z, HE C S, YANG Y M, et al. Genetic diversity among flue-cured tobacco cultivars on the basis of AFLP markers[J]. Czech J. Genet. Plant Breed., 2009, 45(4): 155-159.
[5] Šarčevic′ H, Gunjača J, Budimir A, et al. Long-term genetic improvement and genetic diversity of croatian flue-cured tobacco (Nicotiana tabacum L.) cultivars[J]. Crop Sci., 2013, 53: 112-120.
[6] Zhang H Y, Liu X Z, He C S, et al. Random amplified DNA polymorphism of Nicotiana tabacum L. cultivars[J]. Biologia Plantarum, 2005, 49 (4): 605-607.
[7] Raju K S, Sheshumadhav M, Murthy T.G.K. Molecular diversity in the genus Nicotiana as revealed by randomly amplified polymorphic DNA[J]. Physiol. Mol. Biol. Plants, 2008, 14(4): 377-382.
[8] Moon H S, Nicholson J S, Lewis R S. Use of transferable Nicotiana tabacum L. microsatellite markers for investigating genetic diversity in the genus Nicotiana[J]. Genome, 2008, 51: 547-559.
[9] Moon H S, Nifong J M, Nicholson J S, et al. Microsatellite- based analysis of tobacco (Nicotiana tabacum L.) genetic resources[J]. Crop Sci., 2009, 49: 2149-2159.
[10] Gholizadeh S, Darvishzadeh R, Bernousi B A I, et al. Molecular characterization and similarity relationships among flue-cured tobacco (Nicotiana tabacum L.) genotypes using simple sequence repeat markers[J]. Not Bot Horti Agrobo., 2012, 40(2): 247-253.
[11] 张晨东,杨志新,张聪,等. 44份香料烟品种ISSR遗传多样性分析[J]. 热带作物学报,2012, 33(12): 2144-2149.
ZHANG Chendong, YANG Zhixin, ZHANG Cong, et al. ISSR analysis of genetic diversity for 44 oriental tobacco cultivars[J]. Chinese Journal of Tropical Crops, 2012, 33(12): 2144-2149.
[12] 张雪廷,童治军,焦芳婵,等. 38份晾晒烟种质资源遗传关系的SSR分析[J]. 植物遗传资源学报,2013, 14(4): 653-658, 678.
ZHANG Xueting, TONG Zhijun, JIAO Fangchan, et al. Genetic relationship analysis of thirty-eight sun/air-cured tobacco germplasms based on simple sequence repeat (SSR) markers[J]. Journal of Plant Genetic Resources, 2013, 14(4): 653-658, 678.
[13] Maryan K E, Lahiji H S, Deylami M S. Assessing the genetic diversity of tobacco (Nicotiana tabacum L.) varieties[J]. Crop Breeding Journal, 2(2): 125-132.
[14] LU X P, XIAO B G, LI Y P, et al. Diversity arrays technology (DArT) for studying the genetic polymorphism of flue-cured tobacco (Nicotiana tabacum)[J]. Journal of Zhejiang University- SCIENCE B (Biomedicine & Biotechnology), 2012, 10(3): 1-8.
[15] 张剑锋,罗朝鹏,何声宝,等. 应用SNP 标记分析24份烟草品种的遗传多样性[J]. 烟草科技,2017, 50(11): 1-8.
ZHANG Jianfeng, LUO Zhaopeng, HE Shengbao, et al. Genetic diversities of 24 tobacco cultivars analyzed by SNP[J]. Tobacco Science & Technology, 2017, 50(11): 1-8.
[16] 蔡露,杨欢,王勇,等. 利用GBS技术开发烟草SNP标记及遗传多样性分析[J]. 中国烟草科学, 2018, 39(5): 17- 24.
CAI Lu, YANG Huan, WANG Yong, et al. Analysis of genetic diversity of tobacco germplasm resources based on SNP markers via genotyping-by-sequencing technology[J]. Chinese Tobacco Science, 2018, 39(5): 17-24.
[17] 孙九喆,杨金初,苏东嬴,等. 基于SSR标记的初烤烟叶品种快速鉴别[J]. 烟草科技,2019, 52(3): 26-32.
SUN Jiuzhe, YANG Jinchu, SU Dongying, et al. Rapid identification of cured tobacco leaf varieties based on SSR markers[J]. Tobacco Science & Technology, 2019, 52(3): 26-32.
[18] Sun J Z, Wang J T, Su D Y, et al. Discrimination of tobacco cultivars using SCAR and RAPD markers[J]. Czech J. Genet. Plant Breed., 56: 170-173.
[19] 国家技术监督局. 烤烟:GB2635-92[S]. 北京:中国标准出版社,1992: 4-7.
State Bureau of Quality Technical Supervision. Flue-cured tobacco: GB2635-92[S]. Beijing: China standard press, 1992: 4-7.
[20] 中华人民共和国国家质量监督检疫总局,中国国家标准化管理委员会. 白肋烟:GB/T 8966-2005[S]. 北京:中国标准出版社,2007: 1-6.
State General Administration of the People's Republic of China for Quality Supervision and Inspection and Quarantine Standardization Administration of the People’s Republic of China. Burley tobacco: GB/T 8966-2005[S]. Beijing: China standard press, 2007: 1-6.
[21] 国家质量技术监督局. 香料烟:GB 5991.1-2000[S]. 北京:中国标准出版社,2005: 1-5.
State Bureau of Quality and Technical Supervision. Aromatic tobacco-Grading technical requirement: GB 5991.1-2000[S]. Beijing: China standard press, 2005: 1-5.
[22] 国家烟草专卖局. 烟草特征性成分生物碱的测定气相色谱-质谱联用法和气相色谱-串联质谱法:YC/T 559-2018[S]. 北京:中国标准出版社,2018, 1-20.
State Tobacco Monopoly Administration. Characteristic components of tobacco-Determination of alkaloids-Gas chromatography-mass spectrometry method and gas chromatography-tandem mass spectrometry method: YC/T 559-2018[S]. Beijing: China standard press, 2018, 1-20.
[23] 国家烟草专卖局. 烟草特征性成分烟碱中氢稳定同位素比值的测定气相色谱-稳定同位素比质谱联用法: YC/T 560-2018[S]. 北京:中国标准出版社,2018, 1-12.
State Tobacco Monopoly Administration. Characteristic componentsof tobacco-Determination of stable hydrogen isotope ratio of nicotine- Gas chromatography-isotope ratio mass spectrometry method: YC/T 560-2018[S]. Beijing: China standard press, 2018, 1-12.
[24] 国家烟草专卖局. 烟草特征性成分烟碱旋光异构体比例的测定高效液相色谱法和超高效合相色谱-串联质谱法:YC/T 561-2018[S].北京:中国标准出版社,2018, 1-16.
State Tobacco Monopoly Administration. Characteristic components of tobacco-Determination of enantiomer ratio of nicotine-High performance liquid chromatography method and ultra-performance convergence chromatography- tandem mass spectrometry method: YC/T 561-2018[S]. Beijing: China standard press, 2018, 1-16.
[25] Lewis R S, Bowen S W, Keogh M R, et al. Three nicotine demethylase genes mediate nornicotine biosynthesis in Nicotiana tabacum L.: Functional characterization of the CYP82E10 gene[J]. Phytochemistry, 2010, 71: 1988-1998.
[26] Wang X W, Bennetzen J L. Current status and prospects for the study of Nicotiana genomics, genetics, and nicotine biosynthesis genes[J]. Mol Genet Genomics, 2015, 11: 1-11.
[27] 童治军,焦芳婵,肖炳光. 普通烟草及其祖先种基因组SSR位点分析[J]. 中国农业科学,2015, 48(11): 2108- 2117.
TONG Zhijun, JIAO Fangchan, XIAO Bingguang. Analysis of SSR loci in Nicotina tabacum genome and its two ancestral species genomes [J]. Scientia Agricultura Sinica, 2015, 48(11): 2108-2117.
[28] 童治军. 烟草微卫星标记的开发与应用[D]. 杭州:浙江大学,2012, pp: 35, 87-88.
TONG Zhijun. Development and application of microsatellite markers in flue-cured tobacco (Nicotiana tabacum L.) [D]. Zhejiang University, 2012, pp: 35,87-88.
[29] 李卫,周冀衡,胡志明,等. 烟草特有亚硝胺(TSNA)的研究进展[J]. 作物研究,2009, 23(增刊):172-176.
LI Wei, ZHOU Jiheng, HU Zhiming, et al. Research progress of tobacco specific nitrosamines (TSNA) [J]. CROP RESEARCH, 2009, 23(Suppl.): 172-176.
Study on specific PCR primers for identification ofplants
TONG Zhijun1, ZHANG Ke2, SUN Haowei2, ZHANG Xiaowei2, FANG Dunhuang1, ZENG Jianmin1,CHEN Xuejun1, CHEN Dan2, LONG Jie2, ZHANG Jiwu2, CAI Jieyun2, WANG Chunqiong2, XIAO Bingguang1*
1 Yunnan Academy of Tobacco Agricultural Sciences / Key Laboratory of Tobacco Biotechnological Breeding / National Tobacco Genetic Engineering Research Center, Kunming 650021, China;2 Yunnan Tobacco Quality Inspection & Supervision Station, Kunming 650106, China
To scientifically and efficiently identify and detect the tobacco materials contained in the tobacco raw materials involved in the case, molecular markers were developed using the sequence data of genes related to nicotine metabolism pathway and genomic data of Solanaceae (including unpublished tobacco genomic data) in public database in this study. The-specific markers were obtained by experimentally verifying 17 non-tobacco materials and 91 tobacco materials belonging to 11 sections of 3 sub-genus. The results of the study showed that 2 pairs of stable, reliable and-specific primers were screened out from 209 newly developed markers, which could clearly amplify the target length fragments in 91materials, while there was no PCR product amplification in 17 non-materials. The method is simple and easy to operate, so it can be applied to the authenticity determination of tobacco materials in the anti-counterfeiting and anti-smuggling work of tobacco industry.
tobacco raw materials involved; nicotine;-specific markers
. Email:xiaobg@263.net
童治军,张轲,孙浩巍,等. 鉴别烟草属植物的特异PCR引物研究[J]. 中国烟草学报,2022,28(2). TONG Zhijun, ZHANG Ke, SUN Haowei, et al. Study on specific PCR primers for identification of Nicotiana plants[J]. Acta Tabacaria Sinica, 2022, 28(2).doi:10.16472/j.chinatobacco.2021.T0024
中国烟草总公司云南省公司项目(2020530000241034);“烟草抗黑胫病基因聚合与抗黑胫病烤烟新品系选育”(2020530000241009);“基于拉曼光谱的烟草农药残留检测技术研发”(2020530000241037)
童治军(1980—),博士,副研究员,主要从事烟草分子育种,Tel:0877-2075074,Email:tzj861@163.com
肖炳光(1971—),博士,研究员,主要从事烟草育种研究,Tel:0877-2075076,Email:xiaobg@263.net
2021-02-25;
2021-12-06
