生物降解地膜添加剂2, 6-二异丙基苯胺对烟苗生长、生理特性及氮代谢的影响
2022-04-29向美蔡凯高维常杨磊张婕邓琴潘文杰吴迪
向美,蔡凯,高维常,杨磊,张婕,邓琴,潘文杰,吴迪
生物降解地膜添加剂2, 6-二异丙基苯胺对烟苗生长、生理特性及氮代谢的影响
向美1,2,蔡凯2,高维常2,杨磊3,张婕2,邓琴1,潘文杰2,吴迪1*
1 贵州师范大学 贵州省山地环境信息系统与生态环境保护重点实验室贵州 贵阳 550001;2 贵州省烟草科学研究院,烟草行业山地烤烟品质与生态重点实验室贵州 贵阳 550081;3 湖南中烟工业有限责任公司,原料采购中心 长沙 410109
【】聚己二酸/对苯二甲酸丁二酯(PBAT)生物降解地膜正在逐步替代常规地膜应用于农业生产,苯胺类物质2, 6-二异丙基苯胺(2, 6-DIPA)作为降解地膜主要的有机添加剂,对其进行植物安全性评价尤为重要。以2叶1心期K326烟苗为材料,通过添加2, 6-DIPA的空白、低(1.77 µg/mL)、中(17.7 µg/mL)、高(88.5 µg/mL)4个浓度进行水培试验,探究其对烟苗表型性状、生理指标及氮代谢的影响。2, 6-DIPA浓度越高,对烟苗表型抑制作用越明显,株高、茎围、最大叶面积、生物量、根系发育等被显著抑制,叶绿素含量显著增加。丙二醛(MDA)含量及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)等抗逆酶活性随2, 6-DIPA浓度增大均有不同程度增加,而谷胱甘肽还原酶(GR)活性在2, 6-DIPA低浓度时显著增加,高浓度时显著下降。烟苗叶片中生物碱含量随2, 6-DIPA浓度增大先降后升,多数氨基酸及其类似物在高浓度时显著下调,仅丙氨酸(Ala)、天冬氨酸(Asp)与色胺(Try)表现为显著上调。2, 6-DIPA可显著抑制烟苗的生长发育,并使叶绿素含量及抗逆酶活性增加,同时影响烟苗对氮的吸收,进而改变其氨基酸与生物碱的合成代谢。
烟草;PBAT生物降解地膜;2, 6-二异丙基苯胺;生长发育;生理特性;氮代谢
近年,为积极应对传统塑料地膜带来的“白色污染”问题[1-2],以聚己二酸/对苯二甲酸丁二酯(PBAT)为原料的生物降解地膜逐步应用于农业生产[3]。PBAT的化学结构无毒性单元,在水和土壤中的降解产物表现为无植物毒性、细胞毒性、遗传毒性和致突变性[4-7],对植物与环境的危害风险较低。为优化其理化性能,降解地膜加工过程中会加入不同类型的有机添加剂(如抗氧化剂、紫外线稳定剂、抗水解剂水解产物等),各类有机添加剂总量组成占比在5%()以上[8]。类似于常规塑料中的增塑剂邻苯二甲酸酯的添加剂可能在生态毒理中起重要作用[9]。前期研究发现,PBAT生物降解地膜中的2, 6-二异丙基苯胺(2, 6-DIPA)及其异氰酸酯含量可达2.45 mg/g,与地膜接触的土壤中含量也达14.37 μg/g[10],以烟田10 kg/亩用量计算,每年转移到环境中的量为24.5g/亩。2, 6-DIPA主要来源于添加剂stabaxol®-1水解,该物质首先转化为2, 6-二异丙基苯异氰酸酯,再水解为2, 6-DIPA[11],此类型胺易被土壤吸附,难被生物体降解,导致其在水体与土壤中累积,现已被列为优先控制污染物[12]。2, 6-DIPA与内源芳香胺化学结构类似,可能会以外源胺的形式对植物生长发育产生影响,从而对植物的生长、生理指标和代谢造成影响[13-14]。植物生长、生理指标的变化可用于表征其受胁迫程度,而代谢分析则是从分子层面阐述植物受胁迫时产生的代谢干扰,将此二者结合,能从多维度有效地评估植物在有害物暴露条件下的安全风险[15]。
添加剂2, 6-DIPA对植物生长的影响目前鲜有报道,本研究设计2, 6-DIPA不同浓度的水培试验对2叶1心期烟苗进行处理,分析其对烟苗表型性状、生物量、根系构型、生理特性及氮代谢等的影响,探究其对烟苗生长的作用机理,以期为2, 6-DIPA的安全性评价及PBAT生物降解地膜在烟草种植过程中的安全应用提供参考。
1 材料与方法
1.1 供试材料
以烤烟品种K326作为试验材料,种子由贵州省烟草科学研究院提供。
2, 6-DIPA(纯度>99%)购于北京百灵威科技有限公司,其它试剂主要购于上海国药集团化学试剂有限公司。
1.2 试验设计
水培试验于2020年8—10月在贵州省烟草科学研究院进行,将烟草种子播种于漂浮育苗盘中,置于人工气候箱内(白昼:12 h,光照/20000 lx ,温度/25℃,湿度/70%;黑夜:12 h,光照/0 lx,温度/20℃,湿度/70%)培养至2叶1心时,选取健壮且长势一致的烟苗,用去离子水洗净根系表面基质,定植于装有Hoagland 营养液(pH 5.7± 0.2)的水培箱中(12 h光照、12 h黑暗)。室温下预培养5 d 后,参考文献[16]邻苯二甲酸酯添加剂的水培浓度,设置2, 6-DIPA 0 µg/mL(CK)、1.77 µg/mL(T1)、17.7 µg/mL(T2)、88.5 µg/mL(T3)4个浓度对烟苗进行处理。每个处理设3个重复,每个重复48株,培养15 d 后取样测定相关指标。
1.3 测定指标及方法
1.3.1 烟苗生长指标测定
每处理各取5株完整且长势相近的烟苗,分别统计叶片数,测量株高、茎围、最大叶面积,之后洗净并吸干表面水分,从根茎基部剪断分为地上部和地下部(根系),分别称鲜重。采用根系扫描仪(Expression 1000XL,EPSON,加拿大)结合WinRHIZO根系分析系统对根系总长、根投影面积、根系表面积、根体积、根平均直径等相关根系构型参数进行分析,随后放入烘箱中以105℃杀青30 min,80℃烘干至恒重分别称干重。
1.3.2 烟苗生理指标测定
每处理重新取10株与上述长势相近的烟苗,地上部分取自上而下第2~3片完全展开的真叶,一部分冰浴研磨用于生理指标测定,另一部分立即冷冻干燥于4℃保存,用于测定相关氮代谢物。叶绿素含量采用SPAD-502叶绿素仪和分光光度法[17]分别测定;丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性参照张志良等[18]方法,分别采用硫代巴比妥酸比色法、氮蓝四唑法、紫外吸收法、愈创木酚法进行测定,谷胱甘肽还原酶(GR)、苯丙氨酸解氨酶(PAL)分别采用Ellman[19]方法、Koukol[20]方法进行测定;地下部分用TTC法测定根系活力[21]。
1.3.3 主要氮代谢物测定
参照Cai等[22-23]方法,采用超高效液相色谱-紫外检测器检测烟苗叶片中21种氨基酸,天冬氨酸(Asp)、谷氨酸(Glu)、天门冬酰胺(Asn)、丝氨酸(Ser)、谷氨酰胺(Gln)、组氨酸(His)、甘氨酸(Gly)、苏氨酸(Thr)、精氨酸(Arg)、γ-氨基丁酸(Gaba)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、蛋氨酸(Met)、色氨酸(Trp)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、鸟氨酸(Orn)、赖氨酸(Lys)和7种生物胺,酪胺(Ta)、亚精胺(Spd)、精胺(Spm)、色胺(Try)、苯乙胺(Pea)、腐胺(Put)、胍基丁胺(Agm)和铵离子(NH4+);采用气相色谱-氮化学发光检测器检测4种生物碱,烟碱(NIC)、降烟碱(NNIC)、新烟草碱(ATB)、假木贼碱(ABS)。
1.4 数据处理
采用Excel 2010和SPSS 26.0进行数据统计分析,Origin8.0与MetaboAnalyst 4.0(https://www.metaboana lyst.ca/)分别绘制图表与代谢物差异分析。
2 结果与分析
2.1 2, 6-DIPA对烟苗生长特性与生物量的影响
由表1可知,2, 6-DIPA加入15 d后,与CK相比,各处理烟苗的叶片数和根冠比无显著差异,株高、茎围、最大叶面积、地上部鲜、干重均随2, 6-DIPA浓度增大呈减小趋势,而地下部鲜、干重表现为先增后减。与CK相比,T1、T2、T3的株高分别降低了26.87%、58.68%、79.43%,茎围分别减小了1.04%、12.71%、23.96%,最大叶面积分别减少了27.51%、63.84%、84.32%,植株地上部鲜重降幅分别达到 20.00%、42.19%、71.05%,对应干重分别降低4.76%、33.33%、53.03%,且T1处理株高、茎围、地上部鲜、干重与CK无显著差异,T2、T3处理与CK差异达显著水平,而最大叶面积T1、T2、T3处理均较CK显著减小。T1处理地下部鲜重比CK增加2.78%,对应干重增加7.14%,但T2、T3鲜重分别较CK显著降低了27.78%和68.06%,对应干重分别显著降低28.57%和57.14%。表明低浓度2, 6-DIPA对烟苗地上部的影响大于地下部,而中、高浓度显著抑制烟苗整体生长。

表1 不同处理对烟苗生长特性的影响
注:同行数据后不同小写字母表示不同处理差异达显著水平(<0.05),下同。
Note: Different lowercase letters after data in the same line indicate significant difference between different treatments(<0.05), the same as below.
2.2 2, 6-DIPA对烟苗根系生长的影响
由表2可知,2, 6-DIPA处理15 d后T1烟苗的根系总长、根投影面积、根体积、根尖数、分支数、交叉数等均较CK减小,但差异未达显著水平,而T2、T3与CK相比,降幅较大且差异显著。烟苗根平均直径表现为随2, 6-DIPA浓度增大而增加,较CK而言,T1、T2、T3分别显著增加13.16%、26.32%、34.21%。说明低浓度2, 6-DIPA对根系影响较小,中、高浓度条件下抑制较为明显,但各浓度对根平均直径均表现为促进作用。
表2 不同处理对烟苗根系生长的影响
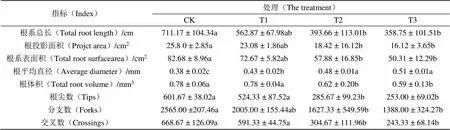
Tab.2 Effect of different treatments on root morphological characteristics of tobacco seedlings
2.3 2, 6-DIPA对烟苗根系活力与叶绿素含量的影响
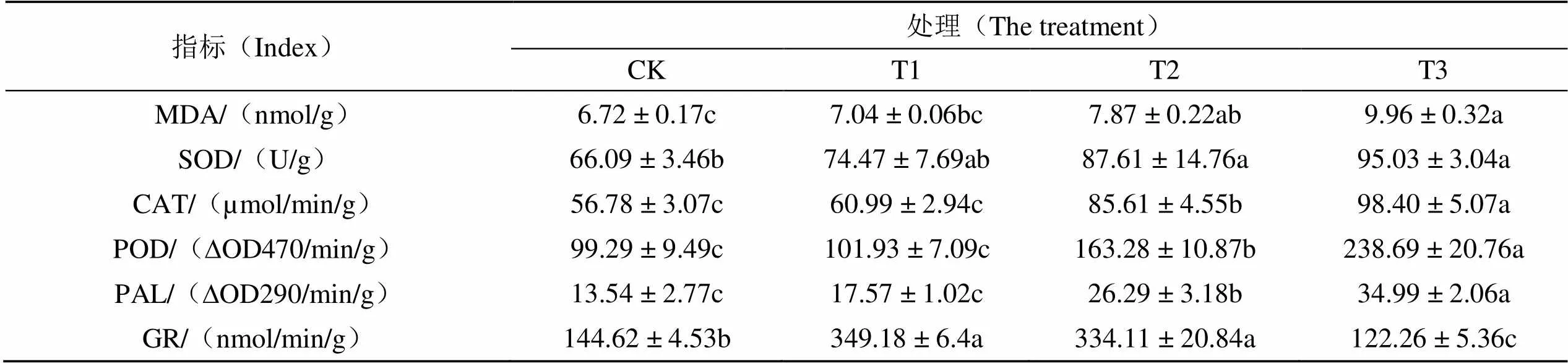
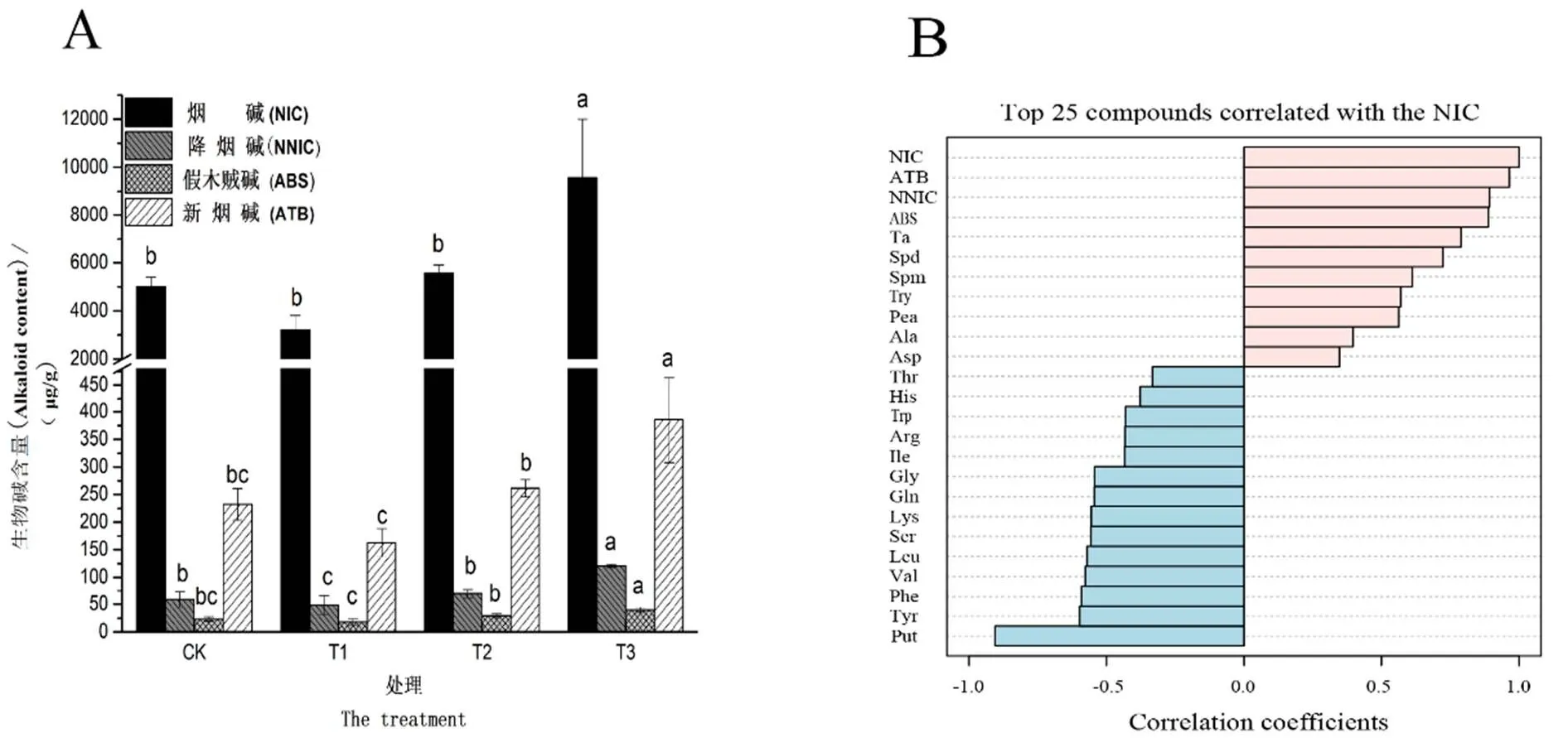
由图1A可知,烟苗的根系活力随2, 6-DIPA浓度增加逐渐减弱,T1、T2、T3分别比CK降低3.74%、13.45%和22.82%,T1根系活力与CK相比差异不显著,而T2、T3较CK差异达显著水平,表明低浓度2, 6-DIPA对烟苗根系活力影响较小。烟苗叶片中的叶绿素含量与处理浓度间呈显著正相关关系(图1B),总体趋势为CK 注:图中小写字母表示不同处理间差异达显著性水平(P<0.05),下同。 由表3可知,MDA含量随2, 6-DIPA浓度增大而增加,与CK相比,T1、T2、T3分别增加了4.76%、17.11%和48.21%,且T1差异不显著,T2、T3差异达显著水平。烟苗叶片中的SOD、CAT、POD、PAL活性与2, 6-DIPA浓度呈正相关,T3增幅最大,且与CK相比,4种酶活性分别增加了43.79%、73.30%、140.40%和158.42%。表明T2时虽有大量膜脂过氧化产物积累,但此时烟苗的抗氧化系统与苯丙烷合成途径被激活,使其受损程度有所减轻。此外,GR活性在T1时较CK增加了141.45%,T2开始呈下降趋势,低于T1但仍显著大于CK,T3急剧减小,且较CK显著降低了15.46%。 表3 不同处理对烟苗叶片中MDA含量及抗逆酶活性的影响 Tab.3 Effects of different treatments on MDA content and related stress-resistant enzyme activities in tobacco leaves 2.5.1 生物碱含量变化与生物胺的相关性分析 如图2A所示,不同处理下,烟苗中NIC、NNIC、ABS、ATB变化趋势相似。与CK相比,T1时NIC、NNIC、ABS、ATB含量分别减少35.54%、17.27%、22.69%、29.99%,T2时分别增加10.91%、18.17%、24.86%、12.56%,T3时增幅显著且分别增加90.36%、104.92%、71.55%、60.05%,烟苗生物碱含量整体表现为“低抑高促”。进一步利用MetaboAnalyst 4.0中的PatternHunter数据分析对NIC与生物胺进行相关性分析,以±0.6为截止点,其中,NNIC、ABS、ATB、Try、Pea、Spd与NIC呈显著正相关,而Put与NIC呈显著负相关(图2B)。表明烟苗在2, 6-DIPA作用下,其微量生物碱和生物胺的含量组成与NIC合成密切相关。 图2 不同处理对生物碱的影响(A)及烟碱与生物胺的相关性分析(B) 2.5.2 主要氮代谢物差异分析 以生物碱、氨基酸、铵离子及生物胺为变量,利用MetaboAnalyst 4.0 对样品进行主成分分析,以获得不同浓度2, 6-DIPA处理对烟苗相关氮代谢物的影响。从图3A可见,PC1(主成分1)与PC2(主成分2)分别能解释变量方差的60.50%与20.70%,累计贡献率为81.20%,且不同处理在PC轴上出现明显分化,CK与T1区分主要在PC2,CK与T2、T3区分主要在PC1,表明CK与T1差异较小,与T2、T3差异较大,该结果也表明2, 6-DIPA使烟苗相关氮代谢发生改变且具有浓度差异。进一步利用偏最小二乘判别分析筛选模型变量投影重要性(VIP)值>1.1的变量(图3B),结合方差分析Fisher's LSD值≤0.05,获得15个对区分具有重要贡献的氮相关代谢物,其中,Phe、NH4+、Asn、Tyr、Gln、Trp、Thr、Arg、His、Ile、Val、Ser等12个代谢物表现为T3显著下调,仅Ala、Asp与Try表现为T3显著上调,表明2, 6-DIPA对烟苗叶片中的氮代谢途径具有调控作用,且主要表现为对氮代谢物的下调作用。 图3 主成分分析(A)及变量重要性贡献图(B) 逆境胁迫下植物会通过自身一系列生理生化调节以适应新环境[24]。本研究表明,中、高浓度2, 6-DIPA显著抑制烟苗的表型,而低浓度影响相对较小,且该浓度处理时烟苗地下部生物量有所增加,这一现象说明低浓度2, 6-DIPA在阻碍烟苗生长的同时,可以通过增加地下部生物量以维持烟苗正常的生理机能。植物遭受外源胁迫时,叶绿素含量也可用于反映其代谢情况和抗逆性[25]。金桂芳等[26]研究表明盐胁迫下20 mg/L有机胺(PTMAC)能显著提高小麦幼苗中的叶绿素含量,景涛等[27]探究向日葵对苯胺废水的耐受性,发现苯胺浓度为100 mg/L时,向日葵的净光合速率较对照显著升高。本研究烟苗叶片中叶绿素含量随2, 6-DIPA浓度增大而增加,该现象与文献报道结果类似,导致这一现象的原因可能是2, 6-DIPA使烟苗生长受阻从而产生“浓缩效应”,促使其单位质量及单位面积叶片的叶绿素含量显著增加,最终使烟苗叶色随处理浓度增加[28];也可能是2, 6-DIPA功能类似于多胺,其一方面通过与类囊体膜上带负电的离子结合,使膜稳定性增强,从而提高叶绿素的含量[29],另一方面通过参与膜的构成以减缓膜脂过氧化及膜蛋白的水解作用,使类囊体膜的组成保持相对稳定,从而减少叶绿素的损失[30]。植物在遭受外源胁迫时,细胞内会发生过氧化反应,产生并积累大量膜脂过氧化产物MDA,这将诱导抗氧化系统做出应激反应[31]。有研究报道,MDA超过植物的耐受程度时,抗氧化酶活性会被抑制,酶系统遭到破坏,从而造成植物死亡[32]。本研究烟苗叶片中MDA含量随2, 6-DIPA浓度增大而增加,SOD、CAT、POD、PAL等4种抗逆性酶活性也与2, 6-DIPA浓度呈正相关,当处理浓度达88.5 µg/mL时,4种抗逆性酶活性仍表现为增加趋势,说明本试验设置浓度范围内,2, 6-DIPA能激发烟苗的抗逆性但未超过其耐受程度。此外,植物体内的GR在活性氧清除过程中也发挥着重要作用[33],本研究GR酶活性在2, 6-DIPA低浓度时升高,中、高浓度时逐渐降低,变化趋势与其它几种抗逆性酶有差异,这可能是因为烟苗叶片中的GR不仅参与烟苗的抗氧化过程,部分还用于维持烟苗正常的光合作用[34]。 生物碱是烟叶的重要质量指标,其组成和含量直接影响烟草制品的生理强度、烟气特征和安全性[35],生物碱适宜的含量和合理的组成是优质低害烟叶生产的必然要求,NIC作为主要的生物碱,占总生物碱含量的90%以上,其含量组成尤为重要[36-37]。本研究中,不同浓度2, 6-DIPA作用下,烟苗叶片中的NIC及其它3种生物碱总体随2, 6-DIPA浓度呈现“低抑高促”的趋势,生物碱与内源胺的高相关性(>0.6),证明了生物碱的合成途径与植物内源多胺密切相关[38]。Put、Spm及Spd等是合成NIC的主要多胺,本研究中Put与NIC呈负相关,Spm、Spd与NIC呈正相关,这是由于Put作为吡咯烷的合成前体,高浓度2, 6-DIPA可能诱导腐胺-N-甲基转移酶高表达合成吡咯烷,促进NIC的形成,同时还提高亚精胺合成酶的表达,使Spd与Spm合成增加[38]。此外,生物碱的合成还与Try、Ta等芳香胺呈显著正相关,这可能与芳香族L-氨基酸脱羧酶活性相关[39]。主成分分析显示2, 6-DIPA使烟苗氮代谢发生改变,其主要影响烟苗对NH4+的吸收,从而导致Gln、Ser、Val、Ile等的合成下调,而与生物碱合成相关的氮代谢物(Ala、Asp与Try等)表现为上调,该结果与生物碱变化趋势具有一致性。从代谢途径来看,氮代谢的差异物质主要富集在氨酰-tRNA生物合成,精氨酸生物合成,谷氨酰胺、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,吲哚生物碱生物合成等代谢通路上。 本研究表明,2, 6-DIPA对烟苗生长、生理及氮代谢均有不同程度影响。若将PBAT生物降解地膜应用于烟草实际种植中,考虑到芳香胺在土壤中的吸附性较强(如苯胺在不同类型土壤中吸附常数达2.61~19.42[40]),烟草对2, 6-DIPA的富集能力随之被削弱,最终导致2, 6-DIPA对烟草生长和生理的影响产生差异,但差异程度尚未明确。关于PBAT生物降解地膜长期使用后土壤中苯胺类添加剂的累积情况[41]及使用该材料制作漂盘进行漂浮式水培育苗时,其对烟草的影响仍需进一步评估。 (1)低浓度2, 6-DIPA对烟苗的生长发育影响相对较小,中、高浓度则明显抑制其生长,且随2, 6-DIPA浓度增加,烟苗整体通过“浓缩效应”增加其叶片中的叶绿素含量;(2)2, 6-DIPA能激活烟苗的抗氧化系统,提高抗逆性酶活性以维持自身正常生理机能;(3)2, 6- DIPA能显著调控氮相关代谢途径,表现为对大多数氮代谢物(氨基酸与生物胺)的下调作用,但在生物碱合成方面,表现为低浓度显著抑制生物碱合成,而中、高浓度显著促进。 [1] 高维常,蔡凯,曾陨涛,等. 农用地膜残留对土壤氮素运移及烤烟根系生长的影响[J]. 土壤学报,2020, 57(6): 1556-1563. GAO Weichang, CAI Kai, ZENG Yuntao, et al. Impacts of mulching plastic film residue on migration of soil nitrogen and growth of flue-cured tobacco roots[J]. Acta Pedologica Sinica, 2020, 57(6): 1556-1563. [2] Zeng L S, Zhou Z F, Shi Y X. Environmental problems and control ways of plastic film in agricultural production[J]. Applied Mechanics and Materials, 2013, 2301(593): 2187-2190. [3] 张淑敏,宁堂原,刘振,等. 不同类型地膜覆盖的抑草与水热效应及其对马铃薯产量和品质的影响[J]. 作物学报,2017, 43(4): 571-580. ZHANG Shumin, NING Tangyuan, LIU Zhen, et al. Weed infestation, soil moisture, and temperature under mulching cultivation with different films and the effects on yield and quality of potato[J]. Acta Agronomica Sinica, 2017, 43(4): 571-580. [4] 严昌荣,何文清,薛颖昊,等. 生物降解地膜应用与地膜残留污染防控[J]. 生物工程学报,2016, 32(6): 748-760. YAN Changrong, HE Wenqing, XUE Yinghao, et al. Application of biodegradable plastic film to reduce plastic film residual pollution in Chinese agriculture[J]. Chinese Journal of Biotechnology, 2016, 32(6): 748-760. [5] Rychter P, Kawalec M, Sobota M, et al. Study of aliphatic-aromatic copolyester degradation in sandy soil and its ecotoxicological impact[J]. Biomacromolecules, 2010, 11(4): 839-847. [6] Muroi F, Tachibana Y, Kobayashi Y, et al. Influences of poly (butylene adipate-co-terephthalate) on soil microbiota and plant growth[J]. Polymer Degradation and Stability, 2016, 129: 338-346. [7] Palsikowski P A, Roberto M M, Sommaggio L R D, et al. Ecotoxicity evaluation of the biodegradable polymers PLA, PBAT and its blends usingas test organism[J]. Journal of Polymers and the Environment, 2018, 26(3): 938-945. [8] Ügdüler S, Van Geem K M, Roosen M, et al. Challenges and opportunities of solvent-based additive extraction methods for plastic recycling[J]. Waste Management, 2020, 104: 148-182. [9] 宋雪英,崔小维,李嘉康,等. 邻苯二甲酸酯类塑化剂的土壤生态毒理学研究进展[J]. 生态环境学报,2016, 25(11): 1885- 1890. SONG Xueying, CUI Xiaowei, LI Jiakang, et al. Research advances in soil ecotoxicology of phthalic acid esters (PAEs) exposure[J]. Ecology and Environmental Sciences, 2016, 25(11): 1885-1890. [10] Cui H, Gao W C, Lin Y C, et al. Development of microwave- assisted extraction and dispersive liquid-liquid microextraction followed by gas chromatography-mass spectrometry for the determination of organic additives in biodegradable mulch films[J]. Microchemical Journal, 2021, 160: 105722. [11] Anadón A, Binderup M L, Bursch W, et al. Scientific opinion on the safety evaluation of the substance bis (2, 6‐diisopropylphenyl) carbodiimide for use in food contact materials[J]. EFSA Journal, 2010, 8(12): 1928. [12] 洪小燕,温裕云,林芳,等. 土壤及沉积物中25种芳香胺的固-液-液萃取及气相色谱-质谱测定方法初步研究[J]. 分析测试学报,2010, 29(1): 31-34. HONG Xiaoyan, WEN Yuyun, LIN Fang, et al. Preliminary study of 25 aromatic amines in soil and sediment matrices with solid-liquid-liquid extraction combining with GC-MS[J]. Journal of Instrumental Analysis, 2010, 29(1): 31-34. [13] Kim Y S, Park S, Kang K, et al. Tyramine accumulation in rice cells caused a dwarf phenotype via reduced cell division[J]. Planta, 2011, 233(2): 251-260. [14] Dai Y R, Michaels P J, Flores H E. Stimulation of ethylene production by catecholamines and phenylethylamine in potato cell suspension cultures[J]. Plant Growth Regulation, 1993, 12(3): 219-222. [15] Wang Y , Chen S, Deng C Y, et al. Metabolomic analysis reveals dose-dependent alteration of maize (Zea mays L.) metabolites and mineral nutrient profiles upon exposure to zerovalent iron nanoparticles[J]. NanoImpact,2021, 23: 100336. [16] 张明,游广永,崔军,等. 4种葫芦科植物对酞酸酯的胁迫反应与吸收[J]. 福建农林大学学报(自然科学版),2017, 46(6): 618-622. ZHANG Ming, YOU Guangyong, CUI Jun, et al. Stress response and absorption of 4 Cucurbitaceae plants to PAEs[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2017, 46( 6): 618-622. [17] 徐芬芬,叶利民,徐卫红,等. 小白菜叶绿素含量的测定方法比较[J]. 北方园艺,2010(23): 32-34. XU Fenfen, YE Limin, XU Weihong, et al. Comparison of methods of chlorophyll extraction in chinese cabbage[J]. Northern Horticulture, 2010(23): 32-34. [18] 张志良,瞿伟菁,李小芳. 植物生理学实验指导[M]. 高等教育出版社,2009. ZHANG Zhiliang, QU Weijing, LI Xiaofang. Plantphysiology experimental guidance[M]. Higher Education Press, 2009. [19] Ellman G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. [20] Koukol J, Conn E E. The metabolism of aromatic compounds in higher plants: IV. Purification and properties of the phenylalanine deaminase of Hordeum vulgare[J]. Journal of Biological Chemistry, 1961, 236(10): 2692-2698. [21] 李合生. 植物生理生化实验原理和技术[M]. 高等教育出版社,2000: 119-120. LI Hesheng. Principle and technology of plant physiology and biochemistry experiment[M]. High Education Process, 2000: 119-120. [22] Cai K, Xiang Z M, Li H Q, et al. Free amino acids, biogenic amines, and ammonium profiling in tobacco from different geographical origins using microwave-assisted extraction followed by ultra high performance liquid chromatography[J]. Journal of Separation Science, 2017, 40(23): 4571- 4582. [23] Cai K, Xiang Z M, Zhang J, et al. Determination of eight tobacco alkaloids in flue-cured tobacco samples by gas chromatography with nitrogen chemiluminescence detection (NCD)[J]. Analytical Methods, 2012, 4(7): 2095-2100. [24] 王立志,魏跃伟,黄明月,等. 低氮胁迫对烟草生物学性状、生长素及NtPINs基因家族的影响[J]. 中国烟草学报,2018,24(1): 38-44. WANG Lizhi, WEI Yuewei, HUANG Mingyue, et al. Effects of nitrogen deficiency stress on tobacco biological characters, auxin and NtPINs gene family[J], Acta Tabacaria Sinica, 2018, 24(1): 38-44. [25] 朱健,张道勇,潘响亮,等. 盐酸左氧氟沙星对凤眼莲生理特性的影响[J]. 贵州师范大学学报(自然科学版),2008, 26(2): 18-21. ZHU Jian, ZHANG Daoyong, PAN Xiangliang, et al. Resistance ofto levofloxacin hydrochloride[J]. Journal of Guizhou Normal University(Natural Sciences). 2008, 26(2): 18-21. [26] 金桂芳,于海彬. 有机胺(PTMAC)对盐胁迫小麦幼苗抗氧化能力的影响[J]. 生物技术通报,2012(10): 83-87. JIN Guifang, YU Haibin. Effects of organic amine (PTMAC) on the antioxidant activities of wheat seedlings under salt-stressed[J]. Biotechnology Bulletin, 2012(10): 83-87. [27] 景涛,谢会成,孙居文,等. 向日葵对苯胺废水的光合生理响应及净化效果[J]. 生态学报,2017, 37(18): 6091-6098. JING Tao, XIE Huicheng, SUN Juwen, et al. Tolerance and phytoremediation capacity of sunflower exposed to aniline wastewater[J]. Acta Ecologica Sinica, 2017, 37(18): 6091-6098. [28] 薛欣欣,鲁剑巍,李小坤,等. 不同施氮量下缺钾对水稻叶片营养及生理性状的影响[J]. 植物营养与肥料学报,2016,22(6): 1494-1502. XUE Xinxin, LU Jianwei, LI Xiaokun, et al. Nutritional and physiological characters of rice leaves exposure to potassium deficiency under different nitrogen rates[J]. Journal of Plant Nutrition and Fertilizers, 2016, 22(6): 1494-1502. [29] 王汉忠,赵福庚,张国珍. 多胺延缓植物衰老的机制[J]. 山东农业大学学报,1995(2): 227-232. WANG Hanzhong, ZHAO Fugeng, ZHANG Guozhen. Retardation of plant senescence by polyamines[J]. Journal of Shandong Agricultural University(Natural Science Edition), 1995(2): 227- 232. [30] Tiburcio A F, Besford R T, Capell T, et al. Mechanisms of polyamine action during senescence responses induced by osmotic stress[J]. Journal of Experimental Botany, 1994, 45(12): 1789- 1800. [31] 陈少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯,1991, 27(2): 84-90. CHEN Shaoyu. Injury of membrane lipid peroxidationg to plant cell[J]. Plant Physiology Journal, 1991, 27(2): 84-90. [32] 苏迪,程思思,张习敏,等. 干旱胁迫下铁皮石斛愈伤组织生理特性研究[J]. 贵州师范大学学报(自然科学版),2012, 30(5): 5-8. SU Di, CHENG Sisi, ZHANG Ximin, et al. Study on effect of drought stress on physiological characteristics of callus of[J]. Journal of Guizhou Normal University (Natural Sciences), 2012, 30(5): 5-8. [33] 林源秀,顾欣昕,汤浩茹. 植物谷胱甘肽还原酶的生物学特性及功能[J]. 中国生物化学与分子生物学报,2013, 29(6): 534-542. LIN Yuanxiu, GU Xinxin, TANG Haoru. Characteristics and biological functions of glutathione reductase in plants[J]. Chinese Journal of Biochemistry and Molecular Biology, 2013, 29(6): 534-542. [34] 丁顺华,陈珊,卢从明. 植物叶绿体谷胱甘肽还原酶的功能研究进展[J]. 植物生理学报,2016, 52(11): 1703-1709. DING Shunhua, CHEN Shan, LU Congming. Research progress on functions of glutathione reductase in chloroplasts of plants[J]. Plant Physiology Journal, 2016, 52(11): 1703-1709. [35] 史宏志,黄元炯,刘国顺,等. 我国烟草和卷烟生物碱含量和组成比例分析[J]. 中国烟草学报,2001, 7(2): 8-12. SHI Hongzhi, HUANG Yuanjiong, LIU Guoshun, et al. Alkaloid content and proportion in Chinese tobacco and cigarettes[J]. Acta Tabacaria Sinica, 2001,7(2): 8-12. [36] Cai K, Zhao H N, Yin R S, et al. Chiral determination of nornicotine, anatabine and anabasine in tobacco by achiral gas chromatography with ()-(-)-camphanic chloride derivatization: application to enantiomeric profiling of cultivars and curing processes[J]. Journal of Chromatography A, 2020, 1626: 461361. [37] 孙雨琦,赵园园,周迪, 等. 国内外不同产区和类型雪茄烟烟草特有亚硝胺及生物碱含量分析[J]. 中国烟草学报, 2020, 26(5): 30-38. SUN Yuqi, ZHAO Yuanyuan, ZHOU Di, et al. Analysis on TSNAs and alkaloid contents in different types of cigar tobacco from different regions at home and abroad[J]. Acta Tabacaria Sinica, 2020, 26(5): 30-38. [38] Dewey R E, Xie J H. Molecular genetics of alkaloid biosynthesis in[J]. Phytochemistry, 2013, 94: 10-27. [39] Facchini P J, Huber-Allanach K L, Tari L W. Plant aromatic-amino acid decarboxylases: evolution, biochemistry, regulation, and metabolic engineering applications[J]. Phytochemistry, 2000, 54(2): 121-138. [40] Song C C, Song Y Y. Adsorption and desorption behaviors of nitrobenzene and aniline by wetland soil[C]//2010 4th International Conference on Bioinformatics and Biomedical Engineering. IEEE, 2010: 5732-5736. [41] Ning X A, Liang J Y, Li R J, et al. Aromatic amine contents, component distributions and risk assessment in sludge from 10 textile-dyeing plants[J]. Chemosphere, 2015, 134: 367-373. Effects of 2, 6-diisopropylaniline additive in biodegradable mulch film on the growth, physiological properties and nitrogen metabolism of tobacco seedlings XIANG Mei1, 2, CAI Kai2, GAO Weichang2, YANG Lei3, ZHANG Jie2, DENG Qin1, PAN Wenjie2, WU Di1* 1 Guizhou Provincial Key Laboratory for Information Systems of Mountainous Areas and Protection of Ecological Environment, Guizhou Normal University, Guiyang 550001, China;2 Upland Flue-cured Tobacco Quality & Ecology Key Laboratory of China Tobacco, Guizhou Academy of Tobacco Science, Guiyang 550081, China;3 Tobacco Leaf Purchase Center, Hunan China Tobacco Industry Co., Ltd., Changsha 410109, China PBAT biodegradable mulch film is gradually replacing conventional mulch film for agricultural production. The aniline compound of 2,6-diisopropylaniline is the main additive in PBAT. Hence, evaluating the safety 2, 6-DIPA to crop is particularly important.Flue-cured tobacco K326 was treated with different concentrations (CK,T1/1.77 µg/mL, T2/17.7 µg/mL, T3/88.5 µg/mL) of 2, 6-DIPA at the seedling stage in hydroponic experiments. The growth, physiological properties and nitrogen metabolism of tobacco seedlings were analyzed and evaluated.The higher the concentration of 2, 6-DIPA, the more obvious the inhibition effect on tobacco growth was observed. The plant height, stem girth, maximum leaf area, biomass, root activity of tobacco seedlings were significantly decreased with the increase of 2, 6-DIPA concentration, but the chlorophyll contents was significantly increased with it. With the increase of 2, 6-DIPA concentration, MDA content, SOD, POD, CAT, PAL activity increased, while GR activity showed a tendency of first increasing and then decreasing. Analysis of nitrogen metabolism showed that 2, 6-DIPA significantly changed the nitrogen-related metabolites. The nicotine synthesis was significantly inhibited at low concentration of 2, 6-DIPA, and was promoted at high concentration. Most amino acids and related metabolites were significantly down-regulated at high concentrations of 2, 6-DIPA and only Ala, Asp and Try were drastically up-regulated.2, 6-DIPA can significantly change the agronomic traits of tobacco seedlings, and increase chlorophyll content and antioxidant enzyme activity, thus affecting the nitrogen absorption and interfering amino acid, alkaloid synthesis. tobacco; PBAT biodegradable mulch;2, 6-diisopropylaniline; growth and development; physiological characteristics; nitrogen metabolism . Email:1977@126.com 向美,蔡凯,高维常,等.生物降解地膜添加剂2, 6-二异丙基苯胺对烟苗生长、生理特性及氮代谢的影响[J]. 中国烟草学报,2022,28(2).XIANG Mei, CAI Kai, GAO Weichang, et al. Effects of 2, 6-diisopropylaniline additive in biodegradable mulch film on the growth, physiological properties and nitrogen metabolism of tobacco seedlings[J]. Acta Tabacaria Sinica, 2022,28(2).doi:10.16472/j.chinatobacco. 2021.180 贵州省科技计划项目“全生物降解地膜的组分组成及其胁迫下对烟草代谢机制研究”(黔科合基础[2019]1212);“贵州省百层次创新人才”(黔科合平台人才[2020]6020);贵州省烟草公司科技项目(201933)“烟用全生物降解地膜开发” 向美(1995—),硕士,主要研究方向:环境分析化学,Tel:0851-8411027,Email:908128465@qq.com 吴迪(1977—),Email:1977@126.com 2021-09-15; 2022-02-11
2.4 2, 6-DIPA对烟苗抗逆性的影响
2.5 2, 6-DIPA对烟苗氮代谢的影响

3 讨论
4 结论
