NaHCO3与典型气体协同灭火效果研究
2022-04-29梁天水张俊格毛思远张华杰
梁天水,张俊格,毛思远,张华杰
(郑州大学 力学与安全工程学院,河南 郑州 450001)
0 引言
随着哈龙灭火剂被禁用,其替代技术的研究大量涌现[1],如细水雾[2]、干粉灭火剂[3]、全氟己酮[4]等。其中干粉灭火剂以其高效、环保和低成本等特点广泛应用于各种类型的火灾,被认为是哈龙灭火剂的良好的替代品之一[5]。但干粉灭火剂存在颗粒较大、在全淹没式灭火过程中弥散性差、残留量较多等方面的问题。因此,国内外众多研究学者在超细粉体的制备以及灭火效能提升方面做了大量的工作。
一是降低粉体粒径,以期提高灭火效率。Chen等[6]制得平均粒径为7.2 μm超细磷酸二氢铵,发现其灭火效能是Halon1211和Halon1301的2~4倍,是七氟丙烷的5~8倍。王天政[7]利用实验平台对不同粒径粉体抑制瓦斯爆炸性能展开了研究,发现粒径较小的Mg(OH)2粉体,火焰的传播速度峰值和最大压力降幅较大。
二是不同灭火介质共同作用、相互协同,以期提高灭火效率。卢大勇等[8]通过理论预测模型和实验结果对比分析发现,七氟环戊烷与一溴三氟丙烯之间存在一定的协同灭火作用。梁天水等[9]发现当全氟三乙胺占灭火剂体积分数超过10%后,全氟己酮和全氟三乙胺具有较好的协同效果。赵洪海[10]通过实验,分析了气体间的协同灭火作用,发现以化学作用为主的灭火剂与以物理作用为主的气体灭火剂的复合灭火剂,能产生积极的协同灭火效果。对于粉体灭火介质,引入气体灭火剂驱动,不仅能够增加干粉在输送管道中的流动性,还有可能提高干粉在封闭空间的弥散性。目前,国内外关于气固协同灭火方面研究较少。孟祥卿[11]选取CO2、N2等惰性气体为气相抑制剂,NaHCO3为粉体抑爆剂,进行气固协同抑制甲烷爆炸研究,结果表明,在相同条件下,气固两相抑制剂对爆炸的抑制效果更好。但是对于NaHCO3粉体与惰性气体协同效果缺乏定量评估,最佳气固配比也缺乏数据支撑。
本文选用3种不同粒径的NaHCO3粉体为研究对象,采用杯式燃烧器获取其抑制熄灭甲烷火焰的临界灭火浓度,并选择灭火效果最好的粉体,继续开展与CO2、N2、He和Ar的协同灭火效果实验,通过计算协同因子定量评价气固的协同灭火效果,获得协同效果最佳的气固比例,为气固协同灭火相关研究提供一定理论指导和数据支持。
1 实验装置与方法
1.1 实验装置
实验装置由燃料供应系统、气体输送控制系统、粉体输送系统和出料速率测量系统等组成,具体布置如图1所示。燃料供应系统由燃烧杯、蜂窝整流层、外罩、燃料接口、高压气瓶和质量流量计等组成。选用甲烷气体作为燃料,燃烧杯内放置直径为3 mm小钢珠,保证甲烷气体均匀通过。设置甲烷流量为0.288 L/min,空气流量为20 L/min。空气和惰性气体均由质量流量计控制,并通入混合腔中预混。粉体输送系统由进料仓、螺旋杆、步进电机、控制器以及震动器组成。通过控制器调节步进电机的转速实现对粉体的定量输送,进料仓与震动器固定,保证粉体输送的稳定性。
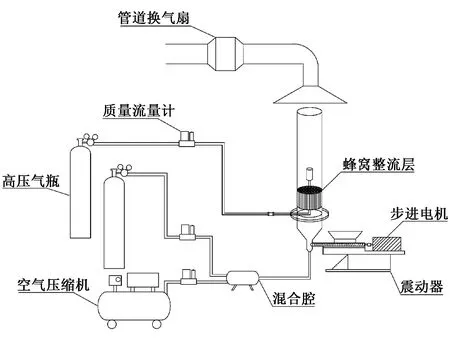
图1 粉体灭火装置
1.2 原材料及处理
一般而言,粒径在1~100 μm之间的粉体称为微米粉体,在0.1~1.0 μm 之间称为亚微米粉体,在1~100 nm之间称为纳米粉体,而将粒径小于10 μm 的粉体称为超细粉体。在消防灭火技术中,常用干粉灭火剂的平均粒径在10~75 μm之间,超细粉体的平均粒径一般为5 μm左右,本文选择的粉体粒径分别为48、10、4 μm,兼顾了一般粉体与超细粉体,具有较高的实际意义。原材料包括:NaHCO3粉体(48、10、4 μm,山东寿光学祥化工有限公司),疏水气相二氧化硅(10~20 nm,山东优索化工科技有限公司),CO2、N2、He、Ar气体(纯度为99.99%,上海熙乐化工有限公司)。先将NaHCO3粉体在60 ℃恒温干燥箱内干燥24 h蒸发水分,疏水气相二氧化硅的添加能够有效防止粉体发生团聚,取3%质量分数的疏水气相二氧化硅与干燥后的粉体在球磨机中充分混合,设置转速为120 r/min,运行时间为150 min,最终制得具有较好流动性、疏水性和分散性的粉体材料。
1.3 干粉临界灭火浓度测量
在实验开始前,采用高精度的电子天平结合质量采集软件测量不同粉体在特定转速下的出料质量曲线,并通过计算软件拟合出对应的出料速率。图2为4 μm NaHCO3在不同转速下对应的出料速率。
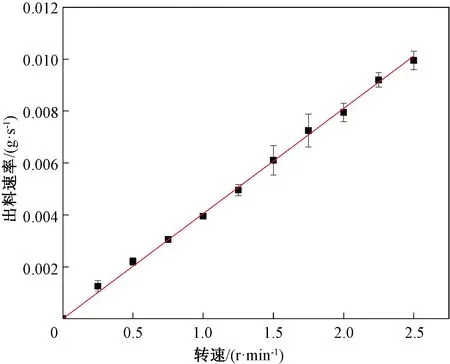
图2 4 μm NaHCO3出料速率标定曲线
利用粉体的出料速率和气体流量得出不同的气体氛围中的粉体浓度C为
(1)
式中:qn为粉体在转速n下的出料速率,g/s;Vair为通入的空气体积流量,L/min,本实验中固定为20 L/min;Vx·r为惰性气体流量示数为Vx时对应的实际体积流量,L/min;Vx为对应质量流量控制器的显示示数,L/min;r为对应惰性气体的转换系数。
1.4 实验方法
开启燃料供应系统,待甲烷气体在反应区内供应稳定后点燃甲烷气体进行预热,预燃60 s后,开始通入较低浓度的惰性气体,在该气体环境下继续预燃60 s,同时启动进料控制器和震动器,由小到大调节转速,若60 s内火焰未熄灭则继续增大转速重复上述过程,直至火焰熄灭。火焰熄灭时对应的粉体浓度即为在该浓度气体灭火剂环境下粉体的临界灭火浓度。为确保实验结果的准确性,在实验条件相同的情况下重复实验5次取平均值,得到平均临界灭火浓度。然后继续增大空气中惰性气体的体积分数,重复上述操作,即得到不同体积分数下粉体的临界灭火浓度。
2 结果与讨论
2.1 典型气体灭火剂抑制熄灭甲烷火实验
为保证实验的准确性,分别选用CO2、N2、He、Ar气体作为灭火剂进行抑制熄灭甲烷火的实验,以确定在实验条件下不同气体抑制熄灭甲烷火焰的临界灭火浓度,并与前人研究相比较,确保数据的准确性。表1为实验测得各气体灭火剂的临界灭火浓度与Takahashi等[12]实验数据的对比情况。
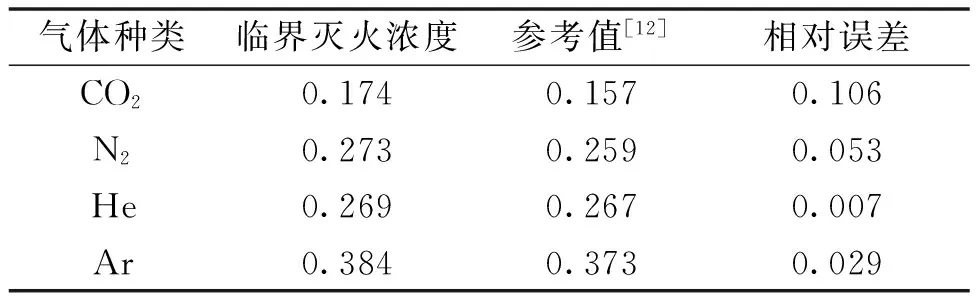
表1 典型气体灭火剂临界灭火浓度
由表1可知,不同惰性气体灭火剂的临界灭火浓度差别较大,各典型气体灭火剂抑制熄灭甲烷火的临界灭火浓度与前人研究所得结果吻合度较高,灭火效果从高到低排序依次为CO2>He ≈ N2>Ar,说明实验装置有一定的可靠性,可以用来进行粉体临界灭火浓度测量。
2.2 典型干粉抑制熄灭甲烷火实验分析
为确保实验的准确性,采用电子扫描电镜(SEM)对制备的不同粒径NaHCO3(平均粒径为4、10 μm)粉体进行微观结构、粒径分布以及团聚情况进行观察,结果如图3所示。由图3可知,经过处理的NaHCO3粉体改性效果好,没有出现团聚现象,颗粒分布较为均匀,可以用来进行下一步实验。

图3 2种不同粒径粉体的扫描电镜图
使用综合量热仪对NaHCO3(4 μm)粉体进行表征,结果如图4所示。4 μm NaHCO3粉末在81.2 ℃时开始分解,吸热峰值出现在148.7 ℃,在174.1 ℃时样品重量迅速下降至73.9%,期间对应2个吸热峰,分别为NaHCO3受热分解为Na2CO3,Na2CO3进一步分解为Na2O和CO2,随着温度的增加,样品继续平稳分解,在800 ℃时质量下降至68.1%。由图4可知,NaHCO3分解温度低,分解产生的CO2能够稀释火焰周围的氧气浓度,在实验过程中取得了较好的灭火效果。

图4 NaHCO3粉体的TG-DSC曲线
对3种不同粒径的NaHCO3粉体进行熄灭甲烷火实验,其临界灭火浓度如表2所示,灭火效能排序依次为4 μm NaHCO3>10 μm NaHCO3>48 μm NaHCO3。随着NaHCO3粒径的减小,在相同质量下,粒径小的粉体比表面积大,在火焰中分解更加充分,物理和化学灭火机理均得到增强,灭火效能显著提升,从原理上来讲,粉体粒径越小,灭火效率越高,此为一般规律。其中4 μm NaHCO3粉体熄灭甲烷火用量较10 μm NaHCO3粉体灭火剂降低45.7%,其灭火效能约为10 μm NaHCO3干粉的2.2倍。
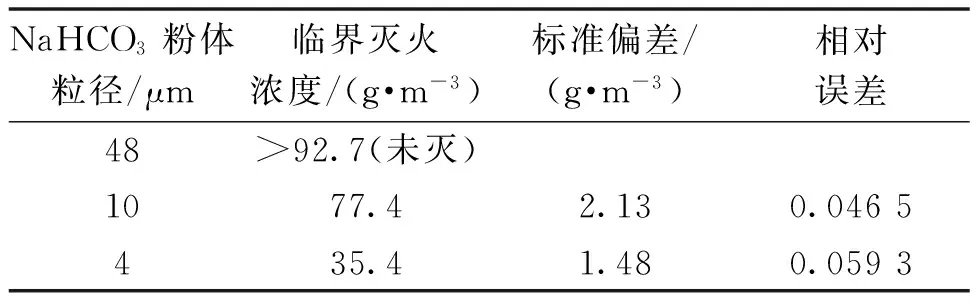
表2 典型粉体临界灭火浓度
使用NaHCO3粉体灭火的过程中发现,Na元素参加了反应,火焰呈亮黄色。以4 μm NaHCO3粉体灭火过程为例,其抑制熄灭甲烷火焰过程如下图5所示。在未施加粉体前,火焰处于稳定燃烧状态,如图5(a)所示,火焰上部呈橘黄色,底部火焰为蓝色,火焰形状较稳定不随时间而波动,在粉体接触火焰后,由于焰色反应使得火焰整体变为黄色,亮度增加,外焰伸长,燃烧范围扩大如图5(b)所示;随着粉体浓度的上升,火焰形状也在发生剧烈的变化,火焰的高度开始变小,直径增大,呈现出一种被“压缩”的状态,如图5(c)、5(d)所示;在NaHCO3粉体的持续作用下,粉体被火焰卷吸进入火焰底部,造成火焰底部被抬升,并短暂脱离杯口,此时火焰结构被破坏,火焰产生的热辐射减少,链式反应难以为继,火焰濒临熄灭,如图5(e)、5(f)所示;最终火焰熄灭,如图5(g)所示。

图5 碳酸氢钠粉体抑制熄灭火焰变化
干粉灭火剂的灭火方式主要分为物理灭火机理与化学灭火机理,其中物理灭火机理主要为灭火组分受热分解吸收火焰热量,进而降低火焰温度。关于NaHCO3粉体灭火的化学机理,Ni等[13]对NaHCO3的均相反应进行研究,提出反应生成的NaOH能够有效捕捉H·和·OH自由基,并且随着NaHCO3粉体粒径的减小,其分解速度更快,能加快NaOH的生成速率,阻断火焰的链式反应。主要的化学反应过程如下:
2NaHCO3→Na2CO3+H2O+CO2↑
Na2CO3→Na2O+CO2↑
Na2O→Na2O↑
Na2O+H2O→2NaOH
NaOH+H·=Na+H2O
NaOH+OH·=NaO+H2O
2.3 超细粉体与气体灭火剂协同灭火实验分析
为了衡量NaHCO3粉体与不同气体灭火剂的协同灭火效果,引入协同因子F进行量化表征,具体表达式为
(2)
式中:C0和X0分别为单独使用粉体和气体灭火剂熄灭火焰的临界灭火浓度;C为在气体灭火剂体积分数为X(X≤X0)时,粉体对应的临界灭火浓度。若协同因子F小于1,则说明气固灭火剂具有正协同效应,反之,则具有负协同效应。
因粒径越小灭火效果越好,所以选取4 μm的NaHCO3粉体作为研究对象,分别在4种典型气体灭火剂环境下协同熄灭甲烷火焰。改变空气中气体灭火剂的体积分数,得到NaHCO3粉体在不同气体灭火剂浓度下的临界灭火浓度如图6所示。随着气体灭火剂体积分数的不断增加,NaHCO3粉体的临界灭火浓度有显著下降,但继续增加气体灭火剂浓度,其临界灭火浓度下降缓慢。在不同的气体灭火剂氛围下,临界灭火浓度下降趋势有一定的相似性。
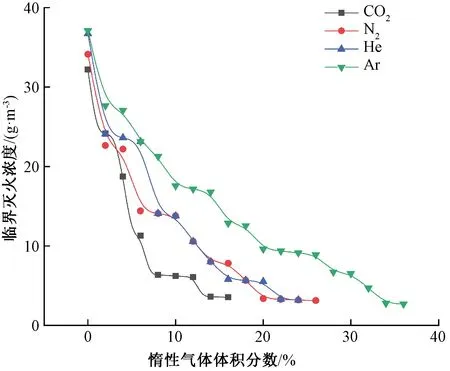
图6 不同气体灭火剂浓度下粉体(4 μm)的临界灭火浓度
NaHCO3粉体与不同气体灭火剂的协同效果如图7所示。随着气体灭火剂体积分数的不断增大,粉体对应的协同因子均小于1,表现出不同程度的正协同效果,这可能是因为化学灭火剂与物理灭火剂可以产生协同效果[10],产生了积极的协同灭火效果。该结果与孟祥卿[11]气固协同抑爆的研究结果相吻合,表明气固协同有效提升了超细粉体的灭火性能。
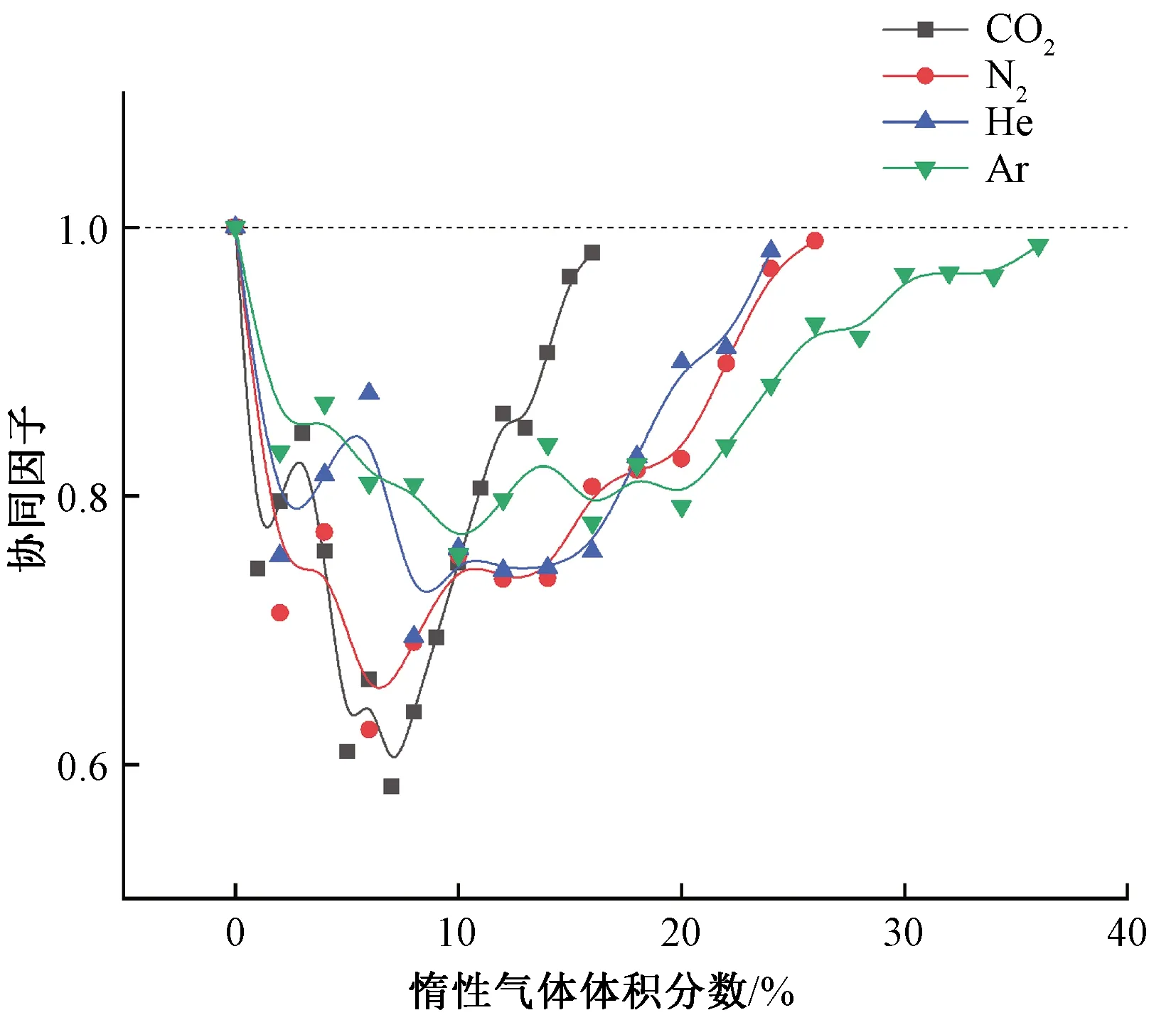
图7 不同体积分数下粉体(4 μm)的协同因子
在CO2、N2、He、Ar气体作用下,4 μm NaHCO3粉体的协同效果分别在气体体积分数为7.1%、6.4%、8.5%、10.1%处达到峰值,协同因子分别为0.58、0.62、0.69、0.76。说明该粉体与不同气体灭火剂均存在最佳气固配比浓度,继续增加气体灭火剂浓度,协同效果趋于下降,并且对应粉体的临界灭火浓度下降不明显。气体灭火剂的添加会稀释空气中氧气浓度,改变火焰周围空气的热容,能够有效降低火焰温度;而固体颗粒的加入,能够对甲烷燃烧产生的H·和·OH等自由基进行捕捉,进一步阻断燃烧链式反应。因此,火焰熄灭可能是通过两个方面实现的:一方面是气体灭火剂的加入和固体颗粒的吸热分解降低火焰温度;另一方面是固体颗粒通过化学作用阻断燃烧链式反应。这只是基于实验结果和已经建立的灭火理论的假设,为了探究气固协同灭火的详细机理,需要对火焰温度、火焰内自由基种类及变化进行更多的测量。
3 结论
(1)通过对典型粉体的实验,得出灭火效能排序为4 μm NaHCO3>10 μm NaHCO3>48 μm NaHCO3,4 μm NaHCO3粉体的灭火效能是10 μm NaHCO3的2.2倍。
(2)4 μm NaHCO3粉体与CO2、N2、He、Ar气体灭火剂之间均有良好的协同效果。4 μm NaHCO3粉体分别在体积分数为7.1%、6.4%、8.5%、10.1%时协同效果达到峰值,对应协同因子为0.58、0.62、0.69、0.76。
(3)与N2、He和Ar气体相比,CO2气体与NaHCO3粉体具有最佳的协同灭火效果。
