超声监测下清宫术治疗剖宫产瘢痕妊娠的临床价值
2022-04-24张耀匀李玉娜谢爱静班艳丽戴红英
张耀匀,韩 毅,李玉娜,谢爱静,班艳丽,戴红英*
(1.青岛大学附属医院妇科,青岛 266000;2.山东大学齐鲁医院妇产科,济南 250012)
剖宫产术后子宫瘢痕妊娠(cesarean scar pregnancy,CSP)是指受精卵着床于前次剖宫产的瘢痕处,是一种特殊类型的异位妊娠。CSP在总体妊娠人群中的发生率约为 1∶3000[1]。近年来,随着二胎政策的放开,剖宫产率升高,CSP发病率也随之增加。若不及时治疗,CSP有胎盘植入、子宫破裂、大出血的风险,故一旦确诊需引起重视。目前临床上最常用的治疗方式是超声监测下清宫术,具有创伤小、花费低、恢复快且并发症少等优点。本研究通过回顾分析299例CSP患者的临床资料,探讨超声监测下清宫术治疗CSP的可行性与安全性,分析其失败的危险因素,以更好地为临床提供指导。
1 资料与方法
1.1 一般资料 选取2015年1月至2020年6月青岛大学附属医院收治的299例诊断为CSP并以超声监测下清宫术为初始治疗方案的患者为研究对象,收集并分析患者的临床资料。纳入标准:既往有剖宫产手术史,符合CSP超声诊断标准[2];术前未行药物预处理;排除严重系统性疾病;均处于早孕期(孕周≤12周);临床资料完整。根据2016年中华医学会专家共识[3]将所有患者进行回顾性分型,其中Ⅰ型130例,Ⅱ型166例,Ⅲ型3例。再根据山东大学齐鲁医院康彦君等[4]提出的实用临床分型将所有患者进行回顾性分型:Ⅰ型,瘢痕厚度>3mm。Ⅱ型,瘢痕厚度≤3mm 且>1mm:Ⅱa型,妊娠囊或包块平均直径≤3cm,Ⅱb型包块或妊娠囊平均直径>3cm。Ⅲ型,瘢痕厚度≤1mm:Ⅲa型,包块或妊娠囊平均直径≤6cm,Ⅲb型,包块或妊娠囊平均直径>6cm。其中Ⅰ型130例,Ⅱa型128例,Ⅱb型35例,Ⅲa型6例,Ⅲb型0例。经子宫动脉栓塞(uterine artery embolization,UAE)预处理后再行超声监测下清宫术(UAE组)者26例;未进行预处理直接行超声监测下清宫术(直接清宫组)者273例,根据治疗结果分为成功组(n=249)和失败组(n=24)。收集并对比分析所有患者的一般资料、超声指标及随访情况。
1.2 治疗方法 行经腹+经阴联合超声确定相关指标,告知患者及家属可能存在的风险并签署同意书。UAE预处理的患者在UAE术后48h内行超声监测下清宫术。超声监测下先清除剖宫产瘢痕部位以外的妊娠组织,用300~400mmHg负压轻轻吸引瘢痕部位,至超声显示内膜线清晰、宫腔内无妊娠囊,检查吸出物有绒毛组织,清宫结束。如有活动性出血,宫颈注射垂体后叶素或欣母沛、静滴缩宫素、填塞Foley尿管等,若仍不能有效止血,则更改为其他术式或行子宫动脉栓塞术。术后缩宫素静滴,抗生素预防感染。若术后1天阴道流血不多则予出院。出院后每周复查血β-HCG值,随访血β-HCG降至正常的时间;术后1月复查超声。
1.3 治疗失败的标准 术中、术后出血过多或止血困难导致更改术式或行子宫动脉栓塞术。术后复查超声提示宫腔下段异常包块持续存在并伴有血流信号,且血β-HCG值下降不满意,需给予MTX或米非司酮补充治疗,甚至再次手术。
1.4 观察指标 一般资料:停经时间、年龄、孕次、剖宫产次数、流产次数、距末次剖宫产时间。辅助检查:血β-HCG、孕囊大小、瘢痕厚度、血流信号、有无心管搏动。其中根据超声测量将血流情况分为三级:1级:病灶内部或周围无明显血流信号或少量点条状血流信号;2级:病灶内部或周围见多个点条状血流信号;3级:病灶周边花色血流信号或动静脉瘘形成。手术及随访指标:术中出血量、住院时间、住院费用、术后血β-HCG恢复正常时间、UAE术后有无并发症。
1.5 统计学处理 应用SPSS 26.0统计软件,受试者工作曲线(ROC曲线)采用MedCalc软件进行分析。计量资料以均数±标准差表示,应用两独立样本t检验,计数资料以例数表示,应用卡方检验或Fisher确切概率法。应用单因素方差分析进行多组间均数比较;应用多因素logistic分析CSP清宫术失败的危险因素;通过ROC曲线计算曲线下面积(AUC),根据约登指数计算各项危险因素的最佳预测值及相对应的敏感度、特异度。P<0.05为差异有统计学意义。
2 结 果
299例患者中,UAE预处理组26例,直接清宫组273例。直接清宫组中,成功249例(91.2%),失败24例(8.8%)。24例失败病例中,无子宫破裂、切除子宫等事件发生,4例(IIa型)行宫腔镜清除残余病灶;9例因术中或术后止血困难行其他手术方式:其中开腹手术5例,腹腔镜手术2例,经阴道手术2例;5例因出血较多行急症子宫动脉栓塞;2例术后持续阴道流血,介入栓塞后行开腹手术;4例因术后血β-HCG值下降不满意口服米非司酮或MTX治疗。按中华医学会分型的II型患者共166例,其中UAE组21例,清宫组145例。
2.1 Ⅱ型CSP患者不同治疗方式的对比 UAE组与清宫组患者在年龄、停经时间、妊娠次数、剖宫产次数、流产次数、距末次剖宫产的时间、胎心搏动、瘢痕厚度、血β-HCG值、孕囊最大径线、血流信号、血β-HCG值降至正常的时间、成功率等方面比较,差异均无统计学意义(P>0.05)。而在出血量、住院时间、住院费用方面比较,差异有统计学意义(P<0.05)。UAE组患者的术中出血量低于清宫组,而住院时间与住院费用却明显高于清宫组。UAE后清宫组的CSP患者中,有3例患者术后出现发热,经抗感染治疗后好转出院;有2例患者术后出现穿刺部位所在下肢的麻木或不规律的疼痛。见表1。
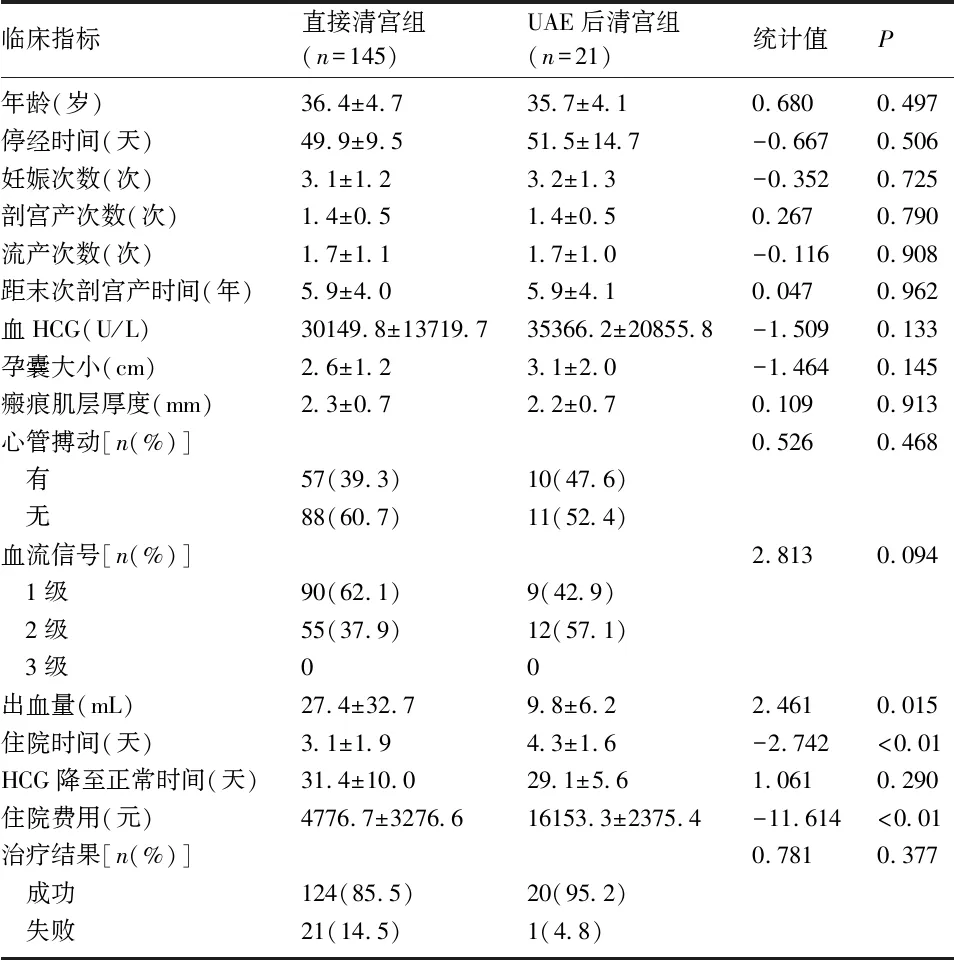
表1 中华医学会专家共识Ⅱ型CSP患者不同治疗方式效果对比的单因素分析
2.2 清宫组患者基本临床资料的单因素分析 直接清宫组中,成功组与失败组患者的年龄、停经时间、妊娠次数、剖宫产次数、流产次数、距末次剖宫产时间、胎心搏动等比较,差异均无统计学意义(P>0.05);而在临床分型、瘢痕处肌层厚度、血β-HCG值、孕囊最大径线、血流信号、出血量、住院时间、血β-HCG值降至正常的时间等方面比较,差异有统计学意义(P<0.05)。成功组患者的孕囊最大径线、术前血β-HCG值、血流信号明显低于失败组,瘢痕处肌层厚度明显高于失败组;各临床分型直接清宫的成功率分别为:Ⅰ型97.7%、Ⅱa型93.3%、Ⅱb型54.4%、Ⅲ型0%,由此可见,Ⅰ型与Ⅱa型直接清宫成功率较高,Ⅱb型成功率明显降低(P<0.01)。见表2。
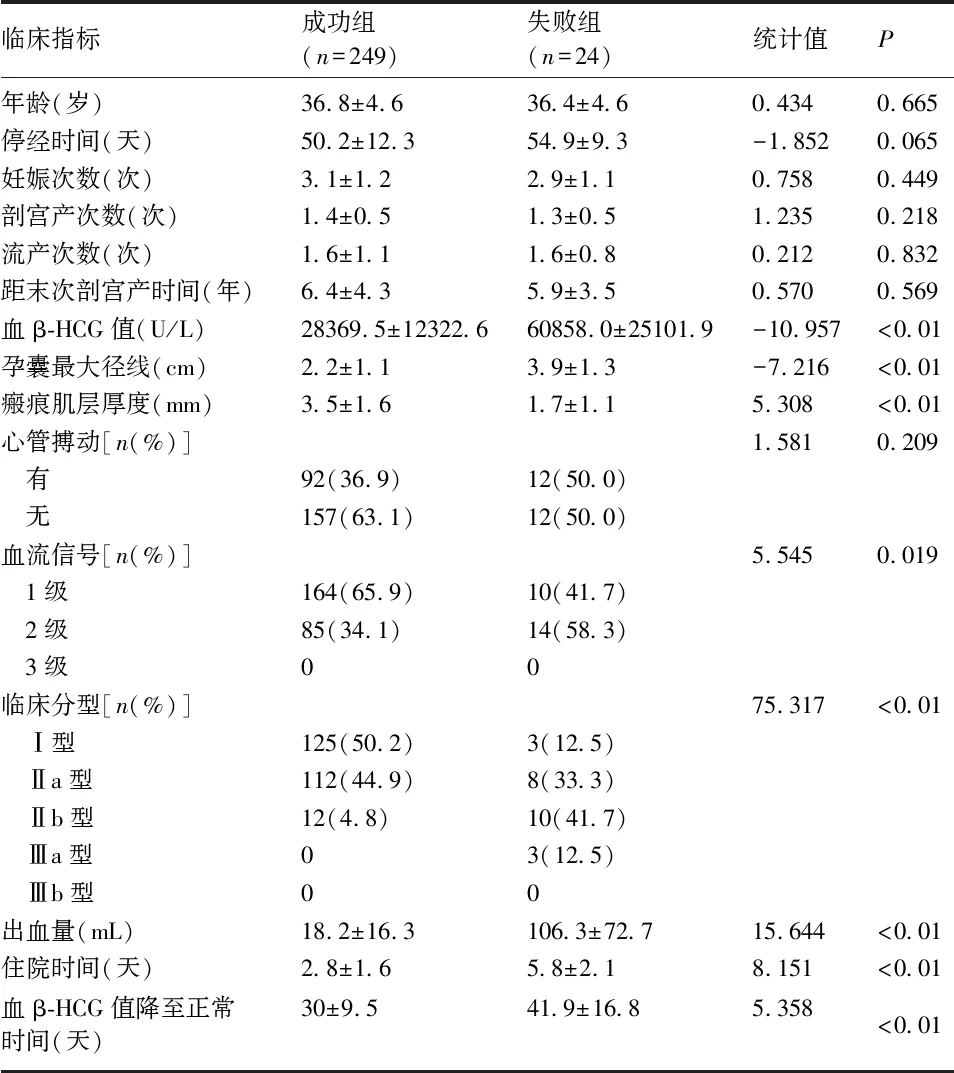
表2 直接清宫组中成功组和失败组患者临床资料的单因素分析结果
2.3 CSP直接行清宫术失败危险因素的多因素logistic分析 将单因素分析中有统计学意义的临床指标进行赋值,然后进行多因素logistic回归分析,结果显示,孕囊最大径>2.8cm(OR=5.841,95%CI为 2.051~16.634)、瘢痕处肌层厚度<2.5mm(OR=13.058,95%CI为4.005~42.576)、血β-HCG值>30000(OR=6.311,95%CI为1.883~21.151)是清宫失败的独立危险因素。见表3。
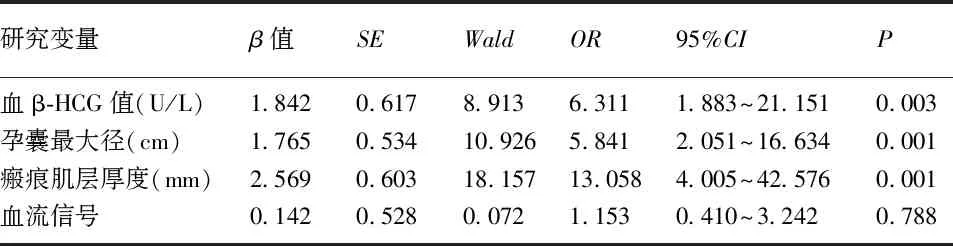
表3 清宫失败的多因素logistic回归分析结果
2.4 ROC曲线计算清宫失败危险因素的预测价值 血β-HCG值预测清宫失败风险的AUC为0.858,95%CI为0.811~0.898,血β-HCG值为43720U/mL时,AUC为最大值。瘢痕厚度预测清宫失败风险的AUC为0.833,95%CI为0.784~0.876,瘢痕厚度为2.4mm时,AUC为最大值。孕囊最大径线预测清宫失败风险的AUC为0.861,95%CI为0.814~0.900,当孕囊最大径线为3.3cm时,AUC为最大值。见表4及图1。
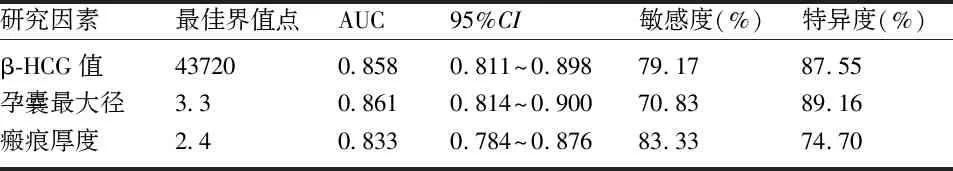
表4 各危险因素对清宫失败的预测价值
3 讨 论
CSP是一种特殊类型的异位妊娠,是剖宫产术后的并发症。多次人工流产、子宫单层缝合、胎盘粘连史是CSP发生的危险因素[5]。目前其发生机制尚未完全明确,最可能的机制是由于子宫瘢痕愈合不良,形成与宫腔相通的微小裂隙,再次妊娠时受精卵易通过此裂隙种植于瘢痕处,致使滋养细胞侵入子宫肌层。CSP一旦确诊,应及时诊治,目前CSP的治疗方式主要有MTX药物治疗、超声监测下清宫术、经阴道手术、宫腹腔镜手术等。超声监测下清宫术是临床上终止早孕最简单的方式,具有操作简单、恢复快、创伤小的优点。但子宫下段瘢痕部位的肌层薄弱、收缩性差,吸宫时断裂的小血管难以自然闭合,容易发生大出血,故不可盲目使用清宫术。
为避免治疗方式选择不当或过度治疗,治疗前对CSP 患者进行合适的分型是非常有必要的,以便根据分型进行个体化治疗。近年来有许多学者针对CSP提出了不同的分型:2000年Vial等[6]将CSP分为内生型和外生型;2012年向阳[7]提出临床学分型:I型瘢痕处宫腔内孕囊存活型、II型为瘢痕处肌层内孕囊型,Ⅲ 型为包块型或类滋养细胞疾病型;2016年我国专家共识[3]首次将瘢痕厚度这一超声定量指标作为标准将CSP分为Ⅰ、Ⅱ、Ⅲ型;建议Ⅱ型及Ⅲ型的CSP患者清宫或病灶切除术术前行UAE预处理。2019年山东大学齐鲁医院妇产科的康彦君等[4]根据临床经验,除瘢痕厚度外另纳入病灶大小等指标作为分型标准,总结出更为细化的实用临床分型,并按各型推荐的首选手术方式进行治疗,总体成功率达 95.4%,其指出对于Ⅱ型及Ⅲ型的CSP可不用常规行子宫动脉栓塞术,减少经济负担和并发症的发生;并推荐超声监测下清宫术±宫腔镜检查适用于Ⅰ型与Ⅱa型患者,Ⅱb型患者推荐行腹腔镜监视下清宫术或经阴道手术。本研究中Ⅰ型与Ⅱa型患者直接清宫成功率较高,总成功率为95.1%,Ⅱb型成功率明显降低,3例Ⅲa型均失败,也验证了该观点。
本研究中清宫组术前均未行预处理,总体治愈率达91.2%,无子宫破裂、切除子宫等严重事件发生,进一步证实了超声监测下清宫术在CSP治疗中的价值。实用临床分型建议Ⅰ型及Ⅱ型行清宫术的患者同时行宫腔镜检查判断病灶是否清除干净,若有病灶残留可行宫腔镜残留病灶电切术。本研究中清宫组失败病例中有4例患者因宫腔内持续不均质包块行宫腔镜手术清除残余病灶。宫腔镜能为术者提供直视下手术的机会,既可以直接利用钝性分离与电外科切除相结合的方式清除妊娠组织,又可用于检查清宫后是否存在妊娠组织残留,值得临床进一步推广应用。刘宝等[8]一项关于不同分型方法与手术方式的相关性分析研究发现,山东大学齐鲁医院妇产科提出的实用临床分型对选择手术方式的指导性相较于其他分型更强,更具有临床意义。UAE能阻断血流、降低滋养细胞活性、减少出血, UAE预处理后行清宫术可显著降低大出血风险,提高成功率,但其费用较高且可能出现下肢麻木、子宫内膜损害、卵巢功能损伤等并发症[9],故不推荐作为常规使用。本研究按2016年中华医学会分型的176例Ⅱ型患者中,UAE预处理后清宫成功率高于直接行清宫的成功率,但两者差异无统计学意义,且行UAE预处理的患者住院时间长,治疗费用高,有部分患者出现了术后并发症。因此如何预测CSP患者直接手术存在的大出血风险,从而减少预防性术前UAE的比例,仍是临床研究的重点。
本研究结果显示,血β-HCG值、孕囊大小、瘢痕处肌层厚度、血流信号、临床分型均与清宫术的成败密切相关,血β-HCG值、孕囊最大径、瘢痕处肌层厚度为清宫失败的独立危险因素。Jurkovic等[10]研究表明,孕囊大小是清宫术中大出血(>1000mL)的显著危险因素。李红叶等[11]在对CSP患者吸宫术治愈组与补充手术组的比较中发现,孕囊直径>3cm时,吸宫术后需补充治疗。孕囊越大,所含的绒毛越多,孕囊周围的滋养层血流量也相应增加,清宫时发生大出血、组织残留的风险也高。本研究发现,孕囊最大径线是清宫失败的危险因素,当孕囊最大径线<3.3cm时行清宫术较为安全。梁志怡等[12]研究表明,血β-HCG越高表示滋养细胞生长旺盛,侵袭性强;当血β-HCG值>97006U/L时,不建议直接行清宫术治疗。本研究中ROC曲线分析显示,血β-HCG值为 43720U/L是预测清宫失败的最佳阈值点,此时需谨慎选择将清宫术作为首选治疗方式。
随着孕周的增加,宫体不断增大,瘢痕处肌肉受到的作用力增大,瘢痕处肌层变薄,子宫抗拉伸能力减低,清宫时发生子宫破裂等风险变高[13]。Sun等[14]通过一项纳入 228例 CSP 患者的前瞻性研究指出,瘢痕厚度是影响CSP治疗成败的主要因素。本研究logistic回归分析得出,瘢痕厚度是清宫失败最显著的危险因素;ROC曲线分析结果显示,当患者子宫下段瘢痕厚度为2.4mm时,对清宫失败的预测值最佳。本研究中未发现血流信号与清宫术的成败有相关性,可能与实际的临床超声工作中对于血流分级的主观性较大、样本量较小有关,如何通过血流阻力指数或其他指标使血流分级统一标准、客观、具体也值得进一步探讨[15]。
综上所述,对于CSP要做到早诊断、早干预,治疗前进行合理的分型可有效帮助治疗方式的选择,随着临床医生对于CSP认识的加深和诊治经验的积累,对于CSP的分型和指南也需不断地完善和细化,实用临床分型在临床价值上要优于此前的中华医学会分型。Ⅱ型CSP患者术前可不常规行UAE预处理,直接清宫成功率较高,但若局部血流丰富、预测术中出血风险较大,也可考虑术前预防性行UAE。超声监测下清宫术操作简单、创伤小、恢复快,但需在术前对CSP患者的病情进行严格评估,切忌无选择性的盲目清宫。瘢痕处肌层较薄、孕囊较大及血HCG较高的CSP患者,在充分告知风险和患者要求的前提下可在手术室或腹腔镜监护下谨慎行清宫术,必要时及时经阴道或经腹腔镜行病灶清除术;但对于瘢痕厚度≤1mm的Ⅲ型患者,不建议行清宫治疗。
