IVF-ET中新鲜和冷冻胚胎移植对胎盘印迹基因PEG10和L3MBTL1表达的影响
2022-04-24王云霞熊亦雯胡继君管一春孙丽君
杨 璐,刘 洋,王云霞,李 哲,熊亦雯,胡继君,管一春,孙丽君
(郑州大学第三附属医院生殖医学科,郑州 450000)
过去十年,辅助生殖技术(assisted reproductive technology,ART)中冷冻胚胎移植(frozen embryo transfer,FET)的使用不断上升。有报告显示,2006至2012年,FET周期数量增加了82.5%,超过了新鲜胚胎移植(fresh embryo transfer,ET)周期的增长速度[1]。大量研究表明,与传统的ET相比,FET可能会产生更好的新生儿结局,婴儿低出生体重(low birth weight,LBW)发生率和早产(preterm birth,PTB)的风险更低[2-3]。有研究认为,这是由于FET周期具有更自然的子宫环境,有助于早期胎盘的正常植入,而ET周期中的卵巢刺激引起的高雌激素环境可能改变子宫内膜血管生成和随后的胎盘植入[4-5]。胎盘介于胎儿与母体之间,是维持胎儿宫内生长发育的重要器官。在胎盘的发育过程中,子宫内膜的蜕膜化、滋养层细胞黏附与侵袭、胎盘印迹基因的表达和胎盘血管的形成都受到表观遗传修饰的调控[6]。有关动物研究表明,胎盘组织比胚胎组织更易受到印迹基因表观遗传的干扰,这可能导致胎盘发育和功能的异常以及胎儿发育的异常[7]。PEGl0是哺乳动物进化中起源较早的印迹基因之一,是反转录转座子来源的父源性表达印迹基因[8]。PEGl0位于7q21染色体,在胎盘、脑、肾、肝、卵巢、睾丸等组织中均有表达,与胎儿生长发育及胎盘形成植入密切相关[9]。L3MBTLl是位于20q13.12上的父系表达基因,在胎盘、造血干细胞及脑组织中均有表达,可调节正常和恶性细胞的自我更新[10]。许多实验表明,L3MBTLl正常表达对细胞的有丝分裂和减数分裂有重要作用[11]。目前关于新鲜胚胎移植与冷冻胚胎移植对胎盘中印迹基因表达及新生儿出生体重的影响尚无定论。为了探讨其确切机制,本研究收集了IVF-ET患者新鲜胚胎移植与冷冻胚胎移植分娩的胎盘,检测印迹基因PEG10和L3MBTLI在两种胎盘中的表达,为改善IVF/ICSI不良妊娠结局奠定基础。
1 材料与方法
1.1 研究对象 收集2019年6月至2021年3月在郑州大学第三附属医院行IVF/ICSI患者分娩的胎盘。纳入标准:产妇年龄21~38岁;无妊娠期合并症及并发症;均为单胎、足月分娩,胎儿无畸形。根据患者移植周期分为新鲜胚胎移植组(ET组,n=16)与冷冻胚胎移植组(FET组,n=16)。采用实时荧光定量聚合酶链反应(qRT-PCR)、蛋白质印迹法(Western blot)和免疫组化法(immunohistochemistry,IHC)检测胎盘中印记基因PEG10和L3MBTLI表达。本研究经郑州大学第三附属医院道德伦理委员会批准,孕妇知情同意。
1.2 研究方法
1.2.1 胎盘组织标本处理 所有标本均在胎盘娩出15min内采集,取胎盘中央部位组织,避开出血、坏死及钙化区域,洗净血迹后置于适量RNA保存液,-80℃冰箱储存。其余样品用4%多聚甲醛溶液(PFA)固定。
1.2.2 qRT-PCR 根据生产商使用说明,使用Trizol(Takara,China)试剂提取胎盘组织总RNA,逆转录合成cDNA。使用SYBR Green (Takara,China)在Step One plus thermo cycler(Applied Biosystems)进行real-time PCR,检测PEG10、L3MBTL1表达水平。使用GAPDH作为内参基因对结果进行归一化处理,采用2-△△Ct法对目的基因相对表达量进行分析。引物序列:PEG10-F 5'-ACCTCTTGGACTTCTGAAT-3';PEG10-R 5'-TCTTGGAACTGTCTGTATCT-3';L3MBTL1-F 5'-GTTGACTAGCATTGTGTTCTG-3';L3MBTL1-R 5'-ATCACCTCCTTGGACCTT-3';GAPDH-qF 5'-AGAAGGCTGGGGCTCATTTG-3';GAPDH-qR 5'-AGGGGCCATCCACAGTCTTC-3'。
1.2.3 Western blot 蛋白裂解液(Thermo Fisher,Carlsbad,CA,USA)处理胎盘组织,提取总蛋白。采用BCA Protein Assay Kit (Solarbio,Beijing,China)检测各蛋白浓度,制备蛋白样品。SDS-PAGE凝胶电泳反应结束后转至PVDF膜,5%脱脂奶粉室温封闭2h,依次加一抗、二抗孵育,避光条件下进行显色反应,洗涤晾干后进行扫描分析。
1.2.4 IHC 对固定在PFA中的胎盘样品进行常规脱水、包埋石蜡。石蜡切片脱蜡入水,3% H2O2溶液室温孵育10min,消除内源性过氧化物酶的活性。滴加一抗和二抗工作液,用二氨基苯并(DAB)和底物缓冲液处理3~5min。将切片用苏木精复染(Sigma,美国),荧光显微镜下观察拍照。
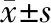
2 结 果
2.1 两组患者一般资料比较 FET组与ET组孕妇年龄、孕周、孕前体质量指数(body mass index,BMI)、孕期增重、胎盘重量及新生儿体重比较,差异均无统计学意义(P>0.05),FET组新生儿出生体重较ET组有增加趋势,但差异无统计学意义。见表1。
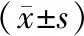
表1 ET组与FET组一般资料的比较
2.2 两组患者胎盘组织中PEG10和L3MBTL1表达 ET组的PEG10 mRNA和蛋白表达显著低于FET组,差异有统计学意义(P<0.05),而两组的L3MBTL1 mRNA和蛋白表达水平无显著差异。见图1、表2。
2.3 免疫组化法结果 IHC检测结果显示,PEG10、L3MBTL1均在胎盘间质细胞胞质中呈棕褐色表达,细胞核不着色。FET组胎盘组织中PEG10蛋白的信号强度高于ET组,两组的L3MBTL1蛋白信号强度无明显差异(图2),与Western blot检测结果一致。
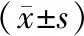
表2 两组胎盘组织中PEG10和L3MBTL1 mRNA
3 讨 论
ART包括人工授精和体外受精-胚胎移植技术,近年来胚胎冷冻已成为ART中的常规程序,在ART中扮演着重要角色[12]。随着胚胎冷冻保存技术的发展,冷冻胚胎的质量和植入潜力与新鲜胚胎相似[13]。几项大型队列研究表明,与新鲜的IVF-ET相比,FET周期出生的单胎中,新生儿出生体重增加,PTB和LBW发生率较低[14-15]。Pelkonen等[16]研究发现,ET周期出生的新生儿低出生体重(LBW)、小于胎龄儿(small for gestational age,SGA)的风险均低于ET周期。研究发现,控制性卵巢刺激产生的高雌激素和孕酮浓度可能影响着床相关基因,损害早期胚胎植入和后期胎儿的生长[17]。此外,高雌激素水平还会干扰子宫内膜血管生成,这可能影响胎盘的功能。FET移植时患者体内雌孕激素水平更接近生理状态,对子宫内膜容受性和早期着床有积极的影响,更有利于胎盘的植入和发育。
胎盘的功能可能受多种因素的调节,大量研究证实,表观遗传机制在胎盘的发育过程中起着重要作用,对早期胚胎分化和发育、胎儿生长、胎盘分化和神经系统发育至关重要,基因印记紊乱可能导致子代发育异常、妊娠并发症风险增加[18]。本研究中,PEG10和L3MBTL1都是父源性表达的印记基因。Moore等[19]在2015年的研究中表明父系表达的基因促进胎儿生长,而母系表达的基因抑制胎儿生长。PEG10可改善妊娠期新陈代谢,促进孕激素的合成,有利于胎盘植入和胚胎发育。本研究发现,胎盘中PEGl0 mRNA及蛋白表达在FET组明显高于ET组;FET组新生儿出生体重也较ET组有增加趋势。梁小妍等关于胎儿生长受限(fetal growth restriction,FGR)和印记基因PEG10的研究中发现,PEG10过度甲基化后,转录活性减弱,PEG10蛋白表达降低,抑制了滋养细胞的增殖分化和浸润,从而导致FGR的发生[20]。研究发现,自然流产患者子宫内膜中PEG10表达显著下调[21]。Smallwood等[22]在动物实验中也发现了敲除PEG10基因的小鼠,会引起胚胎发育异常,甚至导致胚胎早期死亡、流产。Lim等[23]研究发现,越低出生体重儿脐血中PEG10表达越低。这些研究都表明PEG10在胎儿和胎盘发育过程中起到重要作用[24]。本研究结果与这些早期研究成果一致。
L3MBTL1在生殖细胞和生殖干细胞早期阶段均有表达,并参与人类胚胎干细胞增殖,影响胚胎干细胞向滋养外胚层分化,L3MBTL1基因缺陷可抑制生殖干细胞染色质转录[25]。L3MBTL1下调可能增加ART患者流产和胚胎停育的风险,增加子代患印记基因疾病的风险。此前研究报道,ART子代与正常自然受孕子代L3MBTL1基因的表达存在差异[26]。但本研究FET组与ET组胎盘中L3MBTL1表达无显著差异,提示不同移植周期对L3MBTL1的表达无明显影响,也可能是由于本实验样本量限制造成。尽管人们对人类印迹基因的兴趣日益增长,并且认识到表观遗传学在人类发育中的重要性,但是关于印迹基因在人类胎盘发育和胚胎发生中的作用的认识仍有限,对于不同移植周期是否影响印迹基因的表达还需进行深入的研究。
