猪子宫腔液外泌体来源的TIMP2蛋白对胚胎附植的影响
2022-04-24匡婧靖贺艳娟吴珍芳蔡更元洪林君
匡婧靖,贺艳娟,胡 群,顾 婷,吴珍芳,蔡更元,洪林君
(华南农业大学动物科学学院 国家生猪种业工程技术研究中心,广州 510642)
猪妊娠期胚胎死亡率高达30%~50%,其中大部分的妊娠失败发生在胚胎附植期[1-2],因此猪妊娠早期的胚胎附植是影响母猪产仔数提高的关键环节。在胚胎附植期,当母胎之间的信息分子交流不足时,则可能导致妊娠失败[3]。猪胚胎附植期很长,直到妊娠第15天胚胎才开始与母体子宫内膜相粘附,在此之前胚胎游离于子宫腔液中,因此,此时期胚胎与母体子宫间的物质交流和信息传递主要依赖于子宫腔液中的物质[4-5],其中包括外泌体[6-8]。
外泌体(exosomes)是细胞向胞外释放的一种直径为30~150 nm,电镜下观察到形状为杯口状的微型囊泡[9]。它可以选择性装载蛋白质、脂质、核酸等活性物质,并将携带的物质输送到靶细胞内,从而调控靶细胞的生物学功能[10-14]。研究发现,哺乳动物子宫腔液中富含的外泌体对胚胎附植发挥重要作用,外泌体中所含的蛋白质等活性分子可作为母胎“对话”的信号分子调控胚胎附植[8,15-17]。Kusama等[18]发现,牛的子宫腔液外泌体中存在妊娠识别因子IFNT等蛋白调控子宫内膜细胞的凋亡和黏附等过程;Greening等[14]发现,人子宫内膜在妊娠期受到激素影响会释放外泌体,外泌体会被滋养层细胞内化并增强其黏附能力。
基质金属蛋白酶组织抑制物(tissue inhibitor of metalloproteinases,TIMPs)是基质金属蛋白酶(matrix metalloproteinases,MMPs)的天然抑制物,蛋白TIMP2(tissue inhibitor of metalloproteinases-2,TIMP2)属于TIMPs中的一种,主要通过影响金属蛋白酶MMPs的活性来调控细胞外基质组织重构、器官发生发育、血管形成、细胞迁移、细胞增殖以及细胞凋亡等生理过程[19-21]。猪胚胎附植过程中,胚胎形态发生剧烈变化,从妊娠第9天的球状胚胎(直径2~6 mm)迅速变成妊娠第12天的线状胚胎(长度大于100 mm),这一过程的发生主要依赖胚胎细胞的增殖、迁移以及胞外基质组织重构[22]。最近研究发现,在子宫内膜来源的外泌体中存在多种基质金属蛋白酶,且可能会通过外泌体转移至胚胎细胞促进胚胎附植[14,23]。基质金属蛋白酶的活性受基质金属蛋白酶组织抑制物的调控,前期研究发现,基质金属蛋白酶组织抑制物TIMP2在猪胚胎附植期子宫腔液外泌体中表达,因此推测,子宫腔液外泌体来源的TIMP2蛋白对猪胚胎附植发挥调控作用。
本试验将研究TIMP2蛋白在猪胚胎附植期子宫腔液外泌体中的表达规律,并通过体外细胞试验研究外泌体来源TIMP2蛋白对胚胎滋养层细胞增殖和迁移能力的影响,以期阐明猪子宫腔液外泌体来源的TIMP2蛋白对胚胎附植的影响。
1 材料与方法
1.1 材料与试剂
猪滋养层细胞系(porcine trophoblast PTr2)。胎牛血清,DMEM/F12培养基,胰蛋白酶(美国,Gibco);Lipofectamine 3000 Transfection Reagent,Lipofectamine RNAimax Transfection Reagent,PowerUp SYBR Green Master Mix(美国,Thermo Fisher);TRIzol,BCA蛋白定量试剂盒(美国,Invitrogen);重组人胰岛素(Insulin human recombinant),Cell Counting Kit(CCK-8)(中国,翊圣);BeyoClick EdU-555细胞增殖检测试剂盒(中国,碧云天);PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)(日本,TaKaRa);PVDF膜(美国,Millipore);β-actin抗体(英国,Abcam),TIMP2抗体(美国,bio-techne);TIMP2超表达重组质粒(pcDNA-TIMP2)及对照质粒(pcDNA3.1),TIMP2小干扰(si-TIMP2)及干扰对照(si-NC)(中国,吉玛)。
1.2 猪子宫腔液和子宫组织的采集
挑选年龄和遗传背景相似的健康大白母猪。通过对母猪进行同期发情处理,观察到发情并在当天进行输精,记为第0天,输精后1 d记为妊娠第1天,以此类推。取妊娠第9天(n=3)和第12天(n=3)的猪子宫,用PBS冲洗子宫并收集子宫腔液。在子宫内侧纵向打开收集对应子宫的子宫内膜组织。将采集到的子宫腔液和子宫内膜组织保存在-80 ℃备用。
1.3 猪子宫腔液外泌体的分离与鉴定
在4 ℃条件下,猪子宫腔液依次进行2 000×g离心20 min,10 000×g离心30 min,然后取上清液,再用超速冷冻离心机(美国 BECKMAN,Optima XPN-100),在100 000×g条件下离心2 h后弃上清,用适量PBS重悬沉淀。采用透射电镜(TEM)分析外泌体形态结构,将重悬后的PBS滴加到碳膜网格上2 min,用滤纸从网格的一端吸除多余的PBS,将网格板烘干后铀染2 min,用滤纸吸除多余液体,室温静置过夜,再用透射电子显微镜系统分析拍照。使用纳米粒径分析仪对悬浮于PBS中的囊泡进行纳米颗粒粒径分析。使用Western blot检测外泌体的标志蛋白CD9和CD63,方法同“1.8”。
1.4 细胞培养
采用含10%胎牛血清,1%双抗和0.5%胰岛素的DMEM/F12基础培养基培养PTr2,细胞置于5% CO2,37 ℃的恒温培养箱中常规培养,当细胞生长铺满培养皿80%时,用0.25%胰蛋白酶消化并按照1∶3比例传代。
1.5 外泌体与PTr2细胞共培养
采用妊娠第12天的外泌体对PTr2细胞进行共培养,分为对照(PTr2+PBS)组和外泌体共培养(PTr2+P12-exo)组。首先检测得到外泌体样品总蛋白浓度,再将对数生长期的PTr2细胞接种于6孔板中,过夜培养至细胞汇合度达到60%~70%时,将已知浓度的外泌体加入外泌体共培养(PTr2+P12-exo)组,达到培养基中外泌体浓度为50 μg·mL-1,再将等量的PBS加入对照(PTr2+PBS)组。细胞放入细胞培养箱中继续培养48 h,收集细胞并提取蛋白及RNA用于后续试验。
1.6 PTr2细胞转染
TIMP2蛋白对PTr2细胞增殖和迁移能力影响试验分为空载体对照(pcDNA)组(转染pcDNA3.1质粒)和TIMP2超表达(pcDNA-TIMP2)组(转染pcDNA-TIMP2质粒);干扰对照(si-NC)组(转染si-NC)和TIMP2干扰(si-TIMP2)组(转染si-TIMP2)。将对数生长期的PTr2细胞接种于6孔板中,过夜培养至细胞汇合度达到60%~70%时,用Lipofectamine 3000 Transfection Reagent根据试验分组将pcDNA 3.1空载体质粒和pcDNA-TIMP2质粒转染到细胞中;再用Lipofectamine RNAimax Transfection Reagent根据试验分组将si-NC和si-TIMP2转染进细胞中,放入细胞培养箱中培养,进行后续试验。
1.7 实时定量PCR(quantitative real-time PCR, qRT-PCR)检测TIMP2 mRNA的表达
利用 TRIzol提取转染24 h后PTr2细胞中的RNA,紫外分光光度计测定RNA浓度后用反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)逆转录成cDNA,再配制成qPCR反应体系:上、下游引物(10 μmol·L-1)各0.2 μL,cDNA 300 ng,PowerUp SYBR Green Master Mix 5 μL,RNAase free ddH2O补至10 μL。所用引物序列见表1。在荧光定量PCR仪(美国,Life)上测定TIMP2 mRNA的相对表达水平,以β-actin作为内参,按照2-ΔΔCt公式计算结果。

表1 各基因qPCR引物序列
1.8 Western blot(WB)检测TIMP2蛋白水平
将转染48 h的PTr2细胞和与外泌体共培养的PTr2细胞加入RIPA裂解液裂解细胞,外泌体则用超声波裂解。将裂解液离心取上清液,采用BCA法测定蛋白浓度。之后用SDS-PAGE电泳仪(美国,Biorad)电泳分离蛋白,将蛋白转移到PVDF膜上,加入5%脱脂牛奶,常温下摇床封闭2.5 h,TBST洗涤后加入TIMP2抗体(CCL2119021 1∶1 000)和β-actin抗体(ab8226 1∶1 000)4 ℃孵育过夜,再用TBST洗涤,之后用相应的二抗孵育2 h。利用化学发光液对目的蛋白条带进行显色并采用Image J软件分析蛋白条带灰度值。
1.9 CCK-8法检测细胞活性
将PTr2细胞接种于96孔板中,参照“1.6”PTr2细胞转染方法进行空载体对照(pcDNA)组、TIMP2超表达(pcDNA-TIMP2)组、干扰对照(si-NC)组和TIMP2干扰(si-TIMP2)组转染,分别在转染后24、48 h加入CCK-8试剂,37 ℃ 5% CO2条件下孵育2 h后在酶标仪上测定450 nm处的吸光值。试验重复3次。
1.10 EdU试验检测PTr2细胞的增殖
根据制造商说明书,使用BeyoClick EdU-555细胞增殖检测试剂盒(中国,碧云天)分析细胞增殖情况。将细胞悬液接种于24孔板,参照“1.6”PTr2细胞转染方法进行空载体对照(pcDNA)组、TIMP2超表达(pcDNA-TIMP2)组、干扰对照(si-NC)组和TIMP2干扰(si-TIMP2)组转染,转染48 h后,保留原有的500 μL培养基,再加入EdU试剂进行孵育(具体步骤参考制造商说明书),最后进行荧光拍照,参考对照组比较EdU阳性细胞比例。
1.11 划痕试验检测PTr2细胞的迁移能力
参照“1.6”PTr2细胞转染,进行空载体对照组(pcDNA)、TIMP2超表达组(pcDNA-TIMP2)、干扰对照组(si-NC)和TIMP2干扰组(si-TIMP2)转染。在细胞转染48 h后,用牙签在细胞板上垂直划出线状划痕,并将细胞培养基换为无血清的DMEM/F12基础培养基。在0、12 和24 h观察细胞迁移和划痕愈合情况并拍摄照片。选取3个随机视野利用Image J软件计算愈合面积获得细胞迁移率。
1.12 子宫内膜免疫组织化学染色
子宫内膜免疫组织化学染色步骤:1)石蜡切片常规脱蜡至水;2)在3%过氧化氢溶液中浸泡30 min;3)PBS中洗涤3次,每次5 min;4)在修复液中微波修复3次,室温下自然冷却;5)同步骤3;6)滴加5% BSA,37 ℃孵育20 min;6)滴加一抗(稀释比例为1∶100),湿盒中4 ℃孵育过夜,同时添加一组阴性对照(PBS替代一抗);7)同步骤3;8)滴加二抗,37 ℃孵育25 min;9)同步骤3;10)滴加SABC,37 ℃孵育25 min;11)同步骤3;12)滴加DAB显色试剂;13)苏木素染液复染5~10 s,自来水冲洗,烘干,封片,显微镜拍照系统(日本 尼康)拍照。
1.13 统计学方法
qRT-PCR、WB等结果以“平均值±标准差(Mean ± SD)”表示,用GraphPad Prism 8.0软件分析数据并作图,两组间比较采用独立样本t检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 子宫腔液外泌体的分离与鉴定
将超速离心所得妊娠第9天(P9)和第12天(P12)的猪子宫腔液外泌体进行透射电镜观察,呈典型杯状,囊泡外周有膜性结构(图1A)。根据纳米粒径分析结果,提取的外泌体粒径主要分布在30~150 nm之间(图1B)。WB结果显示,妊娠第9和第12天外泌体均存在特异性标记蛋白CD9和CD63(图1C)。

A.妊娠第9(P9)和第12天(P12)的猪子宫腔液外泌体透射电镜图,标尺=100 nm;B.妊娠第9(P9)和第12天(P12)的猪子宫腔液外泌体粒径大小分布图;C.WB检测妊娠第9(P9)和第12天(P12)的猪子宫腔液外泌体标志蛋白CD9和CD63
2.2 子宫腔液外泌体来源的TIMP2蛋白能靶向进入胚胎滋养层细胞
通过WB试验发现,妊娠第12天的猪子宫腔液外泌体中TIMP2蛋白含量显著高于妊娠第9天(P<0.05)(图2A,B)。为了研究子宫腔液外泌体来源的TIMP2蛋白是否能够进入胚胎滋养层细胞,用妊娠第12天子宫腔液外泌体孵育PTr2细胞,通过WB试验发现,外泌体孵育24 h后,PTr2细胞中TIMP2蛋白极显著增加(P<0.01)(图2C,D)。为了进一步明确经外泌体孵育后PTr2细胞中增加的TIMP2蛋白是由外泌体转移进细胞的还是细胞自身转录翻译的,通过qPCR检测了经外泌体孵育后PTr2细胞中的TIMP2 mRNA表达水平,结果发现TIMP2 mRNA相对表达量在外泌体孵育组(PTr2+P12-exo)和对照组(PTr2+PBS)中无显著差异(P>0.05)(图2E)。

A、B.WB检测妊娠第12天(P12)的猪子宫腔液外泌体中TIMP2蛋白的表达量显著高于妊娠第9天(P9);C、D.WB检测妊娠第12天外泌体孵育PTr2细胞(PTr2+P12-exo)相比对照组(PTr2+PBS)中TIMP2蛋白的相对表达水平极显著升高;E.qRT-PCR技术检测妊娠第12天外泌体处理PTr2细胞(PTr2+P12-exo)和对照组(PTr2+PBS)中TIMP2 mRNA的相对表达量。ns.P>0.05,*.P<0.05,**.P<0.01,***.P<0.001,下同
2.3 TIMP2蛋白在妊娠早期的猪子宫内膜中的表达定位
为了探究子宫腔液外泌体中TIMP2蛋白的来源,在大白猪妊娠第9(P9)和第12天(P12)的子宫内膜中开展了免疫组化试验,结果显示TIMP2蛋白在大白猪妊娠第9和第12天的子宫内膜中均存在,包括子宫内膜上皮(endometrial luminal epithelium LE)、腺体(glandular epithelium GE)和基质(endometrial stroma)等(图3A)。同时该蛋白在妊娠第12天的胚胎(trophoblast Tr)中也大量存在(图3A)。进一步对TIMP2蛋白的表达量进行光密度检测,结果发现相比妊娠第9天,妊娠第12天的子宫内膜中TIMP2蛋白的含量极显著升高(P<0.01)(图3B)。

A.免疫组化显示TIMP2蛋白在妊娠第9(P9)和第12天(P12)的子宫内膜中均存在,如子宫内膜上皮(LE)中,腺体(GE)等,同时该蛋白在妊娠第12天(P12)的胚胎(Tr)中也大量存在;B.TIMP2蛋白在两个时期子宫内膜上的光密度检测
2.4 TIMP2超表达对PTr2细胞增殖和迁移能力的影响
采用qRT-PCR法对TIMP2的超表达效率进行分析,与空载体对照(pcDNA)组相比,TIMP2超表达(pcDNA-TIMP2)组的PTr2细胞中TIMP2的mRNA相对表达水平极显著升高(P<0.001)(图4A)。WB结果显示,与空载体对照组相比,TIMP2超表达组的PTr2细胞中TIMP2蛋白相对表达水平显著升高(P<0.05)(图4B,C)。CCK-8细胞活性检测发现,TIMP2超表达组细胞增殖能力极显著降低(P<0.01,图4D),EdU试验结果也显示,TIMP2超表达组细胞增殖能力极显著降低(P<0.01,图4E,F),与CCK-8试验结果相一致。通过划痕试验发现,与空载体对照组相比,TIMP2超表达组的PTr2细胞的迁移能力显著降低(P<0.05,图4G,H)。
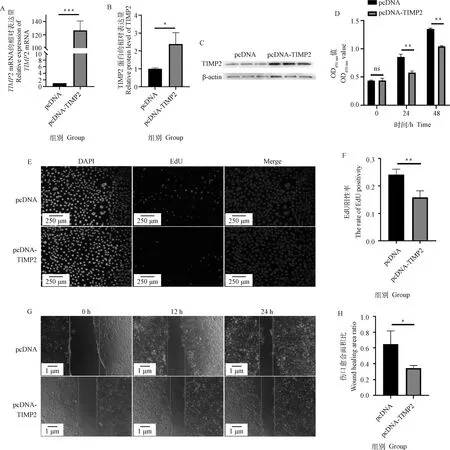
A.超表达后TIMP2 mRNA表达水平;B、C.超表达后TIMP2蛋白表达水平;D、E、F.超表达后PTr2细胞的增殖能力极显著下降;G、H.超表达后PTr2细胞的迁移能力显著下降
2.5 干扰TIMP2对PTr2细胞增殖和迁移能力的影响
采用qRT-PCR法对TIMP2的干扰效率进行分析,与干扰对照(si-NC)组相比,TIMP2干扰(si-TIMP2)组的PTr2细胞中TIMP2的mRNA相对表达水平极显著下降(P<0.001)(图5A)。WB结果显示,与对照组相比,干扰组PTr2细胞中TIMP2蛋白相对表达水平极显著降低(P<0.001)(图5B,C)。CCK-8细胞活性检测发现,干扰组细胞增殖能力极显著增强(P<0.01,图5D),EdU试验结果也显示,干扰组细胞增殖能力极显著增强(P<0.01,图5E,F),与CCK-8试验结果相一致。通过划痕试验发现,与对照组相比,干扰组PTr2细胞的迁移能力显著增强(P<0.05,图5G,H)。

A.干扰后TIMP2 mRNA表达水平;B、C.干扰后TIMP2蛋白表达水平;D、E、F.干扰后PTr2细胞的增殖能力极显著提高;G、H.干扰后PTr2细胞的迁移能力显著提高
3 讨 论
近年来,越来越多的研究表明子宫腔液外泌体能携带母体子宫来源的RNA、蛋白等相关活性分子靶向运输到胚胎细胞,对胚胎发育及胚胎附植发挥重要调控作用[6,10,14,18,23-24]。但在猪中,目前还未发现有子宫腔液外泌体蛋白功能相关的研究。本试验通过分离鉴定猪胚胎附植期子宫腔液外泌体,研究了外泌体蛋白TIMP2的来源及其对胚胎滋养层细胞的功能。
通过超速离心法成功从子宫腔液分离到外泌体,经电镜试验、粒径分析以及标志蛋白检测鉴定了外泌体的质量和纯度都符合要求,并与前人的研究结果相吻合[25-26]。通过WB试验,发现妊娠第12天子宫腔液外泌体中TIMP2蛋白的含量显著高于妊娠第9天。妊娠第12天是猪胚胎附植的“窗口期”,此时胚胎开始分泌妊娠识别信号分子——雌激素,在雌激素作用下子宫内膜进入“容受态”,其血管增多,分泌能力增强,从而为胚胎的附植做好准备[3,27]。妊娠第12天子宫腔液外泌体中TIMP2蛋白含量显著高于妊娠第9天,可能与妊娠第12天子宫内膜的分泌能力增强有关。另外,免疫组化试验结果显示,TIMP2蛋白在妊娠第12天子宫内膜中的表达量显著高于妊娠第9天,说明子宫腔液外泌体来源的TIMP2蛋白可能是由子宫内膜所分泌。近期有研究也表明,小鼠胚胎附植期子宫腔液外泌体来源于子宫内膜,且主要由子宫内膜腔上皮和腺上皮所分泌[28]。
为了进一步研究子宫腔液外泌体来源的TIMP2蛋白能够通过外泌体靶向运输到胚胎滋养层细胞内发挥功能,用妊娠第12天子宫腔液外泌体孵育胚胎滋养层细胞后提取滋养层细胞的蛋白和RNA,分别检测TIMP2蛋白及TIMP2 mRNA在外泌体孵育前后的表达量变化,结果发现,TIMP2蛋白在外泌体孵育滋养层细胞后显著升高,而TIMP2 mRNA表达量却未发生显著变化,因此,推测滋养层细胞中显著升高的TIMP2蛋白可能是由外泌体携带进入细胞的,而不是由细胞本身转录翻译而来。TIMP2蛋白是金属蛋白酶抑制剂,已有研究表明,TIMP2蛋白对哺乳动物胚胎附植及妊娠维持发挥重要调控作用,它能通过抑制基质金属蛋白酶MMPs的活性来阻止层联蛋白和胶原蛋白的降解,从而改变子宫内膜细胞以及胚胎滋养层细胞的增殖、迁移和侵袭的能力[29-32]。此外,TIMP2蛋白还能调控子宫内膜的容受性[14],并与子宫内膜癌的发生有关[33]。为了研究外泌体来源的TIMP2蛋白进入胚胎滋养层细胞后所发挥的功能,通过在滋养层细胞中过表达和抑制表达TIMP2基因来分析其对滋养层细胞增殖和迁移能力的影响。CCK-8检测、EdU试验以及细胞划痕试验均表明,TIMP2蛋白能抑制胚胎滋养层细胞的增殖和迁移。这与前人研究发现的TIMP2能通过抑制金属蛋白酶MMPs的活性来抑制细胞的增殖和迁移相一致[34],以上结果表明,在猪胚胎滋养层细胞中TIMP2蛋白可能也是通过抑制金属蛋白酶的活性来抑制胚胎滋养层细胞增殖和迁移的。妊娠第12天猪胚胎已从球状变成了丝状,胚胎滋养层细胞即将与子宫内膜腔上皮细胞相粘附并完成胚胎附植[35],子宫腔液外泌体来源的TIMP2蛋白进入胚胎细胞并抑制胚胎滋养层细胞的增殖和迁移,可能起到避免胚胎形态进一步发生巨变的作用,使胚胎处于一种相对稳定的状态,为接下来与母体子宫内膜相粘附并完成附植做好准备。后续将针对TIMP2蛋白调控胚胎滋养层细胞增殖和迁移的分子机制进行深入研究,并可以小鼠为模型,利用子宫角注射试验,验证TIMP2蛋白对小鼠胚胎附植率的影响。
4 结 论
本研究结果表明,子宫腔液外泌体来源的TIMP2蛋白可能由母体子宫所分泌,并能通过外泌体靶向进入胚胎滋养层细胞调控细胞的增殖和迁移,进而对猪胚胎附植发挥调控作用。
