小分子级联自组装/解组装策略在精准癌症诊疗中的应用
2022-04-22贾德英李爽爽
贾德英,李爽爽,郑 珍
(天津医科大学 药学院,天津 300070)
在癌症的诊断与治疗中,“智能”识别及靶向癌细胞是精确诊断与高效治疗的关键。目前常见的两种靶向递送成像探针(或化疗药物)的策略包括:①共价探针前体(或前药),即将示踪分子(或抗肿瘤药物)与响应基团——如双硫键、糖苷键和特异性氨基酸序列等共价相连形成探针前体(或前药),递送至肿瘤区域后,靶标生物分子与响应基团作用点亮探针(或释放药物)[1];②纳米载药体系,即将示踪分子(或抗肿瘤药物)负载于纳米组装体中,在肿瘤环境中响应性点亮探针(或释放药物)[2]。两种方法均表现出一定的肿瘤靶向成像(或治疗)效果,但仍然存在较大的局限性。小分子共价前体探针(或药物)存在的局限包括机体代谢速度快以及对其他器官毒副作用大。而纳米载药体系中的纳米颗粒尽管对肿瘤组织表现出增强的渗透性和滞留效应(Enhanced permeability and retention effect,EPR)[3],但肿瘤穿透能力仍然有限。此外,各类纳米载药体系还存在分子结构与分子量不明确、批次重现性差、易被网状内皮系统捕获等问题[4]。
为克服上述局限,小分子智能“原位自组装”策略应运而生。该策略借助于肿瘤组织特异性表达的生物标志物,在肿瘤部位原位诱导示踪分子(或药物)衍生物自组装,从而原位形成纳米探针(或纳米药物),可获得更好的显像及肿瘤抑制效果[5]。该策略兼具小分子体系和纳米体系递送的优点,利用小分子作为前体提高了示踪分子(或药物分子)在肿瘤组织的生物穿透性,而自组装形成的纳米结构则提供了更好的生物利用度、更高的代谢稳定性和更长的滞留时间。在生物成像应用中,自组装过程中小分子到超分子的结构转变,能够实现特定成像信号的放大和对比度的增强,有效提高分析检测灵敏度;此外,纳米探针在瘤内的滞留还可以增加成像时间窗口[6-7]。在药物递送应用中,肿瘤原位自组装形成的纳米药物具有组装诱导滞留效应(Assembly induced retention,AIR)[8],可以显著增强药物在瘤内的滞留时间,同时纳米药物进一步缓慢释放出游离的小分子抗癌药物,实现靶向富集和药物缓释的双重功效[9-11]。迄今为止,该策略已被成功运用于精确制造具有增强成像信号和提高肿瘤治疗效果的纳米材料。
基于个性化诊疗和高灵敏诊断的临床需求,设计在病灶部位响应性应答的“智能型”纳米材料,正逐步成为纳米医用材料的发展趋势。然而,生物体内的自组装行为是一个非常复杂的过程,如何通过设计分子单元并利用生物环境精准调控其在体内的组装进程,实现自组装纳米材料的活体功能十分具有挑战。近年来,为进一步提升对活体自组装体系的控制,研究者们开发了“级联自组装”策略。相比于单一的生物分子或化学反应调控的自组装,具有级联自组装能力的分子可以和多个响应分子作用,并实现纳米结构的转变,因此在癌症诊断和治疗中表现出更强的靶向性、更精确的时空控制度和增强的生物效应。此外,设计可控的级联自组装/解组装策略同样具有重要意义。小分子的组装和其后的纳米结构解组装可分别转换为成像信号的“Off”到“On”,实现两种靶标分子的检测及更高灵敏度的“Turn on”。目前,设计开发可“智能”区分正常细胞和癌细胞、以及癌细胞细胞器精准靶向的级联增强型自组装/解组装体系,实现更为精准的组装调控与诊疗分子递送,仍处在探索阶段。基于此现状,本文总结了现有的小分子增强型级联自组装、级联自组装/解组装体系及其在癌症诊疗中的应用,以期为实现更为精准高效的诊疗分子递送、药用功能提升提供新思路。
1 增强型级联自组装
增强型级联自组装的基本原理为:通过设计肿瘤微环境刺激响应的关键化学基团,前体分子首先在肿瘤部位发生一级自组装形成初级纳米结构,加速在肿瘤部位的富集与特定癌细胞的摄取,实现癌细胞与正常细胞的有效区分;该初级纳米结构在进入癌细胞后可进一步通过与胞内特定生物分子相互作用,诱导二级自组装聚集形成增强型纳米结构,从而有效提升肿瘤靶向与滞留效果。该级联自组装的设计在癌症的诊疗中具有诸多优势,多分子响应的设计可以增强检测的准确性,同时级联自组装产生的信号激活和扩增也提供了一种高灵敏度的成像策略。
2016年,梁高林课题组[12]通过将生物大分子和点击反应分别作为触发物,首次实现了可区分细胞内外环境的一、二级级联自组装,并通过高分辨冷冻电镜成像进行了分析验证。如图1A所示,在特定肿瘤细胞外部环境中,前体分子Cys(SEt)-Glu-Tyr(H2PO3)-Phe-Phe-Gly-CBT(1)的磷酸根被肿瘤细胞外大量分泌的碱性磷酸酯酶(Alkaline phosphatase,ALP)切除,引发第一级自组装形成由线性分子(2)堆积的平面纳米纤维(Nanofiber 2)。而当这些小分子进入细胞内部后,小分子上的双硫键被谷胱甘肽(Glutathione,GSH)还原,露出半胱氨酸上的氨基硫醇结构,裸露的氨基硫醇结构可与小分子结构中的氰基苯并噻唑发生高效的点击缩合反应,生成环状的二聚体(2-D)。由于二聚体中苯并噻唑提供的强π-π堆积作用,该二聚体分子之间会相互吸引,引发第二级自组装形成由环状单体堆积的管状纳米纤维(Nanofiber 2-D)。冷冻电镜技术能够在保持生物样品接近生理状态的前提下提供精细的结构信息,为观察生物样品中的自组装纳米结构提供技术支持。因此,作者通过高分辨冷冻电镜成像分析揭示了这两种不同纳米纤维在形貌及尺度上的微观差异。该分子“一石二鸟”的设计提供了一种智能超分子纳米结构活体调控的方法,有望在提高分子递送精准度、提升药用效能等方面有所突破。
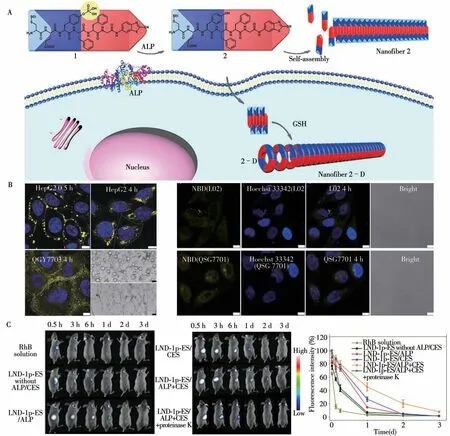
图1 小分子级联自组装实现癌细胞的特异性成像和靶向递送Fig.1 Cascade self-assembly of small molecules for specific imaging and targeted delivery
其后,南开大学的杨志谋课题组[13]开发了依赖肝癌细胞内外微环境不同而触发的级联自组装体系,在肝癌诊断与治疗中具有重要意义。相比于正常细胞,肝癌细胞不仅胞外高表达ALP,同时胞内有更高浓度的GSH。基于此,研究人员构建了可在这两种刺激下发生逐步组装的前体分子NBD-GFFYp-ss-ERGD(3),3在胞外ALP的催化下发生酶促反应,诱发一级自组装形成纳米粒子。由于3含有能与癌细胞膜表面高表达的整合素αvβ3结合的靶向序列RGD,形成的纳米粒子可通过胞吞作用进入细胞,并与胞内GSH发生还原反应诱发二级自组装,转化成纳米纤维。这种级联自组装现象在HepG2和QGY7703两种肝癌细胞中均能观察到,而在其他癌细胞或正常肝细胞中则无法观察到(图1B),因此可以实现肝癌细胞的特异性成像及靶向递送。此外,在细胞内形成的纳米纤维被证实可以进一步诱导肝癌细胞凋亡,或可为癌细胞的消除提供新思路。在此基础上,Yang等[14]又设计了一种靶向肺癌细胞的级联自组装体系,首次将级联组装的调控策略运用到了活体。在肺癌细胞外环境中,ALP将前体分子NBD-GFFYpG-N=N-ERGD转化为NBD-GFFYG-N=N-ERGD,诱发纳米颗粒或短纳米纤维的形成。这些纳米颗粒或短纤维可通过内吞作用被肺癌细胞有效吸收,同时分子中偶氮基团的存在有利于纳米结构的溶酶体逃逸和线粒体积累。线粒体聚集后,线粒体膜上的还原酶可将NBD-GFFYG-N=N-ERGD进一步转化为组装能力更强的分子NBD-GFFYG-aniline,在线粒体中发生二级自组装。二级组装形成的纳米纤维将导致线粒体膜破裂,释放细胞色素C,并诱导氧化应激,产生活性氧(Reactive oxygen species,ROS)。ROS最终可增加内质网应激并激活未折叠蛋白反应(Unfolded protein response,UPR)[15],从而导致肺癌细胞选择性死亡。
通过类似的策略,中国药科大学钟文英团队[16]设计了一种具有三酶响应性的自组装多肽分子LNDGFFYP-ES(LND-1p-ES),可用于成像分子及药物的无载体靶向递送。该分子的主要组成部分有:①药物氯尼达明(Lonidamine,LND),作为疏水头基发挥药效的同时增强多肽的自组装能力;②Gly-Phe-Phe-Tyr,作为组装序列提供自组装的驱动力;③磷酸化的酪氨酸,作为ALP响应基团;④琥珀酸单酯,作为酯酶(Carboxylesterase,CES)响应基团。细胞膜表面的ALP首先催化LND-1p-ES转化为LND-1-ES,触发初级自组装。其后,LND-1p-ES/LND-1-ES进入细胞质,在胞内ALP和CES共同作用下转化为凝胶因子LND-1-OH。后者可在细胞内形成致密的纳米纤维网络,不仅能干扰肌动蛋白的组装、提高癌细胞的ROS水平,还可作为药物储库,在胞内蛋白酶的作用下缓慢释放LND,通过破坏线粒体功能诱导癌细胞死亡。由于ALP位于细胞膜和细胞质,而CES主要位于细胞质,因此癌细胞高表达的ALP和CES可对LND-1p-ES的细胞内外的自组装进行时空调控,进一步提升自组装的时空精准度。如图1C中的体内成像实验显示,LND-1p-ES在ALP和CES作用具有较高的稳定性,而在ALP、CES和蛋白酶K共同作用下,小鼠体内的荧光信号迅速减弱,成功实现了三酶共响应的成像与释放。
在体内级联组装的策略开发中,王浩课题组[17]通过设计系列工作,实现了组装体的形貌调控。其基本原理为连接抗癌药物的纳米粒子在肿瘤部位首先组装形成初级纳米纤维,起到“晶种”的作用以促进纳米粒子的形态转变,使纳米纤维的增长速度明显加快,从而实现抗癌药物在肿瘤部位的加速积累(图2)。该课题组设计了一种可形变的纳米材料活体BP-KLVFFK-GGDGR-YIGSR(4)来构筑人工细胞外基质(Artificial extracellular matrix,AECM),用于抑制肿瘤的浸润和转移[18]。由于双芘(Bis-pyrene,BP)分子间的疏水相互作用,分子4首先通过快速沉淀法形成纳米颗粒(4-NPs)。静脉注射后,由于肿瘤部位的EPR效应,4-NPs有效地积聚在肿瘤部位。累积的4-NPs同时在实体肿瘤周围转化为纳米纤维(4-NFs),并进一步缠绕与肿瘤细胞表面的受体结合形成AECM。AECM在原发肿瘤部位稳定存在72 h以上,有效抑制了乳腺癌和黑色素瘤模型的肺转移。在其后的工作中,王浩等[19]通过金属离子调控多肽的自组装过程,设计了可用于肿瘤成像和治疗的分子BP-KLVFF-RGD(BKR)。当Ca2+存在时,组装好的纳米颗粒可原位转化为纳米纤维。BKR通过在U87细胞表面与Ca2+结合发生点亮,实现细胞特异性成像。此外,BKR肽在细胞表面的仿生形态转化可特异性杀死癌细胞,显示了该分子在癌症诊疗中的巨大潜力。在靶向癌细胞的基础上,Wang等[20]进一步实现了细胞器靶向的级联自组装多肽。该多肽在肿瘤组织中首先组装成纳米颗粒,然后进入癌细胞并在线粒体靶向细胞肽KLAK的帮助下到达线粒体。由于癌细胞的线粒体周围有大量ROS生成,ROS破坏纳米颗粒的亲水/疏水平衡使其向纳米纤维转化,在形态转变的过程中,治疗性肽可以通过多位点与线粒体膜发生相互作用,极大地增强对线粒体膜的破坏作用,从而有效提升肿瘤治疗效果。该系列级联组装策略为疾病的诊断和治疗提供了新策略。
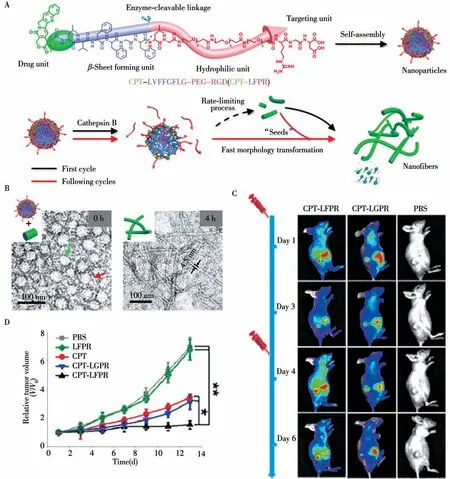
图2 重组装形态转变实现抗癌药物在肿瘤部位的加速积累[17]Fig.2 Self-assembly induced morphological transformation accelerate the accumulation of anticancer drugs in tumor sites[17]
虽然响应多种外部刺激的多肽设计和开发已经取得了重大进展,但由短肽和非肽小分子共同组装形成多重响应体系的构建仍具有挑战。近日,吉维等[21]通过多样化的联吡啶衍生物与N-端修饰有官能团的二苯丙氨酸二肽(FF,淀粉样蛋白的核心识别序列和最简单的多肽砌块)衍生物(ZFF,FmocFF)多级次共组装,实现了多重响应的超分子自组装。FF二肽与联吡啶衍生物之间的共组装动力来自羧酸和吡啶之间较强的分子间氢键,通过对联吡啶/二肽组分的微调,可有效控制其形态多样性,从而获得纳米纤维、纳米带、纳米棒、纳米球、纳米管等多种形貌的组装体,以实现其生物功能的调控。该系列工作将促进级联自组装体系的合理设计和开发。
2 级联自组装/解组装
小分子探针自组装成超分子结构往往会导致探针的荧光自猝灭或19F核磁共振信号的关闭,此时通过蛋白酶等靶分子作用可破坏超分子结构生成单体分子,实现荧光或19F核磁共振信号的打开。基于该级联自组装/解组装策略,研究者们开发了一系列高灵敏度的光、磁癌症诊疗纳米探针。“智能”组装/解组装策略在药物递送中的应用已有所总结[22],故在本综述中不再赘述。
2.1 光学成像
不同于常规荧光探针的聚集诱导猝灭现象,梁高林教授课题组[23]利用2-氰基-6-氨基苯并噻唑与半胱氨酸(CBT-Cys)点击缩合反应,实现了自组装诱导的荧光增强。他们设计了一种荧光探针Cys(StBu)-Lys(FITC)-Asp-Glu-Val-Asp-CBT,通过GSH控制在细胞内自组装成FITC-纳米颗粒(FITC-NPs)。巧妙的是,当这种多功能荧光探针经过GSH控制的缩合形成FITC-NPs时,荧光并未发生自猝灭,反而表现出更强的荧光信号。随后的Caspase-3对FITC-NPs切割导致其分解,此时荧光发生去猝灭而产生第二次荧光增强,实现活细胞中GSH和Caspase-3的荧光“On-On”检测。
相比于上述“始终打开”的荧光探针设计,荧光“关闭-打开”探针的背景噪声更低,因此也具有更高的检测灵敏度[24]。当探针在目标部位“打开”荧光之前,背景信号需要被关闭。目前常用的两种猝灭策略为荧光共振能量转移(Fluorescence resonance energy transfer,FRET)[25]和聚集诱导猝灭(Aggregation induced quenching,ACQ)[26]策略。与单重猝灭探针相比,双重猝灭探针可进一步减少背景信号强度,因此其“打开”的荧光信号的放大倍数会更大。基于此,梁高林教授课题组[27]设计了一种可以同时实现FRET和ACQ两种猝灭策略的小分子前体荧光探针Cys(St Bu)-Lys(Gly-Lys(DABCYL)-Gly-Gly-Arg-Arg-Val-Arg-Gly-FITC)-CBT(5)。探针5进入癌细胞后,发生还原控制的缩合反应,“智能”地自组装成双重猝灭的纳米颗粒5-NPs。在细胞内弗林蛋白酶的剪切下,游离的FITCGRVRR将从纳米颗粒上脱离,完全解除其双重猝灭,从而达到具有高信噪比的荧光信号“打开”。通过用其他酶特异性剪切的底物取代RVRR底物,该设计亦可实现其他生物分子的局部灵敏检测或成像。
除了上述“On-On”和“Off-On”模式外,Zhang等[28]通过荧光信号的连续多次开关实现了活细胞中纳米纤维的级联组装-解组装过程的追踪。其设计的前体探针(2-Pyridinyldithio)-ethoxy-glutaric acyl-Phe-Phe-Lys(4-nitro-2,1,3-benzoxadiazole)-Tyr(H2PO3)-OH(PEA-NBD-Yp)由3部分组成:①ALP响应序列Phe-Phe-Lys-Tyr(H2PO3)-OH;②2-硫吡啶封住的自断裂结构巯基乙醇,可通过二硫键响应GSH还原诱导解组装;③环境敏感型的荧光团4-硝基-2,1,3-苯并噁二唑(NBD)。探针PEANBD-Yp单体处于荧光Off 1状态,在特定癌细胞的胞外环境中,探针PEA-NBD-Yp首先被ALP转化成PEA-NBD-Y,并在细胞外膜上自组装成纳米纤维,伴随细胞膜上荧光信号“开启”(On 1)。其后,自组装的纳米纤维被细胞摄取,伴随细胞内荧光信号“开启”(On 2)。最后,细胞内纳米纤维中的PEA-NBD-Y单体将被胞内GSH还原,生成NBD-Y,使纳米纤维解组装并伴随荧光信号“关闭”(Off 2)。该工作通过连续的荧光信号“开启”和“关闭”,实现了细胞中纳米纤维的级联自组装-解组装过程示踪,也为研究者深入了解活细胞中的生物过程(如微管蛋白的形成)提供了一种新思路。
袁月等进一步拓展了“组装/解组装”策略,实现了D-萤光素的胞内合成与长效释放。D-萤光素半衰期短(小于30 min)是应用萤火虫生物发光系统进行活体成像的最大挑战。以脑胶质瘤的重要标志物脂肪酸酰胺水解酶(Fatty acid amide hydrolase,FAAH)作为肿瘤特异性靶标,Yuan等[7]设计了潜在生物发光(Bioluminescence,BL)探针(D-Cys-Lys-CBT)2(6),6在进入细胞后,双硫键被细胞内的GSH还原,自组装形成纳米粒子6-NPs。由于6-NPs的疏水性和纳米尺寸不易被细胞泵出,因此其在细胞内的循环时间有效延长。其后,通过FAAH裂解6-NPs中环状二聚体的酰胺键,纳米粒子被缓慢分解,释放出Lys-氨基-D-萤光素或氨基-D-萤光素,实现了长达数日的生物发光成像。因此,该D-萤光素衍生物可用于长期监测肿瘤模型中FAAH的活性或各种生物事件的长期生物发光成像。在此基础上,该课题组又设计了两种化学稳定的萤光素前体分子CBT-D-Cystine-CBT(D-1)和CBT-LCystine-CBT(L-1),可在细胞内通过自组装/解组装的方式释放D-氨基萤光素用于生物发光成像[29]。基于其良好的稳定性,该系列前体分子有望作为D-萤光素的替代品广泛应用于生物发光成像。
2.2 磁共振成像
磁共振成像(MRI)因其显著的软组织对比度、优异的成像分辨率和无电离辐射等优点而成为使用最频繁的医学成像技术之一。由于水分子中固有的1H信号,使得传统1H MRI的成像信号受到的背景干扰严重。相对而言,19F MRI具有与1H MRI相似的灵敏度,并且内源浓度通常低于检出限,极低的背景信号让19F外源造影剂具有极高的信噪比和特异性,因而在临床上具有广阔的应用前景。借助19F NMR/MRI技术,很多含氟化合物被用于评估生物标记物和生命过程。然而,19F成像通常需使用高剂量的探针使目标区域产生高信号。因此,开发低注射剂量和高局部信号的19F磁共振探针十分必要。
如图3A所示,袁月等[30]报道了一种小分子在体内自发组装-目标位置解组装产生19F NMR/MRI信号的策略,不但大幅提高了19F NMR/MRI信号的强度、灵敏度和准确性,还降低了所需19F探针的注射剂量。该探针Cys(St Bu)-Asp-Glu-Val-Asp-Lys(FMBA)-CBT(7)(图3B)首先在胞内还原性环境中发生分子间缩合形成二聚体,二聚体堆积自组装生成19F纳米粒子,导致19F NMR/MRI信号峰展宽而大幅降低。其后在凋亡细胞中高表达的酶Casp3/7的剪切下,纳米粒子解组装,释放出单体分子,19F NMR/MRI信号被打开。如图3C所示,19F信号“关-开”的过程可依次用于检测体内的GSH和Casp3/7的活性,并实现了斑马鱼断尾凋亡模型中的Casp3/7成像。在后续工作中,Yuan等[6]设计了一种智能靶向蛋白酶Legumain(Lgmn,大多数人体实体瘤中过表达[31])的19F MRI探针(Cys(StBu)-Ala-Ala-Asn-Lys(FMBA)-CBT)(8)。与7的设计类似,在Lgmn的作用下,组装好的纳米粒子的二聚体被剪切断开,解组装释放游离单体,19F NMR信号峰得以重新恢复。自组装/解组装过程中核磁共振信号的“On-Off-On”可用于相继检测GSH的浓度和Lgmn的活性。利用该“智能组装/解组装”策略,研究人员实现了斑马鱼体内Lgmn19F核磁共振成像,显示该策略在肿瘤高灵敏度19F磁共振成像上有着较大的应用前景。
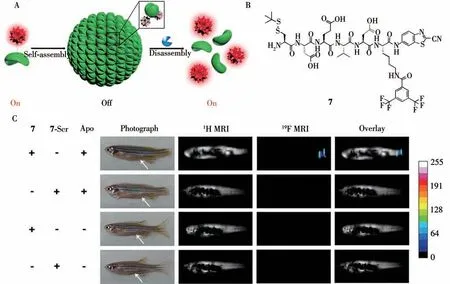
图3 级联组装/解组装应用于斑马鱼断尾凋亡成像[30]Fig.3 Tandem self-assembly and disassembly strategy successfully applied for MR imaging of apoptotic cells in zebrafish[30]
在上述工作基础上,Liang等[32]结合1H MRI的高灵敏度和19F MRI的高选择性优点设计了双功能氟探针(TFMB)-Arg-Val-Arg-Arg-Cys(StBu)-Lys-CBT(9)。通过9进一步将Fe3O4纳米颗粒(IONP)功能化,得到IONP@9,IONP@9的19F MRI信号最初由于顺磁弛豫增强(Paramagnetic relaxation enhancement,PRE)而关闭[33]。在弗林蛋白酶的剪切下,(TFMB)-Arg-Val-Arg-Arg从IONP@9复合物中分离,同时启动CBT-Cys缩合反应,IONP纳米颗粒发生交联聚集。一方面,IONP的聚集会提高周围水分子的横向驰豫速率(R2),提高T21H MRI信号;另一方面,(TFMB)-Arg-Val-Arg-Arg从IONP@9复合物中分离将减弱PRE效应,从而开启19F MRI信号。该智能分子实现了14.1 T下斑马鱼肿瘤的精确双模(1H和19F)磁共振成像,调和了传统MRI探针的选择性和灵敏度之间的两难,为实现肿瘤精准成像提供了新思路。
3 展 望
对癌症进行精确的诊断成像以及提高抗癌药物的利用率一直是肿瘤医学领域的研究重点。原位调控纳米结构的形成和释放的策略,既具备了自由药物分子在肿瘤组织良好的生物穿透性的优点,同时又兼具了纳米药物良好的生物利用度和更长的血液循环时间等药代动力学优势。在单一生物分子或化学反应调控自组装的基础上,研究者提出了小分子级联自组装/解组装策略以进一步提高前体分子对肿瘤组织的靶向性,达到癌症精准成像和抗癌药的有效富集。在增效的同时,该策略也实现了减毒,即可降低药物在肝肾等器官的非特异性蓄积,从而降低药物的毒副作用,在癌症的特异性诊疗中显示出巨大潜力。此外,自组装和重组装过程提供了与以往完全不同的癌细胞杀灭机理,如克服细胞多药耐药、引起溶酶体增压、阻断细胞物质交换等,可为癌症治疗提供新思路。在后续应用研究和临床转化过程中,需从提高合成产量、产率,深化活体微环境分析,优化疾病模型和试工业生产研究等方面继续努力。
猜你喜欢
杂志排行
分析测试学报的其它文章
- Research Progress of Hemicyanine Dye for Molecular Imaging
- 碱性磷酸酶的体外检测和体内成像研究进展
- Recent Progress in Nanoscale MOFs for Biological Imaging of Tumors and Tumor Markers
- I-Motif-based Nanosystems for Biomedical Applications:p H Imaging,Drugs Controlled Release and Tumor Theranostics
- A Low-cost,Automated Nucleic Acid Extraction System Converted from the Open-Source Rep Rap 3D Printer
- Research Progress on Analytical Methods for Deciphering Adenosine-to-inosine RNA Editing
