微小RNA-199a靶向调控沉默信息调节因子1对脑梗死大鼠神经元凋亡的影响
2022-04-22李建红卢宏全陈俊玲
林 影, 李建红, 卢宏全, 陈俊玲
(1. 海南西部中心医院 神经内科, 海南 儋州, 571700;2. 海南医学院第二附属医院 神经内科, 海南, 海口, 570100;3. 海南西部中心医院 肿瘤内科, 海南 儋州, 571700;4. 海南省海口市人民医院 神经内科, 海南 海口, 570100)
脑梗死是临床常见的脑血管疾病,往往由脑供血动脉闭塞造成脑组织缺血性坏死引起,常见临床表现有脑血栓形成、脑栓塞和神经元损伤等,严重时会导致患者失去意识、半身不遂和发生神经功能障碍,甚至危及生命[1-3]。目前,脑梗死的医治方法仍以药物治疗为主,即通过神经保护类药物、改善脑循环药物缓解病情[4]。研究[5]显示,多种因子参与调控脑梗死的病理过程。沉默信息调节因子1(SIRT1)作为多个通路中重要的调控因子,可提高细胞对抗氧化应激的能力,保护神经元并抑制其凋亡[6]。微小RNA(miRNA)是近年来发现的一种非编码小分子RNA, 可在转录后调控相关基因的表达[7]。微小RNA-199a(miR-199a)已被证实与脑缺血及神经元损伤有密切联系[8], 而SIRT1可能作为miR-199a的作用靶基因共同参与调控细胞炎性损伤,但相关机理有待进一步验证。本研究以脑梗死大鼠实验模型为实验对象,探讨miR-199a是否通过靶向调节SIRT1而参与对脑梗死大鼠神经元损伤的调控。
1 材料与方法
1.1 主要材料与仪器
miR-199a质粒及阴性对照, miR-199a siRNA及阴性对照,SIRT1siRNA表达载体(北京擎科生物科技有限公司)。双荧光载体(上海吉玛制药有限公司),转染试剂Lipofectamine 2000(货号11668030, 美国Thermo Fisher Scientific公司),苏木精-伊红(HE)染色试剂盒(货号C1091,上海碧云天生物技术有限公司), SIRT1抗体(货号ab110304, 英国Abcam公司)、活化型半胱氨酸天冬氨酸蛋白酶-3(Cleaved caspase-3)抗体(货号ab214430, 英国Abcam公司)、羊抗鼠免疫球蛋白G(IgG)抗体(货号ab150113, 英国Abcam公司)、羊抗兔IgG抗体(货号ab150077, 英国Abcam公司),荧光定量聚合酶链反应(PCR)仪(7500型,美国ABI公司),凝胶成像系统(HE-120, 上海生工生物有限公司),全自动酶标仪(Varioskan LUX, 美国Thermo Fisher Scientific公司)。
1.2 动物模型构建
从河北省实验动物中心购得清洁级成年雄性SD大鼠60只,体质量(200±10) g, 许可证号SCXK(冀)2018-004。随机挑选12只大鼠纳入假手术组,麻醉后固定于手术台上,暴露颈内动脉及颈外动脉,不设置栓线,直接缝合皮肤。将剩余48只大鼠麻醉后固定于手术台上,分离颈内动脉及颈外动脉,结扎左侧颈外动脉的远心端,于总动脉近心端及颈内动脉远心端放置动脉夹,剪断颈外动脉结扎处,设置栓线,打开颈内动脉的动脉夹并持续推进栓线,直至遇到阻力。阻断大脑动脉血流后固定栓线,缝合皮肤, 2 h后拔出栓线,进行神经行为学评估,依据评分判定模型是否构建成功(评分≥3分即建模成功),评分越高表明神经功能损害越严重。0分,无任何抽搐行为; 1分,出现独立的肌痉挛; 2分,出现短暂的全身性痉挛; 3分,出现全身性强直痉挛; 4分,后肢出现站立和跌倒; 5分,反复抽搐,难以站立。将48只大鼠随机分为脑梗死组、miR-199a抑制组、miR-199a阴性对照组、miR-199a抑制+SIRT1抑制组,每组12只。分组后第1、5天, miR-199a抑制组大鼠尾部静脉注射miR-199a siRNA 2 mL/kg; miR-199a阴性对照组大鼠注射siRNA无意义序列2 mL/kg; miR-199a抑制+SIRT1抑制组大鼠注射miR-199a siRNA 2 mL/kg和SIRT1siRNA表达载体150 μL/kg; 脑梗死组注射等量的生理盐水。
1.3 流式细胞仪检测
末次干预3 d后进行神经行为学评估,随后将各组大鼠断头取脑,置于磷酸盐缓冲溶液中清洗3次,取出缺血侧大脑半球组织,部分用液氮处理后冻存备用,部分置于4%多聚甲醛中固定备用,剩余部分用手术剪彻底剪碎,加入5 mL 0.4%胰蛋白酶置于37 ℃水浴锅中1 h, 期间不断摇晃使组织充分裂解,而后将胰蛋白酶吸净,加入磷酸盐缓冲溶液充分吹打,以400目金属网过筛,加入磷酸盐缓冲溶液稀释为单细胞悬液,反复吹打,静置1 h。1 000转/min离心3 min, 离心半径8 cm, 洗涤3次,加入细胞固定液1 mL, 4 ℃过夜处理, 1 000 转/min离心3 min, 离心半径8 cm, 去除固定液,加入50 μg/mL二苯基氯化碘盐液0.5 mL, 4 ℃避光染色30 min, 应用流式细胞仪检测神经元凋亡情况。
1.4 HE染色
取出固定备用的缺血侧大脑半球组织,以不同浓度乙醇梯度脱水,二甲苯染色透明,石蜡包埋后切片处理,厚度5 μm, 苏木精染色3 min, 清水洗净后加入低浓度盐酸酒精分化直至返蓝,用0.5%伊红染色3 min, 不同浓度酒精梯度脱水,二甲苯透明,树脂封片后置于显微镜下观察病理学变化。
1.5 荧光定量PCR检测
取出事先冷存备用的缺血侧大脑半球组织,研磨成粉,采用Trizol法提取组织RNA,检测RNA浓度,而后反转录,上机检测SIRT1mRNA、miR-199a表达水平。mRNA引物序列用Primer 3.0软件设计,由南京金斯瑞生物科技有限公司合成。引物序列见表1。

表1 引物序列信息
1.6 蛋白质印迹法(Western blot)分析
取出事先冷存备用的缺血侧大脑半球组织,研磨成粉,加入蛋白裂解液处理,不断振荡使蛋白裂解充分,加入0.5 mL提取液,静置5 min, 4 ℃下10 000转/min离心3 min, 取上层清液干燥5 min, 与上样缓冲液混合加热10 min, 倒入10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶板孔道中电泳,取出转膜后用5%脱脂奶粉封闭2 h, 脑组织蛋白中加入一抗[甘油醛-3-磷酸脱氢酶(GAPDH)抗体、SIRT1抗体、Cleaved caspase-3抗体, 1∶1 000], 4 ℃孵育过夜。弃封闭液,用TBST缓冲液清洗3次, 5 min/次。加入二抗(1∶1 500), 常温孵育45 min, 用TBST缓冲液清洗3次, 5 min/次。将发光液倒于膜上,浸泡1 min, 将膜取出,用吸水纸吸去多余液体,置于Syngene光密度扫描系统上,进行条带灰度分析。
1.7 双荧光素酶报告基因实验验证miR-199a与SIRT1 3′-UTR的结合作用
构建包含miR-199a靶位点的SIRT13′-UTR插入荧光素酶报告基因载体pGL3, 构建野生型重组报告基因载体(pGL3-SIRT1-WT), 同时构建包含结合序列突变的突变型重组报告基因载体(pGL3-SIRT1-MUT), 构建方法参照文献[9]。将2种基因载体与miR-199a质粒及miR-199a阴性对照质粒分别共转染于HEK293细胞中。细胞培养后裂解细胞,测定荧光素酶发光强度,根据双荧光素酶活性报告系统判断miR-199a与SIRT13′-UTR结合作用的强弱。
1.8 统计学分析
2 结 果
2.1 miR-199a对脑梗死大鼠神经功能的影响
与假手术组相比,其余4组处理前后的神经学评分均更高,差异有统计学意义(P<0.05)。假手术组、脑梗死组、miR-199a阴性对照组处理后的神经学评分与处理前比较,差异无统计学意义(P>0.05)。处理后, miR-199a抑制组、miR-199a抑制+SIRT1抑制组神经学评分均低于脑梗死组和处理前,差异有统计学意义(P<0.05); miR-199a阴性对照组、miR-199a抑制+SIRT1抑制组处理后神经学评分均高于miR-199a抑制组,差异有统计学意义(P<0.05)。见表2。

分
2.2 miR-199a对脑梗死大鼠脑组织SIRT1mRNA、miR-199a表达的影响
脑梗死组大鼠脑组织miR-199a表达量高于假手术组,SIRT1mRNA表达量低于假手术组,差异有统计学意义(P<0.05); 与脑梗死组、miR-199a阴性对照组相比, miR-199a抑制组、miR-199a抑制+SIRT1抑制组miR-199a表达量降低,SIRT1mRNA表达量升高,差异有统计学意义(P<0.05); miR-199a阴性对照组SIRT1mRNA、miR-199a表达量与脑梗死组相比,差异无统计学意义(P>0.05); 与miR-199a抑制组相比, miR-199a抑制+SIRT1抑制组miR-199a表达量升高,SIRT1mRNA表达量降低,差异有统计学意义(P<0.05)。见表3。
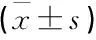
表3 各组大鼠脑组织SIRT1 mRNA、miR-199a表达量比较
2.3 miR-199a对脑梗死大鼠脑组织SIRT1蛋白表达的影响
脑梗死组大鼠脑组织SIRT1蛋白表达量低于假手术组, miR-199a抑制组、miR-199a抑制+SIRT1抑制组SIRT1蛋白表达量均高于miR-199a阴性对照组、脑梗死组, miR-199a抑制+SIRT1抑制组SIRT1蛋白表达量低于miR-199a抑制组,差异有统计学意义(P<0.05); miR-199a阴性对照组SIRT1蛋白表达量与脑梗死组比较,差异无统计学意义(P>0.05)。见图1、表4。

A: 假手术组; B: 脑梗死组; C: miR-199a抑制组; D: miR-199a阴性对照组; E: miR-199a抑制+SIRT1抑制组。图1 不同处理后大鼠脑组织SIRT1蛋白表达量比较
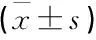
表4 各组大鼠脑组织SIRT1蛋白表达量比较
2.4 miR-199a与SIRT1 3′-UTR结合作用分析
双荧光素酶报告基因实验结果显示,与共转染miR-199a质粒和pGL3-SIRT1-MUT相比,共转染miR-199a质粒和pGL3-SIRT1-WT的荧光素酶活性更低,差异有统计学意义(P<0.05); 共转染miR-199a质粒和pGL3-SIRT1-MUT、共转染miR-199a阴性对照质粒和pGL3-SIRT1-WT、共转染miR-199a阴性对照质粒和pGL3-SIRT1-MUT的荧光素酶活性比较,差异无统计学意义(P>0.05)。见表5。
2.5 miR-199a对脑梗死大鼠神经元凋亡及神经功能的影响
脑梗死组神经元凋亡率和Cleaved caspase-3蛋白表达量高于假手术组, miR-199a抑制组、miR-199a抑制+SIRT1抑制组神经元凋亡率和Cleaved caspase-3蛋白表达量均低于脑梗死组、miR-199a阴性对照组, miR-199a抑制+SIRT1抑制组神经元凋亡率和Cleaved caspase-3蛋白表达量高于miR-199a抑制组,差异有统计学意义(P<0.05); 脑梗死组神经元凋亡率、Cleaved caspase-3蛋白表达量与miR-199a阴性对照组比较,差异无统计学意义(P>0.05)。见图2、图3、表6。

A: 假手术组; B: 脑梗死组; C: miR-199a抑制组; D: miR-199a阴性对照组; E: miR-199a抑制+SIRT1抑制组。图2 各组大鼠脑组织Cleaved caspase-3蛋白表达量比较

A: 假手术组; B: 脑梗死组; C: miR-199a抑制组; D: miR-199a阴性对照组; E: miR-199a抑制+SIRT1抑制组。图3 各组大鼠神经元凋亡情况
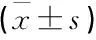
表6 各组神经元凋亡率和Cleaved caspase-3蛋白表达量比较
2.6 miR-199a对脑梗死大鼠缺血侧脑皮层组织病理变化的影响
假手术组大鼠脑组织及皮层神经元结构完整,无明显变性及胶质细胞增生; 脑梗死组大鼠脑组织出现变性,神经元坏死,脑组织稀松且出现胶质细胞增生; 与脑梗死组相比,miR-199a抑制组、miR-199a抑制+SIRT1抑制组脑组织变性得到缓解,胶质细胞数量减少,神经元坏死程度缓解,脑梗死组与miR-199a阴性对照组病理形态变化相似; 与miR-199a抑制组相比, miR-199a抑制+SIRT1抑制组脑组织变性程度加剧,神经元坏死数量增多。见图4。

A: 假手术组(脑组织内有大量神经元); B: 脑梗死组(脑组织神经元数量减少,出现胶质细胞); C: miR-199a抑制组(脑组织神经细胞数量增多); D: miR-199a阴性对照组(与脑梗死组相似); E: miR-199a抑制+SIRT1抑制组(脑组织神经元恢复缓慢)。图4 各组大鼠缺血侧脑皮层神经元组织光学显微镜下病理变化(HE染色,放大200倍)
3 讨 论
脑梗死是常见的脑血管疾病,主要特征为神经元损伤引起的神经功能障碍,临床可通过神经保护类药物改善病情[10-11]。miRNA是一类含有21~23个核苷酸的非编码小分子RNA, 具有调控细胞内基因表达的生物学功能[12]。研究[13-14]发现,在脑缺血再灌注损伤模型中,多种miRNA表达量变化显著,其中高表达miR-199a被证实参与缺血耐受,可降低缺血耐受因子的表达水平,破坏神经功能。由此推测, miR-199a可能在其他脑血管类疾病如脑梗死中起调控作用。
本研究发现,建立脑梗死大鼠模型后,大鼠神经元凋亡率、Cleaved caspase-3蛋白表达量和神经学评分均显著升高,表明脑梗死大鼠神经元凋亡严重,已出现行为障碍。与miR-199a阴性对照组相比, miR-199a抑制组大鼠神经元凋亡率、Cleaved caspase-3蛋白表达量和神经学评分均显著降低,说明抑制miR-199a表达会抑制凋亡相关蛋白Cleaved caspase-3表达,减缓神经元凋亡,改善大鼠行动能力,与相关研究[15]结论一致。脑组织是脑血管疾病的主要危害部位,而其在动物神经功能中发挥着重要作用[16-17]。本研究对大鼠脑组织切片进行HE染色观察,发现假手术组具有完整的脑组织结构,脑梗死组脑组织出现明显变性和神经元坏死,与miR-199a阴性对照组相比, miR-199a抑制组神经元坏死程度得到缓解,脑组织结构逐渐恢复,充分证明抑制miR-199a对脑组织具有保护作用,但其作用机理仍待进一步探索。
有研究[18-19]指出,SIRT1对脑组织具有保护性作用,SIRT1高表达可抑制凋亡相关因子,减轻神经细胞凋亡,猜测SIRT1可能作为miR-199a的作用靶基因共同参与调控神经元损伤。本研究发现,与假手术组相比,脑梗死组大鼠脑组织中miR-199a表达量显著升高,SIRT1mRNA和SIRT1蛋白表达量显著降低,表明脑梗死会降低SIRT1表达,促进凋亡因子生长,破坏神经元,与相关研究[20]结论一致。本研究还发现,与miR-199a阴性对照组相比, miR-199a抑制组大鼠脑组织SIRT1mRNA和SIRT1蛋白表达量均显著升高,表明抑制miR-199a表达可进一步调控SIRT1表达,缓解神经元的凋亡。为了进一步探究miR-199a与SIRT1的靶向关系,本研究添加干扰SIRT1的siRNA和干扰miR-199a的siRNA抑制的脑梗死大鼠进一步比较,发现miR-199a抑制+SIRT1抑制组神经元凋亡率、Cleaved caspase-3蛋白表达量、处理后神经元评分显著高于miR-199a抑制组,且SIRT1mRNA和SIRT1蛋白表达量显著降低,大鼠脑组织变性加剧。双荧光素酶报告基因实验结果显示, miR-199a可与野生型SIRT13′-UTR特异性结合,进一步证实两者具有靶向关系,并推测抑制miR-199a表达对脑梗死大鼠神经元凋亡的调控作用可能与其靶向调控SIRT1表达有关。
综上所述,抑制miR-199a表达可靶向调控SIRT1, 在转录水平上促进SIRT1表达,提高SIRT1mRNA和SIRT1蛋白含量,进而抑制Cleaved caspase-3蛋白表达,缓解神经元凋亡,改善神经元坏死情况,恢复脑梗死大鼠的脑组织结构,减轻脑梗死病情。miR-199a可作为脑梗死治疗药物作用的新靶点,但miR-199a是否还通过其他通路间接参与调控神经元凋亡有待进一步证实。
