皮尔瑞俄类芽胞杆菌ZF390对黄瓜细菌性软腐病的防治效果
2022-04-22赵昱榕谢学文石延霞柴阿丽李宝聚
赵昱榕,谢学文,许 帅,谢 华,石延霞,柴阿丽,李 磊*,李宝聚*
(1. 中国农业科学院蔬菜花卉研究所,北京 100081;2. 北京市农林科学院/北京农业生物技术研究中心,北京 100089)
近年来,随着设施黄瓜栽培面积不断扩大,黄瓜细菌性病害的发生连年严重,由巴西果胶杆菌Pectobacterium brasiliense(Pbr)引起的黄瓜细菌性软腐病已经得到越来越多人的重视[1]。Pbr侵染黄瓜在我国于 2017年首次报道,该病害具有发病速度快、发病程度重、寄主范围广、难以防治等特点,病害发生后可导致黄瓜大面积减产甚至绝收,严重制约我国黄瓜产业的发展[2,3]。已有研究表明,化学农药不能完全有效地控制住软腐病的发生,因此亟需寻找其他安全有效的防治方法,保障黄瓜产业的可持续性发展[4-8]。生物防治成为目前的研究热点,近年来具有生防作用的类芽胞杆菌Paenibacillus被不断发现,除了报道较多的多粘类芽胞杆菌Paenibacillus polymyxa[9-12]以外,还有Paenibacillus ehimensis[13,14]、Paenibacillus jamilae[15]、Paenibacillus xylanexedens[16]、Paenibacillus alvei[17,18]、Paenibacillus yonginensis[19]、Paenibacillus wenxiniae[20]、Paenibacillus elgii[21]、Paenibacillus lentimorbus[22]、Paenibacillus terrae[23]、Paenibacillus kribbensis[24]和Paenibacillus triticisoli[25]等。通过离体试验、温室试验和田间试验的测定,树状类芽胞杆菌Paenibacillus dendritiformis菌株C454被证明对由胡萝卜果胶杆菌Pectobacterium carotovorum在马铃薯上引起的软腐病具有一定的生防能力[26]。然而到目前为止,防治果胶杆菌的生防报道还十分有限。已有一些皮尔瑞俄类芽胞杆菌Paenibacillus peoriae菌株被发现具有生防作用,菌株NRRL BD-62具有较广的抑菌谱,且拮抗物质稳定性较高[27];菌株Pa86对马铃薯青枯病具有较好的拮抗作用[28];菌株RhAn32能够有效抑制尖孢镰孢菌的生长并具有促生作用[29]。本研究以活体防效为基准筛选黄瓜细菌性软腐病高效生防菌株,以期实现黄瓜细菌性软腐病的有效防治,并为生防菌剂的进一步研发和生防机理的深度探究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试病原菌 野油菜黄单胞野油菜致病变种Xanthomonas campestrispv.campestris菌株GL2018042302、丁香假单胞杆菌番茄致病变种Pseudomonas syringaepv.tomatoFQ2017062301、丁香假单胞流泪致病变种Pseudomonas syringaepv.lachrymansHG2019081305、密执安棒杆菌马铃薯环腐亚种Clavibacter michiganensissubsp.sepedonicumMLS2020031402、密执安棒杆菌密执安亚种Clavibacter michiganensissubsp.michiganensisFQ2017052303、巴西果胶杆菌Pectobacterium brasilienseHG2015010904、葡萄土壤杆菌Agrobacterium vitisPT2016061503、西瓜嗜酸菌Acidovorax citrulliTG2019080401,以上病原菌均由中国农业科学院蔬菜花卉研究所分离保存。
1.1.2 供试培养基 LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1000 mL。NB培养基:蛋白胨10 g,牛肉粉3 g,NaCl 5 g,蒸馏水1000 mL,pH7.0。PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1000 mL。WA培养基:琼脂4 g,蒸馏水1000 mL。初始发酵培养基:葡萄糖10 g,蛋白胨10 g,NaCl 1 g,蒸馏水1000 mL,pH 7.0。
1.2 土壤样品中菌株的分离纯化
将 10 g山西省晋中市和顺县黄瓜细菌性软腐病发生严重地块中的健康黄瓜植株根际土壤样品充分悬浮于90 mL无菌水中,梯度稀释后吸取100 μL悬浮液均匀涂布于LB平板,28 ℃培养2 d,挑取形态不同的细菌菌落进行纯化。
1.3 黄瓜细菌性软腐病生防菌株的筛选
1.3.1 病原菌拮抗菌株的离体筛选 采用双层培养法[30]测定全部菌株。将菌株单菌落接种于LB液体培养基中,28 ℃、180 r/min振荡培养16 h,用空白LB液体培养基调节菌悬液浓度至OD600值为0.8,吸取5 μL菌悬液接种至PDA平板中央,28 ℃培养24 h后,用3 mL氯仿熏蒸12 h。将巴西果胶杆菌单菌落接种于NB培养基中,28 ℃、180 r/min振荡培养16 h,用空白NB培养基调节菌悬液浓度至OD600值为0.8,在5 mL WA培养基中均匀混入100 μL病原菌菌悬液,倒入平板平铺至PDA上层,晾干后28 ℃培养24 h。每处理3次重复,若待测菌株菌落周围出现透明圈,则表明该菌株对黄瓜细菌性软腐病菌具有拮抗作用,为拮抗菌株。
1.3.2 病害生防菌株的活体筛选 采用喷雾法测定拮抗菌株对黄瓜细菌性软腐病的活体防效,筛选高效生防菌株。将200 mL的OD600值为0.8的病原菌菌悬液喷雾接种于15株一叶一心时期的健康新泰密刺黄瓜幼苗上,温度28 ℃、相对湿度75%保持24 h后,喷雾接种300 mL OD600值为0.8的拮抗菌株菌悬液100倍液,以接种等体积的3%中生菌素可湿性粉剂650倍液为药剂处理,接种蒸馏水为对照处理。每处理 3次重复。待空白对照完全发病后,调查病情指数并计算防效。病级分类标准参考李磊[31]的研究,0级:无病斑;1级:病斑面积占整个叶面积的5%以下;2级:病斑面积占整个叶面积的6%~25%;3级:病斑面积占整个叶面积的26%~50%;4级:病斑面积占整个叶面积的51%~75%;5级:病斑面积占整个叶面积的 75%以上。病情指数=100×∑(各级病叶数×相对级数的代表值)/(总叶数×最高级数的代表值),防效(%)=100×(对照病情指数-处理病情指数)/对照病情指数。
1.4 菌株ZF390的鉴定
1.4.1 菌株形态及生理生化特性 将菌株ZF390划线接种于LB固体培养基,28 ℃培养48 h后观察菌落形态,并利用透射电镜和扫描电镜观察菌体形态。依据《常见细菌系统鉴定手册》[32]对其生理生化特征进行鉴定,并使用BIOLOG GENE Ⅲ试剂盒进行唯一碳源利用的测定。
1.4.2 多位点序列分型(MLST)分析 收集菌体送至北京奥维森基因科技有限公司进行全基因组测序,将序列上传至NCBI后,根据注释信息,下载不同类芽胞杆菌菌种模式菌株的16S rDNA (IAQ67_00050)、gyrB(IAQ67_00030)、rpoD(IAQ67_19485)、rho(IAQ67_00730)、rpsA(IAQ67_17705) 基因序列,用 MEGA 7.0、Sequence Matrix、Seaview 4.0软件按顺序比对、裁剪、连接、转换格式后,利用MEGA 7.0软件最大似然法,设置自举重复数为1000次,构建多基因联合系统发育树。
1.5 菌株ZF390细菌抑菌谱的测定
试验方法同1.3.1,下层接种菌株ZF390菌悬液,上层接种不同病原细菌菌悬液,以不接种菌株ZF390作为对照,每处理3次重复,测定其细菌抑菌谱,根据抑菌圈直径,计算抑菌率。抑菌率(%)=100×抑菌圈直径/对照平板直径。
1.6 菌株ZF390摇瓶发酵工艺的优化
1.6.1 种子液的活化与发酵液生物量的测定 将菌株ZF390单菌落接种于LB液体培养基中,28 ℃、180 r/min振荡培养16 h,用空白LB液体培养基调节菌悬液浓度至OD600值为0.6,制成种子液。发酵液的生物量以菌体浓度表示,梯度稀释摇培24 h后的发酵液至适当浓度,吸取100 μL菌悬液均匀涂布于LB平板,28 ℃培养2 d,根据平板上的菌落数计算菌体浓度,每处理3次重复。菌体浓度(CFU/mL)=平板上的平均菌落数×稀释倍数×10。
1.6.2 培养基组分的优化 将种子液以2%(v/v)的接种量接种至装液量为100 mL/250 mL的初始发酵培养基中,28 ℃、180 r/min进行振荡培养。采用单因素法测定同等质量分数的碳源(葡萄糖、果糖、麦芽糖、乳糖、蔗糖、糖蜜、可溶性淀粉和糊精)、氮源(蛋白胨、胰蛋白胨、酵母粉、水溶性黄豆饼粉、水溶性棉籽饼粉、水溶性花生饼粉、发酵专用豆粕粉和发酵用玉米浆干粉)和无机盐(NaCl、KCl、CaCl2、K2HPO4、CaSO4、FeSO4·7H2O、MnSO4·H2O 和 MgSO4·7H2O)对菌株 ZF390 菌体浓度的影响。采用爬坡试验(最适碳源和氮源浓度分别设定为10、20、30、40和50 g/L,最适无机盐浓度设定为0.4、0.8、1.2、1.6和2.0 g/L)和三因素三水平正交试验(最适碳源和氮源浓度设定为5、10和15 g/L,最适无机盐浓度设定为1.0、1.2和1.4 g/L)确定碳源、氮源和无机盐的最佳添加量。
1.6.3 发酵条件的优化 采用单因素法依次筛选不同培养温度(25 ℃、28 ℃、32 ℃、35 ℃、37 ℃和40 ℃)、初始pH(5.0、6.0、7.0、8.0和9.0)、装液量(50、100、150和200 mL/250 mL)、种子液接种量(1%、2%、3%、4%和5%(v/v))和转速(150、180、210和240 r/min)对菌株ZF390菌体浓度的影响,最终确定最适发酵条件。
1.6.4 发酵工艺优化前后的比较 分别利用初始发酵工艺和优化后的发酵工艺对菌株 ZF390进行摇瓶发酵,每4 h测定一次发酵液的菌体浓度,连续测定48 h,绘制生长曲线。
2 结果与分析
2.1 黄瓜细菌性软腐病生防菌株的筛选
从16份根际土壤中分离纯化出155株细菌菌株。经过离体平板测定后,筛选得到6株对黄瓜细菌性软腐病菌有抑制作用的拮抗菌株,并对其进行编号ZF388~ZF393,其中菌株ZF388、ZF389和ZF391的抑菌圈直径均在5.5 cm以上,菌株ZF388产生的抑菌圈最大,显著大于其他菌株产生的抑菌圈,直径为6.18 cm,而菌株ZF390、ZF392和ZF393的抑菌圈直径不足2.5 cm(表1,图1)。为得到更加有利于田间应用的菌株资源,利用活体盆栽试验测定6株拮抗菌株对黄瓜细菌性软腐病的防治效果,筛选高效生防菌株,对照处理的黄瓜幼苗在接种病原菌48 h后全部发病,几乎所有叶片上均出现软腐症状,发病严重的植株茎部软烂、折断,整株死亡,经菌株ZF390处理过的植株茎部未发病,叶片上的病斑变干不再向外扩展,生长点可继续正常生长,防效达77.94%,显著高于其他拮抗菌株和对照药剂中生菌素的防效(表1,图2)。通过上述结果可以发现拮抗菌株在离体条件下的抑菌圈直径和在活体条件下的防治效果无显著的相关性,本研究利用离体平板先筛选出对病原菌具有抑制作用的拮抗菌株,再通过活体盆栽确定能够有效防治该病害的生防菌株,以获得能够适用于田间应用的资源,结合以上结果选择菌株ZF390为后续试验对象。

表1 六株拮抗菌株对黄瓜细菌性软腐病的防治作用Table 1 Inhibitory effect of six antagonistic strains against cucumber bacterial soft rot

图1 黄瓜细菌性软腐病拮抗菌株对病原菌的抑制作用Fig. 1 Inhibition of cucumber bacterial soft rot antagonistic strains onPbr

图2 拮抗菌株对黄瓜细菌性软腐病活体盆栽防效Fig. 2 Control effect of antagonistic strains on cucumber bacterial soft rot in greenhouse
2.2 菌株ZF390的鉴定
2.2.1 形态学观察 菌株ZF390在LB平板上28 ℃条件下培养时生长速度较慢,菌体与培养基结合紧密,用接种环不易挑起,淡黄色,有特殊气味,单菌落较小,为边缘不规则的圆形,表面不光泽,中心处相对边缘颜色较白,但不隆起;菌体为椭圆形杆状、饱满、表面略微凹凸不平,长2~4 μm、宽0.5~1 μm,周生多根鞭毛(图3)。

图3 菌株ZF390形态学特征Fig. 3 Morphology of strain ZF390
2.2.2 生理生化特性 如表2所示,菌株ZF390酪蛋白水解反应为阳性,精氨酸水解酶、吲哚产生、明胶液化、硝酸盐还原反应为阴性;可以利用甘油、L-阿拉伯糖、核糖、D-木糖、甲基木糖苷、D-果糖、甘露醇、甲基-D-甘露糖苷、水杨苷、麦芽糖、龙胆二糖、D-松二糖、N-乙酰葡糖胺,不能利用D-阿拉伯糖、侧金盏花醇、D-海藻糖、2-酮基-D-葡糖酸盐、5-酮基-D-葡糖酸盐、鼠李糖。
2.2.3 MLST分析 分析多基因联合系统发育树,菌株ZF390(登录号CP061172.1)与皮尔瑞俄类芽胞杆菌P. peoriae模式菌株KCTC 3763T的亲缘关系最近(图4)。结合形态特征、生理生化指标、BIOLOG唯一碳源利用特性和MLST分析结果,确定菌株ZF390为皮尔瑞俄类芽胞杆菌。

图4 菌株ZF390多基因联合系统发育树Fig. 4 Phylogenetic tree based on the multigene sequences of strain ZF390
2.3 菌株ZF390细菌抑菌谱的测定
经测定,菌株ZF390对8种病原细菌的生长均有抑制作用(表3),具有广谱抑菌活性,对野油菜黄单胞野油菜致病变种和丁香假单胞流泪致病变种的抑制率显著高于对其他病原细菌的抑制率。

表3 菌株ZF390细菌抑菌谱Table 3 The antagonistic effects of strain ZF390 against various pathogenic bacteria
2.4 菌株ZF390摇瓶发酵工艺的优化
2.4.1 培养基组分的优化 经测定,以乳糖为碳源的发酵液菌落数最高,为1.05×107CFU/mL(图5A);以酵母粉为氮源的发酵液菌落数最高,为8.81×108CFU/mL(图5B);以MgSO4·7H2O为无机盐的发酵液菌落数最高,为1.62×109CFU/mL(图5C),菌株ZF390摇瓶发酵的最佳碳源、氮源和无机盐确定为乳糖、酵母粉和MgSO4·7H2O。测定不同乳糖浓度、酵母粉浓度和MgSO4·7H2O浓度对发酵液菌落数的影响,乳糖浓度为10 g/L的发酵液菌落数最高,为1.21×109CFU/mL(图5D);酵母粉浓度为10 g/L的发酵液菌落数最高,为9.11×108CFU/mL(图5E);MgSO4·7H2O浓度为1.2 g/L的发酵液菌落数最高,为8.33×108CFU/mL(图5F)。根据爬坡试验的结果设置三因素三水平正交试验,结果表明影响发酵液菌落数因素的顺序为乳糖>酵母粉>MgSO4·7H2O,发酵培养基的最佳组分为乳糖 15 g/L,酵母粉 10 g/L和MgSO4·7H2O 1.2 g/L(表4)。
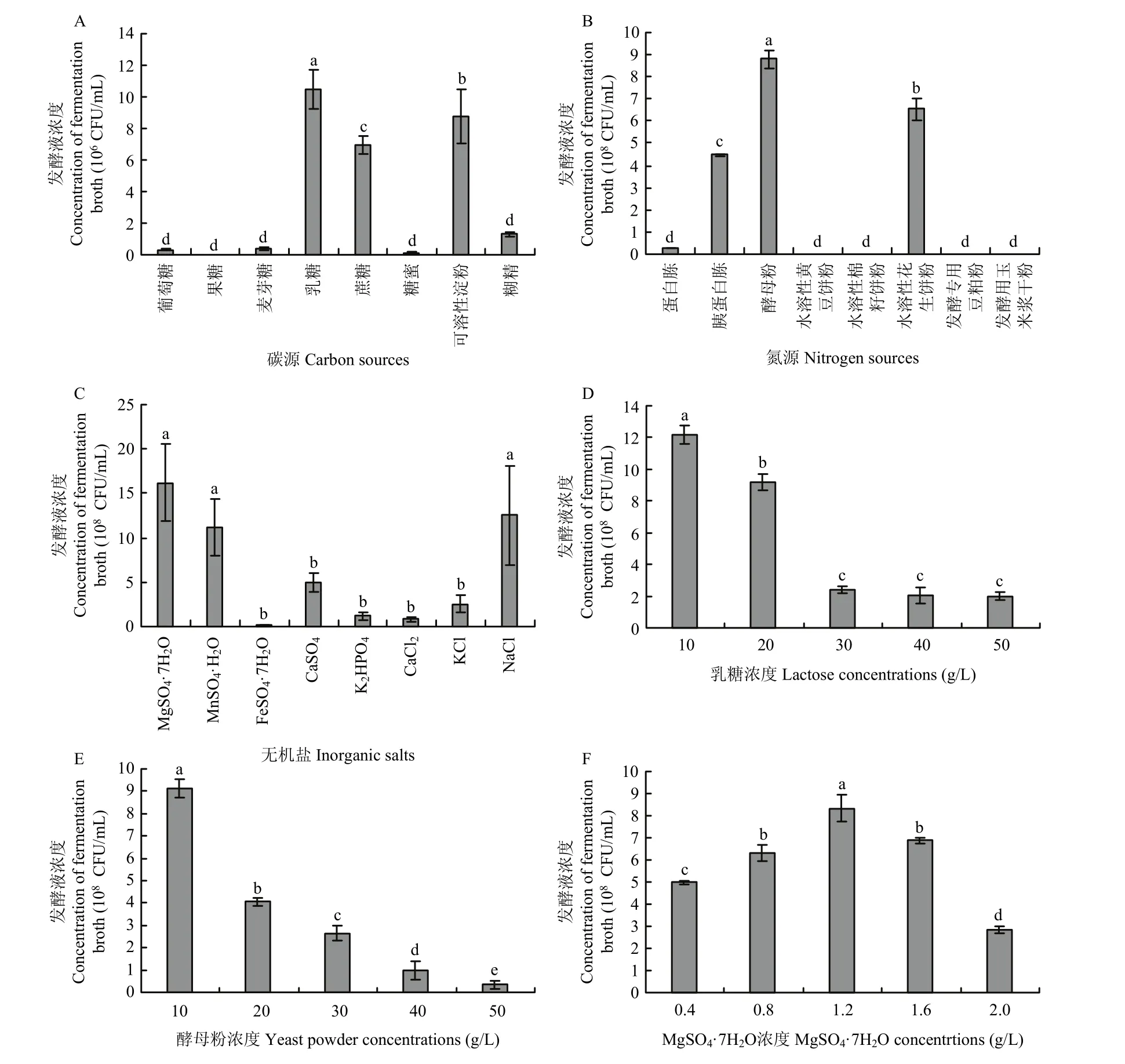
图5 菌株ZF390发酵培养基的优化Fig. 5 Optimization of strain ZF390 fermentation medium
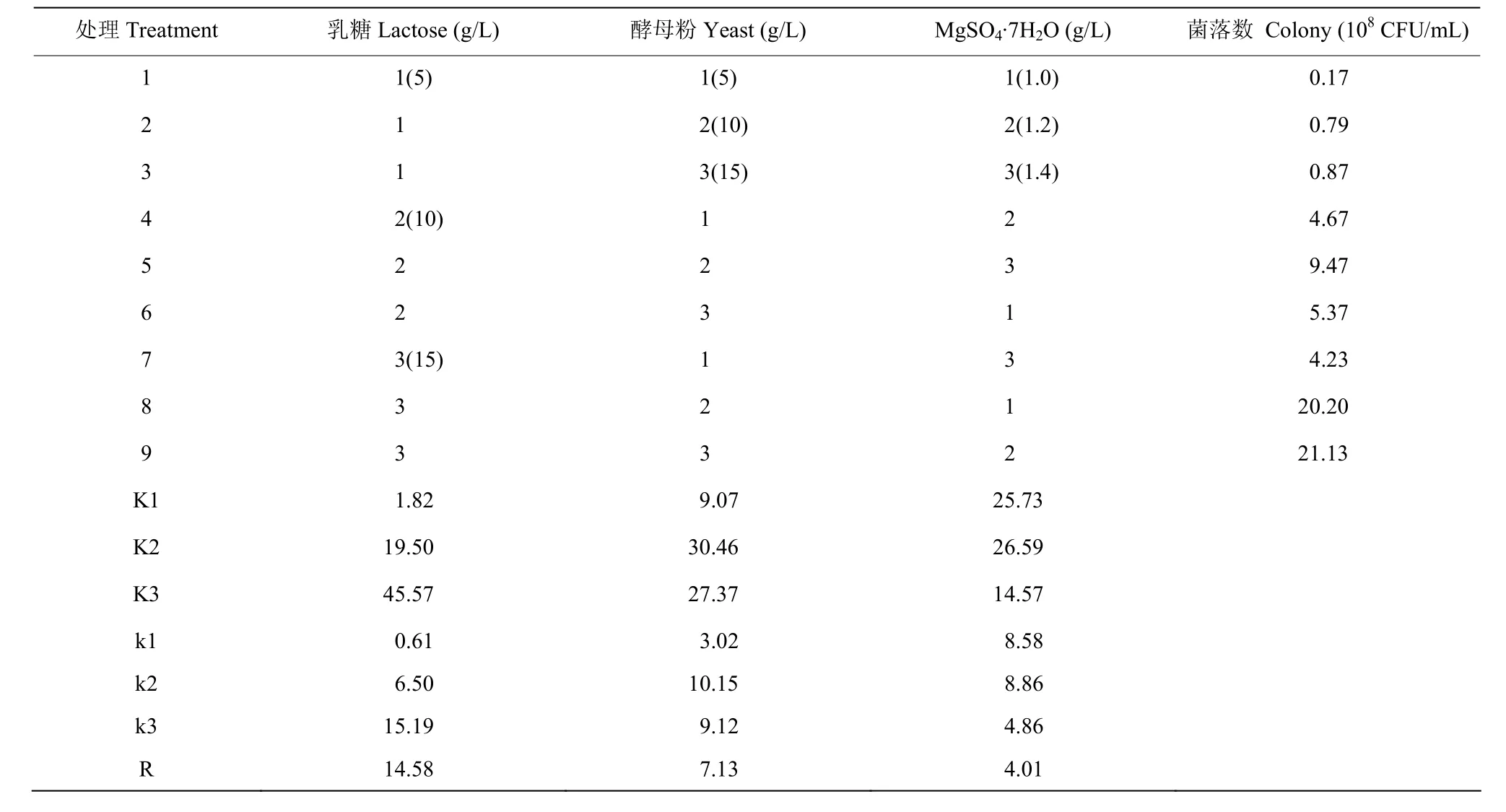
表4 正交试验中的因素及水平Table 4 Factors and levels in orthogonal test
2.4.2 发酵条件的优化 经测定,菌株ZF390在28 ℃时发酵液菌落数显著高于其他温度的发酵液菌落数,为1.47×109CFU/mL(图6A);在pH 7.0时发酵液菌落数显著高于其他pH发酵的发酵液菌落数,为2.20×109CFU/mL(图6B);装液量为50 mL时发酵液菌落数显著高于其他装液量发酵的发酵液菌落数,为1.77×109CFU/mL(图6C);接种量为3%时发酵液菌落数显著高于其他种子液接种量发酵的发酵液菌落数,为2.27×109CFU/mL(图6D);转速为240 r/min时发酵液菌落数显著高于其他转速发酵的发酵液菌落数,为2.26×109CFU/mL(图6E)。菌株ZF390最适发酵条件为温度:28 ℃;pH:7.0;装液量:50 mL/250 mL;种子液接种量:3%(v/v);转速:240 r/min。

图6 菌株ZF390发酵条件的优化Fig. 6 Optimization of strain ZF390 fermentation conditions
2.4.3 发酵工艺优化前后的比较 经测定,无论以何种方式进行发酵,接种种子液后,菌株ZF390的生长直接进入对数期,大致在20~24 h时对数期结束;以优化后的发酵工艺进行发酵,菌株ZF390在对数期后进入稳定期,菌体浓度基本保持不变,在36 h时浓度最大,为2.94×109CFU/mL,而以初始发酵工艺进行发酵的发酵液菌体浓度快速回落,发酵进入衰退期,在24 h时浓度最大,为1.45×105CFU/mL(图7)。

图7 菌株ZF390不同发酵工艺生长曲线Fig. 7 Growth curve of strain ZF390 under different fermentation conditions
3 讨论
我国黄瓜细菌性软腐病多由巴西果胶杆菌引起[4],该病害主要在拱棚、育苗场等地发生,重病拱棚中能造成黄瓜至少50%的减产,严重时导致黄瓜绝产[33]。生物防治具有安全、有效、无残留等特点,具备可持续、环保、简便与低能耗等技术优势,是保障农业可持续发展和粮食生产的有效措施,更是降低化学农药使用量,保障蔬菜水果和大宗农产品安全生产的根本手段[34]。目前,不仅鲜有针对黄瓜细菌性软腐病生防制剂的相关研究,市场上防治细菌病害的化学杀菌剂对该病害的防治效果也均不理想[35]。因此,筛选黄瓜细菌性软腐病高效生防菌株,同时为开发防治该病害的生防制剂提供菌种资源和数据支持具有重要意义。
拮抗细菌的分离多来源于土壤,从病原菌寄主植物病健植株生境分离拮抗细菌是常见方法,绝大部分研究是通过离体对峙培养的方法筛选拮抗细菌,但越来越多的研究表明,离体条件下细菌抑制病原菌的能力与其在植株活体上抑制此病原菌引起的病害不存在普遍的相关性,因此在培养基上产生最大抑菌圈的菌株并不一定是最好的生防因子,并且这些菌株通常无法表现出较好的田间防效[36]。本研究先利用双层培养法离体筛选对黄瓜细菌性软腐病菌具有抑制作用的拮抗细菌,再采用活体盆栽试验测定拮抗细菌在黄瓜幼苗上对病害的防治效果,以活体防效作为菌株生防效果的最终评价指标,筛选得到黄瓜细菌性软腐病高效生防菌株ZF390。该菌株虽在离体条件下的抑菌圈直径仅有1.37 cm,但其对黄瓜细菌性软腐病的治疗效果为77.94%,显著高于其他拮抗菌株和对照药剂的防效;且该菌株具有广谱的抑菌活性,对8种病原细菌均有不同程度的抑制作用。菌株ZF390在离体和活体条件下表现出抑菌差异的原因仍需进一步的深入研究,这可能是该菌株的主要生防机理。
本研究对菌株ZF390进行了形态学观察和生理生化测定,值得注意的是菌株ZF390与皮尔瑞俄类芽胞杆菌KCTC 3763T的生理生化测定结果存在些许不同,表现在明胶液化和D-松二糖酵解方面,Heyndrickx等[37]指出了不同的皮尔瑞俄类芽胞杆菌菌株间可能存在不同的明胶液化能力的区别,但 D-松二糖的酵解能力还仍需进一步探究。利用16S rDNA序列和4个看家基因gyrB、rpoD、rho、rpsA构建菌株ZF390多基因联合系统发育树,进行MLST分析,结果表明菌株ZF390与皮尔瑞俄类芽胞杆菌KCTC 3763T的亲缘关系十分接近,结合形态学特征和生理生化特性,鉴定菌株ZF390为皮尔瑞俄类芽胞杆菌。
Messa[38]指出,生防菌株的作用机制不论是从社会和人类健康的角度还是从环境的角度都具有重要的研究意义,随着生物防治市场前景的不断扩大,分离筛选生防菌株并开发安全有效的微生物菌剂亟需进行更加深入的探索。生防菌株的发酵工艺优化是其从实验室培养到规模化生产的第一步,也是最重要的一步。本研究以发酵液的菌体浓度作为评价指标,对其摇瓶发酵培养基组分和发酵条件进行了优化,发酵液菌体浓度由优化前的1.45×105CFU/mL提升至2.94×109CFU/mL,显著提高了4个数量级。本研究中只对菌株ZF390的摇瓶发酵工艺进行了初步的优化,未来大规模发酵的参数调整需要进行大量的试验,目前该菌株的发酵培养基成本较高,可能需要利用底物水解技术结合代谢产物产量和稳定性等多方面综合优化其发酵工艺。目前有关皮尔瑞俄类芽胞杆菌防治植物病害的报道还非常少,在中国大多是关于皮尔瑞俄类芽胞杆菌用于防治真菌病害的报道[39-41],本研究中获得的菌株ZF390能够有效防治细菌病害,在活体植株上对黄瓜细菌性软腐病发挥了良好的防治作用,该菌种资源具备进一步开发成生防制剂的潜力。
