鸡卵泡膜细胞中膜联蛋白A2互作细胞蛋白的筛选及其功能分析
2022-04-21高洪波王燕碧张福平赵采芹唐宏周磊韩一帆段志强
高洪波 王燕碧 张福平 赵采芹 唐宏 周磊 韩一帆 段志强

摘要:【目的】從鸡卵泡膜细胞蛋白中筛选和鉴定与膜联蛋白A2(ANXA2)相互作用的细胞蛋白并进行功能分析,为深入研究ANXA2调控鸡卵泡发育的作用机制提供理论依据。【方法】制备开产后30周龄贵州黄鸡的卵泡膜细胞,提取卵泡膜总蛋白后利用His Pull-Down联合质谱技术(LC-MS/MS)从卵泡膜细胞中筛选出与鸡ANXA2互作的细胞蛋白,然后通过GO数据库和KEEG数据库分别进行GO功能富集分析及KEEG信号通路注释分析,并利用STRING Version 11.0绘制蛋白互作网络图。【结果】通过His Pull-Down联合LC-MS/MS共鉴定获得41个鸡ANXA2互作细胞蛋白,GO功能富集分析发现这些互作细胞蛋白在分子功能、生物学进程和细胞组成均发挥作用。其中,在分子功能方面主要涉及蛋白结合(占58.06%)、催化活性(占19.35%)、核糖体结构(占16.13%)及细胞骨架结构组成(占6.45%),在生物学进程方面主要参与细胞骨架(占19.35%)、刺激反应(占19.35%)、翻译(占16.13%)、代谢过程(占12.90%)、细胞迁移(占12.90%)、蛋白折叠(占9.68%)和蛋白运输(占9.68%),而细胞组分显示以定位于细胞膜的蛋白为主(占32.26%)。鸡ANXA2蛋白互作细胞蛋白参与的KEEG信号通路主要有应激反应、代谢、翻译、信号转导、免疫系统和蛋白定位等。鸡ANXA2互作细胞蛋白互作网络可分为3条,即CNN2-FN1-MYH9-MYH10-ACTN1-CSRP1、ANXA1-ANXA2-ENO1-PRDX4-GPI-ATP5B-PRDX3-HSPA8-TUBB2A和CCT7-CCT4-GNB2L1-ATP5A1-RPS3-RPS3A-RPL23A-RPL22-RPS7;互作细胞蛋白间存在复杂的互作关系,其中又以膜联蛋白A1(ANXA1)与烯醇化酶-1(ENO1)及ANXA2的互作关系最明显。【结论】鸡ANXA2互作细胞蛋白主要参与细胞骨架形成、应对刺激和翻译等生物学过程,涉及应激反应、代谢、翻译、信号转导、免疫及蛋白定位等信号通路。其中,PRDX3、PRDX4、MYH9和TCSC可能通过与ANXA2蛋白相互作用而参与鸡卵巢相关疾病的发生,而ANXA1与ANXA2相互作用可能在鸡卵泡的发育及排卵过程中发挥重要调节作用。
关键词: 鸡;卵泡膜细胞;膜联蛋白A2(ANXA2);互作细胞蛋白;卵泡发育
中图分类号: S831.2 文献标志码: A 文章编号:2095-1191(2022)01-0210-09
Screening and functional analysis of cellular proteins
interacting with annexin A2 in chicken theca cells
GAO Hong-bo, WANG Yan-bi, ZHANG Fu-ping, ZHAO Cai-qin,
TANG Hong, ZHOU Lei, HAN Yi-fan, DUAN Zhi-qiang*
(College of Animal Sciences,Guizhou University/Key Laboratory of Animal Genetics,Breeding and Reproduction
in the Plateau Mountains Region, Ministry of Education/Key Laboratory of Animal Genetics,
Breeding and Reproduction in Guizhou, Guiyang 550025, China)
Abstract:【Objective】The aim of this study was to screen, identify and analyze the functions of cellular proteins interacting with annexin A2 (ANXA2) in chicken theca cells, which provided theoretical basis for further studying the mechanism of ANXA2 regulating chicken follicular development. 【Method】The chicken theca cells of 30-week-old Guizhou yellow laying hens were prepared and then used to extract the total proteins. The chicken ANXA2 recombinant protein His-ANXA2 and His tag protein were used as bait proteins, respectively, to screen the cellular proteins interacting with His-ANXA2 and His by His Pull-Down combined with mass-spectrometric technique (LC-MS/MS) method. The GO function annotation, KEGG signaling pathway and protein-protein interaction network analysis of the identified proteins was performed using the bioinformatics online software. Protein interaction networks were drawn using STRING Version 11.0. 【Result】A total of 41 cellular proteins that interacted with chicken ANXA2 were identified by His Pull-Down combined with LC-MS/MS. GO annotation analysis showed that these interacting cellular proteins played roles in molecular function, biological processes, and cell composition. As for the molecular function analysis, these proteins were involved in protein binding (58.06%), catalytic activity (19.35%), structural consituent of ribosome (16.13%), and structural constitute of cytoskeleton (6.45%). The results of biological processes analysis revealed that these proteins mainly participated in cytoskeleton organization (19.35%), to stimulus response (19.35%), translation (16.13%), metabolic process(12.90%), cell migration (12.90%), protein folding (9.68%), and protein transport (9.68%). However, the distribution of cell membrane (32.26%) was the main localization pattern in cell composition analysis. Meanwhile, KEGG signaling pathway analysis showed that these proteins were related to stress response, metabolism, translation, signal transduction, immune system, and protein localization. The protein-protein interaction networks were divided into three ways, including CNN2-FN1-MYH9-MYH10-ACTN1-CSRP1,ANXA1-ANXA2-ENO1-PRDX4-GPI-ATP5B-PRDX3-HSPA8-TUBB2A,CCT7-CCT4-GNB2L1-ATP5A1-RPS3-RPS3A-RPL23A-RPL22-RPS7, which showed the complex interactions among them. Of which annexin A1 (ANXA1) and enolase -1 (ENO1) had the most obvious interactions with ANXA2. 【Conclusion】The identified cellular proteins interacting with chicken ANXA2 are mainly involved in the biological processes of cytoskeleton formation, response to stimulationand translation, and the signaling pathways of stress response, metabolism, translation, signal transduction, immunity and protein localization. PRDX3, PRDX4, MYH9, and TCSC possibly participate in the occurrence of chicken ovaries related diseases by interacting with ANXA2, while ANXA1 interacting with ANXA2 might regulate the follicular development and ovulation in chickens.
Key words: chicken; theca cells; annexin A2(ANXA2); interacting cellular protein; follicular development
Foundation items: National Natural Science Foundation of China (31960698,31760732,31502074);Joint Project of Local Poultry Industry in Guizhou (Qiancainong〔2020〕175)
0 引言
【研究意义】膜联蛋白(Annexin,ANX)是一类由钙离子调控且具有磷脂结合特性的细胞膜关联蛋白,在不同生物体内高度保守,主要参与细胞膜转运及膜表面一系列依赖于钙离子的膜性生物学活动(He et al.,2020)。由于每个ANX成员均具备高度可变的氨基末端结构域,因此具有独特的生物学功能。膜联蛋白A2(ANXA2)是ANX家族成员之一,其N-末端结构域由纤溶酶原、P11蛋白(S100A10)和纤溶酶原激活物(t-PA)结合位点所组成(Flood and Hajjar,2011)。在卵巢中,细胞外基质(ECM)重塑、卵泡破裂及排卵均由纤溶酶调节(MacDonald et al.,2019),其中t-PA在鸡卵巢卵泡的发育和排卵过程中已得到广泛研究(Wang et al.,1993)。据报道,在卵泡中ANXA2依赖的纤溶酶原激活物可调节纤溶酶的产生(Su et al.,2018),且ANXA2在多种卵巢癌细胞中的表达异常升高(Cardoso et al.,2019)。因此,加强ANXA2研究对揭示卵泡成熟及卵巢癌发生机制具有重要意义。【前人研究进展】ANXA2具有保守的N端结构域和C端结构域,N端序列包括磷酸化位点、乙酰化位点及F-acting结合位点,可调整ANXA2在细胞中的定位,进而调控ANXA2基因发挥不同功能(Chen et al.,2020);C端区域包含F-肌动蛋白、肝素和纤溶酶原结合位点,介导ANXA2与其他蛋白相互作用,且在细胞生命活动及病毒增殖过程中发挥作用(Grindheim et al.,2017)。早期针对ANXA2的研究主要集中在ANXA2与人类疾病的关联性,已证实ANXA2的表达、特性或定位改变可引起心血管疾病、神经内分泌疾病及肿瘤等发生(Cañas et al.,2015)。近年来,越来越多的研究表明ANXA2与病毒的复制和感染存在密切联系。如ANXA2可作为人免疫缺陷病毒I型(Human immunodeficiency virus 1,HIV-1)感染的辅助因子,协助HIV-1进入巨噬细胞(Woodham et al.,2014);人类乳头状瘤病毒(Human papilloma virus,HPV)感染细胞后以钙离子依赖的方式与异源四聚体A2t中的ANXA2相互作用,参与细胞内囊泡和细胞外的相互作用,在病毒内化过程中发挥重要作用(Taylor et al.,2018)。有关ANXA2与动物病毒感染方面,Chen等(2015)研究证实ANXA2与牛流行病病毒(Bovine ephemeral fever virus,BEFV)M蛋白存在相互作用,且这种相互作用有助于促进BEFV病毒的组装与释放;Koga等(2018)研究表明ANXA2与麻疹病毒(Measles virus,MeV)M蛋白相互作用而影响MeV颗粒的细胞外释放。因此,ANXA2可作为病毒感染细胞的受体,或通过与病毒蛋白相互作用而促进病毒的复制。此外,ANXA2在动物生殖方面的作用也逐渐引起人们关注。ANXA2对动物精子的顶体反应、获能及卵母细胞的成熟、受精及卵裂等生理过程均有重要影响(Woodham et al.,2014;Zhu et al.,2015;Ma et al.,2017)。Cui等(2005)研究发现,猪和大鼠的ANXA2基因均随卵母细胞的成熟及早期胚胎的发育呈现高表达,尤其是在减数分裂的分发泡期;陈欣(2015)研究表明,随着卵巢和卵泡的发育成熟,ANXA2 基因在发育卵泡中的表达显著增加,且以F1代卵泡中的表达量最高;Zhu等(2015)研究证实,ANXA2基因在产蛋高的鸡卵巢中呈上调表达。【本研究切入点】卵泡膜细胞是卵泡的重要组成部分,为卵泡发育提供必要的性激素,参与形成血管系统并为卵泡发育提供营养物质,还介导卵母细胞与颗粒细胞间的相互作用,进而调控细胞凋亡及卵泡发育过程(孟金柱等,2020),但至今鲜见针对鸡卵泡膜细胞ANXA2及其互作细胞蛋白的研究报道。【拟解决的关键问题】基于ANXA2可能在鸡卵泡发育过程中发挥重要调控作用,通过制备鸡卵泡膜细胞,利用His Pull-Down联合质谱技术从鸡卵泡膜细胞蛋白中筛选出与ANXA2相互作用的细胞蛋白并进行功能分析,以期为深入研究ANXA2调控鸡卵泡发育的作用机制提供理论依据。
1 材料与方法
1. 1 试验材料
产蛋期的贵州黄鸡由贵州大学种鸡场提供,用于制备鸡卵泡膜细胞。His-ANXA2重组蛋白由高原山地动物遗传育种与繁殖教育部重点实验室制备并保存提供(高洪波等,2020)。His Pur Ni-NTA Magnetic Beads购自ThermoFisher公司;胎牛血清购自Gibco公司;PBS、青霉素、链霉素、RIPA裂解液(弱)、PMSF及EDTA-3Na购自上海碧云天生物技术有限公司;其他试剂均为国产分析纯。
1. 2 试验方法
1. 2. 1 鸡卵泡膜细胞制备 在无菌条件下取开产后30周龄贵州黄鸡的整个卵巢,分离出多个直径大于7 mm的卵泡,以PBS漂洗2次后,剥净血管及结缔组织,将卵泡膜剪碎,置于30 mL离心管中并加入10 mL的0.1%Ⅱ胶原酶与无血清M199培养基,37 ℃恒温水浴锅中消化45 min,采用高压灭菌的200目不锈钢细胞过滤筛过滤,收集滤液,向滤液中加入等体积的完全培养基终止消化,1500 r/min离心5 min,弃上清液,加入适量培养基重悬细胞,置于37 ℃、5% CO2细胞培养箱中培养,根據卵泡细胞中颗粒细胞和膜细胞的贴壁时间差异在第1次培养12 h后更换培养基,之后每24 h更换1次培养基。
1. 2. 2 鸡卵泡膜细胞蛋白提取 培养卵泡膜细胞,弃上清液,加入预冷PBS洗涤细胞3次,将细胞瓶水平置于冰上,加入适量预冷的RIPA裂解液(弱)及PMSF,冰浴15~20 min,使用细胞刮刀将卵泡膜细胞从细胞瓶上刮下,冰浴10 min,转移悬液至离心管中,4 ℃下12000 r/min离心15 min,上清液即为膜蛋白,-80 ℃保存备用。
1. 2. 3 His Pull-Down筛选互作蛋白 向制备好的鸡卵泡膜细胞蛋白中加入50 μL His Pur Ni-NTA Magnetic Beads纯化重组蛋白His-ANXA2和少量PMSF,对照组加入50 μL His Pur Ni-NTA Magnetic Beads纯化的His标签蛋白,试验组和对照组各设3个重复,在4 ℃摇床振荡4 h,将充分反应的样品在4 ℃下12000 r/min瞬时离心,弃上清液,以预冷PBS吹打混匀,4 ℃下12000 r/min瞬时离心,弃上清液,重复3次,加入30 μL Elution Buffer洗脱,-80 ℃保存备用。
1. 2. 4 SDS-PAGE电泳及银染鉴定 取10 μL His Pull-Down样品经SDS-PAGE电泳后,将凝胶转入固定液中固定12 h;乙醇洗涤20 min;蒸馏水清洗2次,每次20 min;AgNO3溶液反应2 min;蒸馏水清洗2次,每次不超过5 min;1% AgNO3溶液反应10 min;蒸馏水清洗1 min;1%对苯二酚溶液显色2 min;EDTA-3Na溶液反应10 min;蒸馏水清洗3 min,银染后拍照,用于判断样品的完整性。
1. 2. 5 质谱分析 取20 μL His Pull-Down样品,加入二硫苏糖醇(DTT)、碘乙酰胺(IAM)和胰蛋白酶,过夜酶解产生的多肽以C18柱进行除盐处理,抽干后用Loading Buffer溶解多肽,多肽上LC-MS/MS仪器进行质谱分析。搜索参数设置如下:(1)样本类型:识别鉴定;(2)消化:胰蛋白酶;(3)Cys烷基化:IAM;(4)仪器:Triple-TOF5600;(5)数据库:Uniprot。
1. 2. 6 生物信息学分析 通过GO数据库(https://www.ebi.ac.uk/QuickGO/)和KEEG数据库(https://david.ncifcrf.gov/home.jsp)分别对筛选获得的ANXA2互作细胞蛋白进行GO功能富集分析及KEEG信号通路注释分析(Kanehisa et al.,2019),并通过STRING Version 11.0(https://string-db.org/)绘制蛋白互作网络图。
2 结果与分析
2. 1 鸡卵泡膜细胞分离培养结果
于显微镜下观察鸡卵泡膜细胞不同阶段的生长特征,结果发现,刚分离时鸡卵泡膜细胞呈大小不一的圆形(图1-A);培养24 h后卵泡膜细胞基本贴壁且部分细胞有伪足伸出(图1-B);培养48 h后卵泡膜细胞生长占细胞瓶的面积80%,其形态呈长梭形(图1-C);卵泡膜细胞生长迅速,培养3 d后基本长满细胞瓶,呈紧密排列状态(图1-D)。
2. 2 SDS-PAGE电泳及银染结果
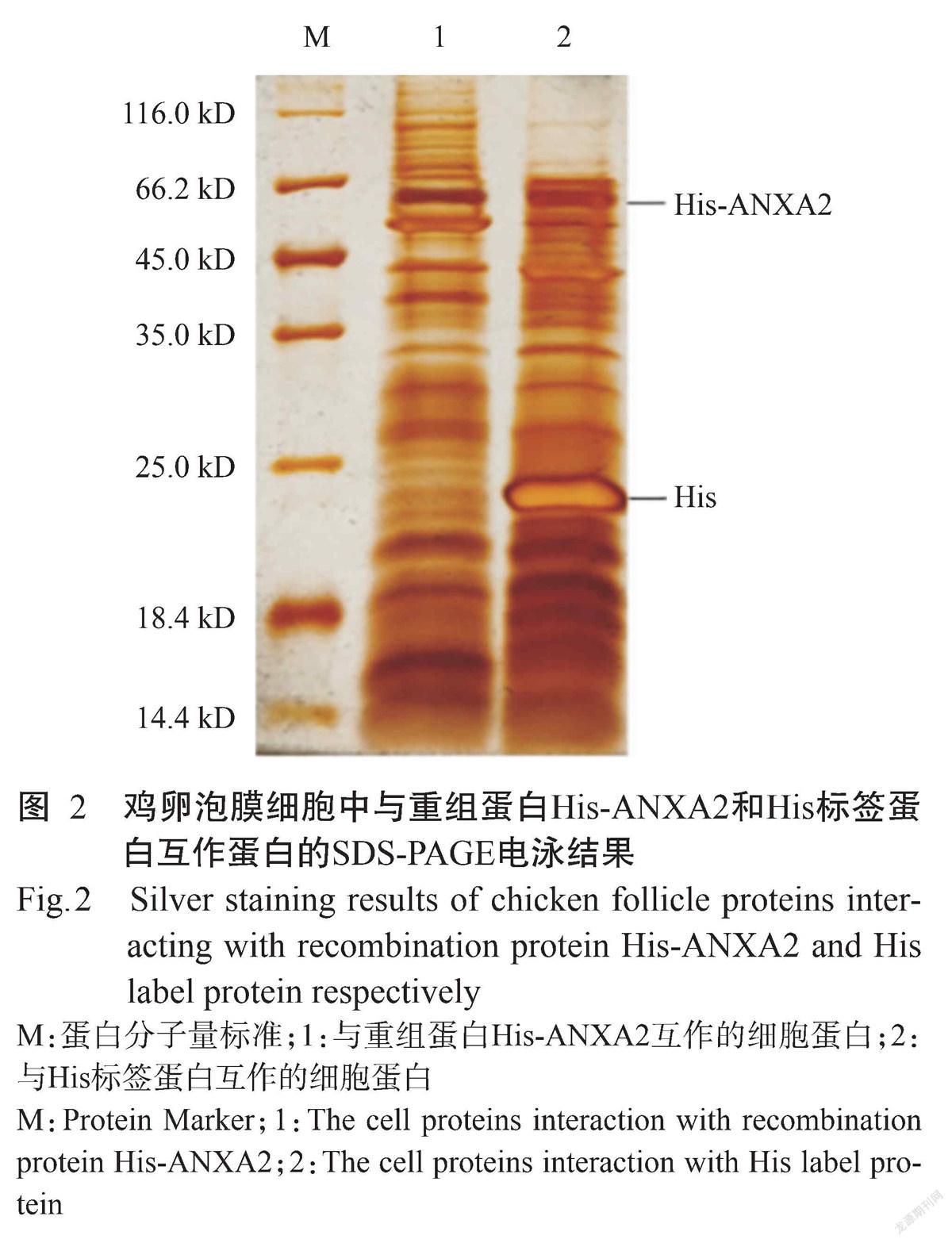
经SDS-PAGE电泳后,将PAGE胶进行银染分析。如图2所示,第1条泳道(重组蛋白His-ANXA2与鸡卵泡膜细胞蛋白互作)和第2条泳道(His标签蛋白与鸡卵泡膜细胞蛋白互作)均明显可见多条蛋白条带,且存在蛋白条带差异,表明鸡卵泡膜细胞蛋白中存在与重组蛋白His-ANXA2和His标签蛋白互作的细胞蛋白,可进行后续的质谱鉴定分析。
2. 3 质谱鉴定分析结果
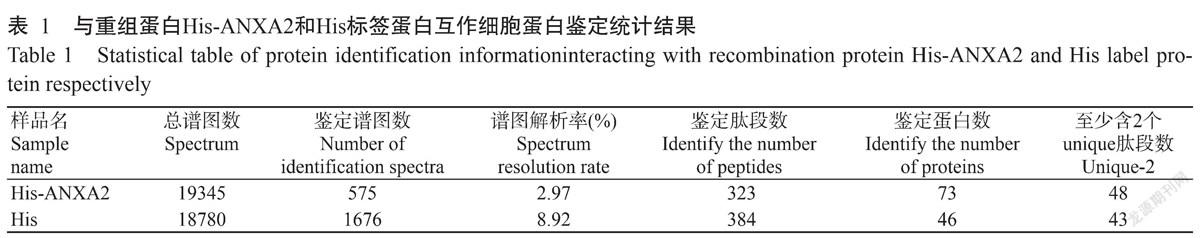
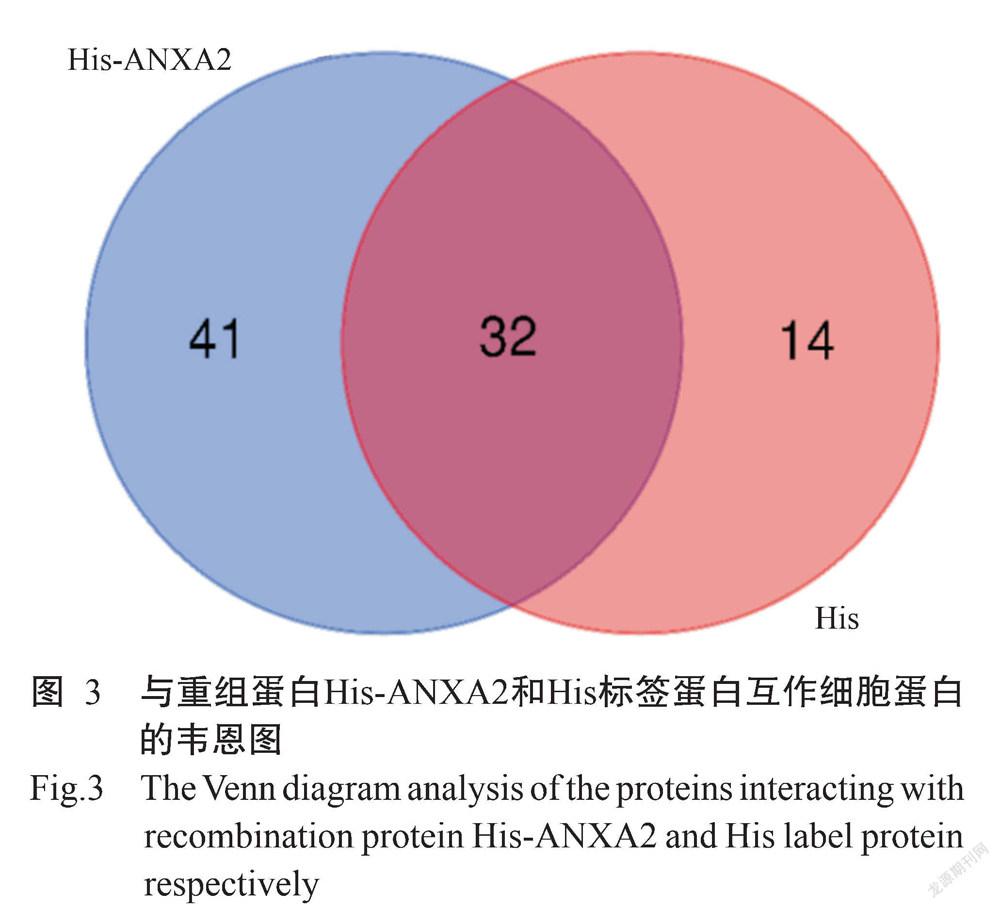
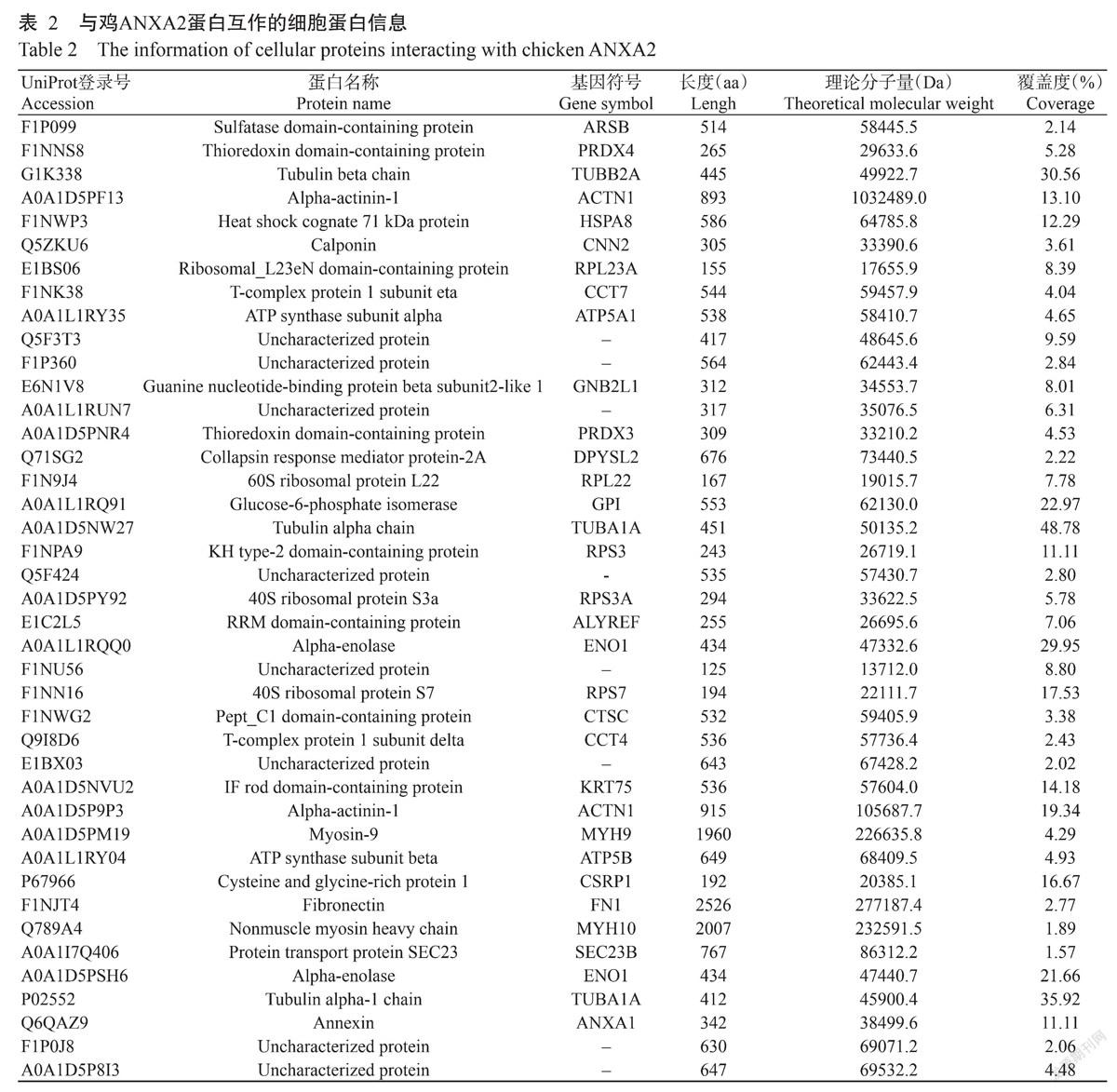
His Pull-Down样品质谱分析获得的二级谱图数分别为19345和18780张,解析的二级谱图数分别为575和1676张,鉴定得到的肽段和蛋白总数如表1所示。共鉴定获得细胞蛋白总数为 87个,其中,与重组蛋白His-ANXA2互作的细胞蛋白有73个,与His标签蛋白互作的细胞蛋白有46个,与重组蛋白His-ANXA2和His标签蛋白均互作的蛋白有32个(图3)。去除His-ANXA2和His共同互作的细胞蛋白,与鸡ANXA2蛋白互作的细胞蛋白有41个(表2)。
2. 4 鸡ANXA2互作细胞蛋白GO功能富集分析结果
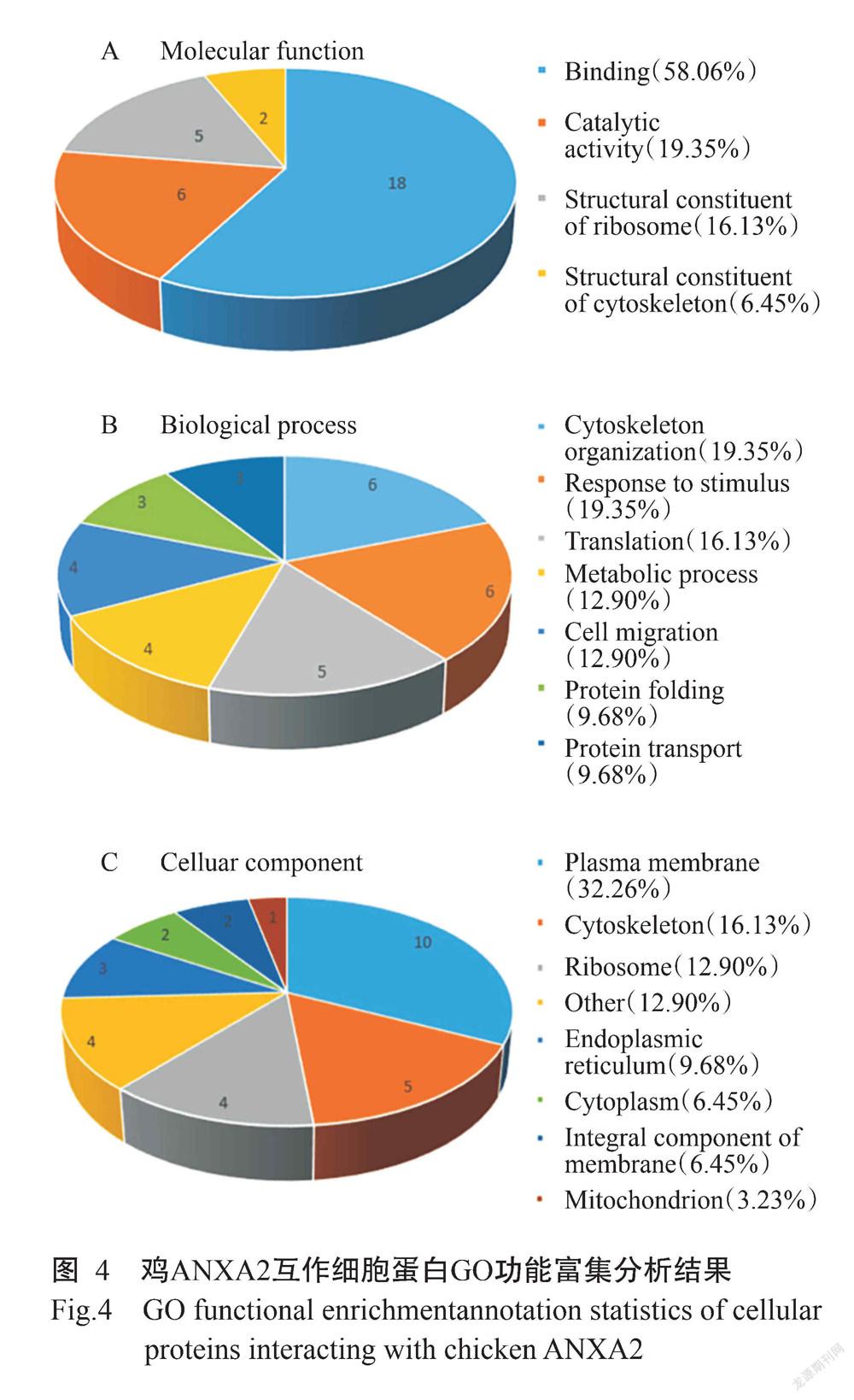
对筛选出的41个鸡ANXA2互作细胞蛋白进行GO功能富集分析,得知这些细胞蛋白在分子功能(Molecular function)、生物学进程(Biological process)和细胞组成(Celluar component)均发挥作用。其中,41个细胞蛋白中有8个为未鉴定蛋白,2个是重复蛋白。与鸡ANXA2蛋白互作的细胞蛋白主要涉及蛋白结合(Binding,58.06%)、催化活性(Catalytic activity,19.35%)、核糖体结构(Structural constituent of ribosome,16.13%)及细胞骨架结构组成(Structu-ral constituent of cytoskeleton,6.45%)等分子功能(图4-A);从生物学进程(图4-B)角度来看,主要参与细胞骨架(Cytoskeleton orgarization,19.35%)、刺激反应(Response to stimulus,19.35%)、翻译(Translation,16.13%)、代谢过程(Metabolic process,12.90%)、细胞迁移(Metabolic process,12.90%)、蛋白折叠(Protein folding,9.68%)和蛋白运输(Protein transport,9.68%);而细胞組分(图4-C)显示以定位于细胞膜(Plasma membrane)的蛋白为主,占32.26%。
2. 5 鸡ANXA2互作细胞蛋白KEGG信号通路注释分析结果
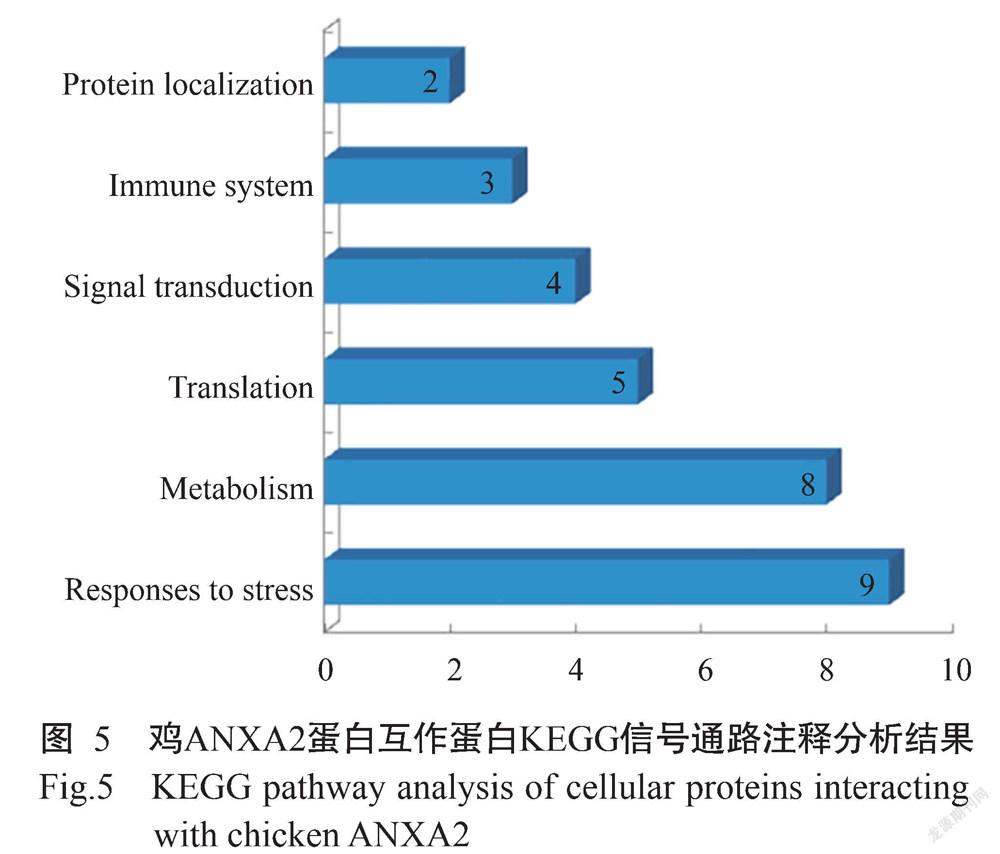
通过KEGG数据库对筛选出的41个鸡ANXA2互作细胞蛋白进行信号通路注释分析,结果(图5)显示,鸡ANXA2互作细胞蛋白参与的信号通路主要有应激反应(Responses to stress)、代谢(Metabolism)、翻译(Translation)、信号转导(Signal transduction)、免疫系统(Immune system)和蛋白定位(Protein localization)等。
2. 6 鸡ANXA2互作细胞蛋白互作网络分析结果
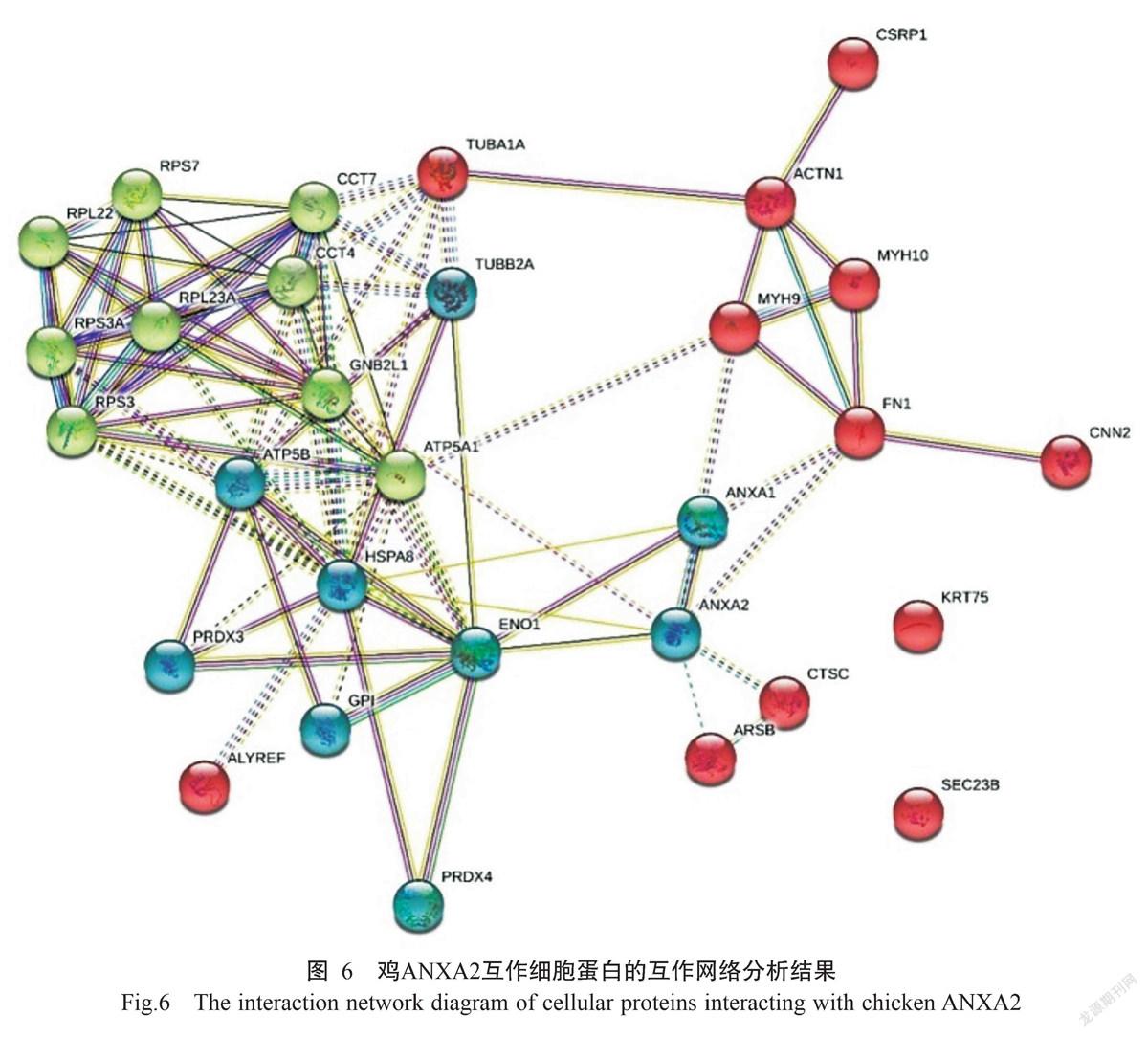
通过STRING Version 11.0绘制鸡ANXA2互作细胞蛋白的互作网络图,结果(图6)显示,鸡ANXA2互作细胞蛋白互作网络可分为3条,包括CNN2-FN1-MYH9-MYH10-ACTN1-CSRP1、ANXA1-ANXA2-ENO1-PRDX4-GPI-ATP5B-PRDX3-HSPA8-TUBB-2A和CCT7-CCT4-GNB2L1-ATP5A1-RPS3-RPS3A-RPL23A-RPL22-RPS7。根据不同方式聚类分析发现,生物学进程主要参与生物运输、翻译、ATP合成及有机物分解等,细胞组成主要由细胞骨架、囊泡、质膜、线粒体、内质网核糖体及细胞器膜等构成,分子功能主要涉及酶活性、蛋白结合、RNA结合、微管结合及阴离子结合等。在以上互作细胞蛋白中,膜联蛋白A1(ANXA1)与烯醇化酶-1(ENO1)及ANXA2相互作用的相关系数最大。
3 讨论
ANX通过与其他细胞蛋白相互作用形成复杂的蛋白复合物而参与多种生物学过程,包括信号转导、细胞凋亡/增殖、细胞骨架重组及肿瘤发生等(Rescher et al.,2020)。ANXA2存在于上皮细胞、单核细胞、巨噬细胞、生殖细胞和肿瘤细胞中,其异常表达参与各种恶性肿瘤的发生发展(Cañas et al.,2015)。已有研究表明,在卵巢癌细胞中,ANXA2功能丧失,β-catenin表达受抑制,从而抑制上皮—间质转化,并减弱癌细胞的增殖和侵袭(Liu et al.,2017);ANXA2在卵巢恶性及交界性肿瘤中呈下调表达或缺失,表达水平与卵巢癌手术病理分期有关,即ANXA2与卵巢癌发生浸润转移密切相关(Cardoso et al.,2019)。此外,在培养的鸡膜细胞中过表达ANXA2可诱导血管生成因子VEGFA及其受体在卵泡膜细胞中上调表达,表明ANXA2参与卵泡血管生成,且有助于卵泡发育和排卵(陈欣,2015)。随着鸡卵巢和卵泡的发育成熟,ANXA2基因呈显著上调表达,排卵后其表达呈显著下调趋势(朱桂玉,2014),故推测ANXA2在促进卵泡血管发育、激发卵母细胞成熟及卵母细胞增殖等过程中发挥重要作用。
为进一步了解鸡ANXA2在调控卵泡发育中的作用机制,本研究分别以鸡ANXA2重组蛋白His-ANXA2和His标签蛋白为诱饵蛋白,利用His Pull-Down联合LC/MS-MS的方法共筛选获得41个鸡ANXA2互作细胞蛋白。经GO功能富集分析及KEGG信号通路注释分析,发现在筛选获得的41个鸡ANXA2互作细胞蛋白中,参与细胞骨架的蛋白有ANXA1、CNN2和TUBA1A,参与胞内物质代谢的蛋白有ATP5A1、ABSB、GPI、RPS3和ALYREF,参与信号转导的蛋白有MYH10、CTSC、RPS7和GNB2L1,与卵巢癌相关的蛋白有PRDX3、PRDX4、MYH9和TCSC。Ahn等(2010)研究证实,CTSC基因在鸡卵巢癌细胞中呈上调表达,表明CTSC在鸡卵巢癌的发生过程中具有潜在的重要作用;Duan等(2013)研究表明,PRDX3基因沉默触发了顺铂介导的卵巢癌细胞凋亡,可能是通过NF-κB信号通路发挥调控作用;Liu等(2019)在多變量模型中发现,MYH9基因过表达是上皮性卵巢癌发生率低的独立预测因子,是上皮性卵巢癌的候选基因之一;Liang等(2020)研究发现,PRDX4通过氧化损伤和内质网应激途径促进Prdx4-/-小鼠卵巢衰老,提示PRDX4是一种保护剂。由此推测PRDX3、PRDX4、MYH9和TCSC与ANXA2蛋白相互作用而参与鸡卵巢相关疾病的发生。
蛋白与蛋白间的互作网络是构成细胞生化反应网络的重要组成部分,对调控细胞及其信号转导具有重要意义。STRING预测结果显示,ANXA1与ENO1及ANXA2的互作关系最明显。ANXA1也是ANX家族中的一员,作为一种钙依赖性磷脂结合蛋白,参与细胞增殖/凋亡及肿瘤的发生发展(Xiao et al.,2017;Xia et al.,2020)。Manai等(2020)研究报道,ANXA1过表达是上皮性卵巢癌总生存期延长的独立预测因子,故推测ANXA1是卵巢癌的早期诊断因子及潜在治疗靶点。ANXA2基因在卵巢癌细胞的增殖、侵袭及EMT生物学行为中发挥正向作用(刘琰,2017)。鉴于ANXA1和ANXA2与卵巢癌发生的密切关系,故推测ANXA1与ANXA2相互作用在鸡卵泡的发育和排卵过程中发挥重要调节作用。计红等(2020)研究发现,干扰ENO1基因表达可使仔鹅卵泡颗粒细胞周期发生G2/M期阻滞,诱导细胞凋亡,进而抑制细胞增殖。Notch信号通路是一种高度进化保守的信号通路,在调控细胞通信和细胞周期方面发挥重要作用(Zhang et al.,2019)。最近的研究表明,C1EIP通过Notch信号通路与ENO1相互作用以调节胚胎干细胞分化的相关基因(Jin et al.,2020)。此外,FGC代谢物可通过阻断ENO1调节而为成纤维细胞的生长和发育创造适宜的微环境(Ji et al.,2020),即ENO1是改善卵泡质量的潜在靶分子。
4 结论
鸡ANXA2互作细胞蛋白主要参与细胞骨架形成、应对刺激和翻译等生物学过程,涉及应激反应、代谢、翻译、信号转导、免疫及蛋白定位等信号通路。其中,PRDX3、PRDX4、MYH9和TCSC可能通过与ANXA2蛋白相互作用而参与鸡卵巢相关疾病的发生,而ANXA1与ANXA2相互作用可能在鸡卵泡的发育及排卵过程中发挥重要调节作用。
參考文献:
陈欣. 2015. 鸡ANXA2基因在卵泡发育中的表达及调控研究[D]. 曲阜:曲阜师范大学. [Chen X. 2015. Expression and regulation of chicken ANXA2 gene in follicular development[D]. Qufu:Qufu Normal University.] doi:10.7666/d.D716604.
高洪波,袁超,周磊,韩一帆,陈佳琪,段志强. 2020. 鸡膜联蛋白A2的原核表达与纯化[J]. 中国家禽,42(8):7-11. [Gao H B,Yuan C,Zhou L,Han Y F,Chen J Q,Duan Z Q. 2020. Prokaryotic expression and purification of chicken annexin A2[J]. China Poultry,42(8):7-11.] doi:10.16372/ j.issn.1004-6364.2020.08.002.
计红,邵子益,薛琳琳,牛春阳,詹雪龙,杨闯,甄莉,杨焕民,李士泽. 2020. α-烯醇化酶基因干扰表达对籽鹅卵泡颗粒细胞增殖及凋亡的影响[J]. 中国应用生理学杂志,36(2):184-188. [Ji H,Shao Z Y,Xue L L,Niu C Y,Zhan X L,Yang C,Zhen L,Yang H M,Li S Z. 2020. Effects of α-enolase gene interference expression on proliferation and apoptosis of follicular granulosa cells from Zi geese[J]. Chinese Journal of Applied Physiology,36(2):184-188.] doi:10.12047/j.cjap.5847.2020.041.
刘琰. 2017. Annexin A2对卵巢癌生物学行为的影响及机制研究[D]. 郑州:郑州大学. [Liu Y. 2017. The effects of mechanism of annexin A2 on biological behavior of ova-rian cancer[D]. Zhengzhou:Zhengzhou University.]
孟金柱,陆雨芳,赵成刚,张羽强,赵园园. 2020. PRSS35在鸡卵泡膜细胞中的表达与卵泡液雌激素含量的关系[J]. 西北农业学报,29(5):653-658. [Meng J Z,Lu Y F,Zhao C G,Zhang Y Q,Zhao Y Y. 2020. Relationship between expression of PRSS35 in chicken follicular membrane cells and estrogen estrogen concentration in follicular fluid[J]. Acta Agriculturae Boreali-occidentalis Sinica,29(5):653-658.] doi:10.7606/j.issn.1004-1389.2020.05.001.
朱桂玉. 2014. 鸡卵巢中ANXA2基因表达调控研究[J]. 山东农业大学学报(自然科学版),45(3):347-351. [Zhu G Y. 2014. The expression and regulation of ANXA2 gene in chicken ovary[J]. Journal of Shandong Agricultural University (Natural Science Edition),45(3):347-351.] doi:10.3969/j.issn.1000-2324.2014.03.005.
Ahn S E,Choi J W,Rengaraj D,Seo H W,Lim W,Han J Y,Song G. 2010. Increased expression of cysteine cathepsins in ovarian tissue from chickens with ovarian cancer[J]. Reproductive Biology and Endocrinology,8:100. doi:10.1186/1477-7827-8-100.
Cañas F,Simonin L,Couturaud F,Renaudineau Y. 2015. Annexin A2 autoantibodies in thrombosis and autoimmune diseases[J]. Thrombosis Research,135(2):226-230. doi:10.1016/j.thromres.2014.11.034.
Cardoso C M,de Jesus S F,de Souza M G,Queiroz L D R P,Santos E M,dos Santos E P,Oliveira L P, Santos C K C,Santos S H S,de Paula A M B,Farias L C,Guimaraes A L S. 2019. High levels of ANXA2 are characteristic of malignant salivary gland tumors[J]. Journal of Oral Patho-logy & Medicine,48(10):929-934. doi:10.1111/jop.129 32.
Chen L H,Li X Y,Wang H M,Hou P L,He H B. 2020. Annexin A2 gene interacting with viral matrix protein to promote bovine ephemeral fever virus release[J]. Journal of Veterinary Science,21(2):e33. doi:10.4142/jvs.2020. 21.e33.
Cui X S,Song H,Kim N H. 2005. Identification of metaphase II-specific gene transcripts in porcine oocytes and their expression in early stage embryos[J]. Reproduction,Fertility,and Development,17(6):625-631. doi:10.1071/rd05019.
Duan J,Lang Y,Song C W,Xiong J,Wang Y,Yan Y. 2013. siRNA targeting of PRDX3 enhances cisplatin-induced apoptosis in ovarian cancer cells through the suppression of the NF-κB signaling pathway[J]. Molecular Medicine Reports,7(5):1688-1694. doi:10.3892/mmr.2013.1370.
Flood E C,Hajjar K A. 2011. The annexin A2 system and vascular homeostasis[J]. Vascular Pharmacology,54(3-6):59-67. doi:10.1016/j.vph.2011.03.003.
Grindheim A K,Saraste J,Vedeler A. 2017. Protein phospho-rylation and its role in the regulation of annexin A2 function[J]. Biochimica et Biophysica Acta. General Subjects,1861(11):2515-2529. doi:10.1016/j.bbagen.2017.08.024.
He X,Liao L,Xie S,Yao M,Xie P,Liu W,Kang Y,Huang L Y,Wang M,Qian L W,Liu Z S,Guan C Y,Guan M,Hua W. 2020. Comprehensive analyses of the annexin (ANN) gene family in Brassica rapa,Brassica oleracea and Brassica napus reveals their roles in stress response[J]. Scientific Reports,10(1):4295. doi:10.1038/s41598-020-59953-w.
Ji H,Guo W J,Niu C Y,Li Y,Lian S,Zhan X L,Guo J R,Zhen L,Yang H M,Li S Z,Wang J F. 2020. Metabono-mics analysis of Zi goose follicular granulosa cells using ENO1 gene expression interference[J]. Journal of Animal Physiology and Animal Nutrition,104(3):838-846. doi:10.1111/jpn.13254.
Jin K,Li D,Jin J,Song J Z,Zhang Y N,Chang G B,Chen G H,Li B C. 2020. C1EIP functions as an activator of ENO1 to promote chicken PGCs formation via inhibition of the notch signaling pathway[J]. Frontiers in Genetics,11:751. doi:10.3389/fgene.2020.00751.
Kanehisa M,Sato Y,Furumichi M,Morishima K,Tanabe M. 2019. New approach for understanding genome variations in KEGG[J]. Nucleic Acids Research,47(D1):D590-D595. doi:10.1093/nar/gky962.
Koga R,Kubota M,Hashiguchi T,Yanagi Y,Ohno S. 2018. Annexin A2 mediates the localization of measles virus matrix protein at the plasma membrane[J]. Journal of Virology,92(10):e00181-18. doi:10.1128/JVI.00181-18.
Liang X R,Yan Z J,Ma W W,Qian Y,Zou X F,Cui Y G,Liu J Y,Meng Y. 2020. Peroxiredoxin 4 protects against ovarian ageing by ameliorating D-galactose-induced oxidative damage in mice[J]. Cell Death & Disease,11(12):1053. doi:10.1038/s41419-020-03253-8.
Liu L Y,Yi J J,Deng X J,Yuan J H,Zhou B X,Lin Z Q,Zeng Z Y. 2019. MYH9 overexpression correlates with clinicopathological parameters and poor prognosis of epithelial ovarian cancer[J]. Oncology Letters,18(2):1049-1056. doi:10.3892/ol.2019.10406.
Liu Y,Li H Y,Ban Z Y,Nai M M,Yang L,Chen Y N,Xu Y M. 2017. Annexin A2 inhibition suppresses ovarian cancer progression via regulating β-catenin/EMT[J]. Oncology Reports,37(6):3643-3650. doi:10.3892/or.2017.5578.
Ma Y,Sun J S,Gu L L,Bao H M,Zhao Y H,Shi L,Yao W,Tian G B,Wang X R,Chen H L. 2017. Annexin A2 (ANXA2) interacts with nonstructural protein 1 and promotes the replication of highly pathogenic H5N1 avian influenza virus[J]. BMC Microbiology,17(1):191. doi:10.1186/s12866-017-1097-0.
MacDonald J A,Takai Y,Ishihara O,Seki H,Woods D C,Tilly J L. 2019. Extracellular matrix signaling activates differentiation of adult ovary-derived oogonial stem cells in a species-specific manner[J]. Fertility and Sterility,111(4):794-805. doi:10.1016/j.fertnstert.2018.12.015.
Manai M,Doghri R,Finetti P,Mrad K,Bouabsa R,Manai M,Birnbaum D,Bertucci F,Charfi L,Driss M. 2020. Overexpression of annexin A1 is an independent predictor of longer overall survival in epithelial ovarian cancer[J]. In Vivo(Athens,Greece),34(1):177-184. doi:10.21873/invivo.11759.
Rescher U,Gerke V, Lim L H K,Jaiswal J K. 2020. Special issue“Recent developments in annexin biology”[J]. Cells,9(11):2477. doi:10.3390/cells9112477.
Su H L,Yang X Q,Wang S F,Shi H Y,Liu X F. 2018. Effect of annexin II-mediated conversion of plasmin from plasminogen on airborne transmission of H9N2 avian influenza virus[J]. Veterinary Microbiology,223:100-106. doi:10.1016/j.vetmic.2018.08.002.
Taylor J R,Fernandez D J,Thornton S M,Skeate J G,Lühen K P,da Silva D M,Langen R,Kast WM. 2018. Heterote-trameric annexin A2/S100A10(A2t) is essential for oncogenic human papillomavirus trafficking and capsid disassembly,and protects virions from lysosomal degradation[J]. Scientific Reports,8:11642. doi:10.1038/s41598-018-30051-2.
Wang L,Croze F,Morley P,Tsang B K. 1993. Granulosa-thecal cell interactions in the regulation of plasminogen activator activity during ovarian follicular development in the hen[J]. Biology of Reproduction,49(5):924-932. doi:10.1095/biolreprod49.5.924.
Woodham A W,Raff A B,Raff L M,da Silva D M,Yan L,Skeate J G,Wong M K,Lin Y G,Kast W M. 2014. Inhibition of langerhans cell maturation by human papillomavirus type 16:A novel role for the annexin A2 heterote-tramer in immune suppression[J]. The Journal of Immunology,192(10):4748-4757. doi:10.4049/jimmunol.130 3190.
Xia W Z,Zhu J,Wang X Y,Tang Y D,Zhou P,Hou M,Li S T. 2020. ANXA1 directs Schwann cells proliferation and migration to accelerate nerve regeneration through the FPR2/AMPK pathway[J]. The FASEB Journal,34(10):13993-14005. doi:10.1096/fj.202000726RRR.
Xiao Y,Ouyang C J,Huang W G,Tang Y L,Fu W T,Cheng A L. 2017. Annexin A1 can inhibit the in vitro invasive ability of nasopharyngeal carcinoma cells possibly through annexin A1/S100A9/Vimentin interaction[J]. PLoS One,12(3):e0174383. doi:10.1371/journal.pone.0174383.
Zhang Y H,Xiang Z,Jia Y J,He X L,Wang L J,Cui W G. 2019. The Notch signaling pathway inhibitor Dapt alle-viates autism-like behavior,autophagy and dendritic spine density abnormalities in a valproic acid-induced animal model of autism[J]. Progress in Neuro-Psychopharmaco-logy and Biological Psychiatry,94:109644. doi:10.1016/j.pnpbp.2019.109644.
Zhu G Y,Chen X,Mao Y,Kang L,Ma X L,Jiang Y L. 2015. Characterization of annexin A2 in chicken follicle develop-ment:Evidence for its involvement in angiogenesis[J]. Animal Reproduction Science,161:104-111. doi:10.1016/j.anireprosci.2015.08.011.
(責任编辑 兰宗宝)
