TUBB3 和ERCC1 基因联合检测在晚期食管癌个性化治疗中的临床价值
2022-04-19吉华琰谢锦华沈预程刘晓岗
吉华琰,谢锦华,沈预程,刘晓岗,王 彧
(南通大学附属海安医院/海安市人民医院肿瘤科,江苏 226600)
食管癌是全球患病率较高的恶性肿瘤,早期患者仅表现为反酸、烧心等不典型症状,常不易察觉,大多数患者确诊时往往处于疾病中晚期,丧失了最佳手术治疗时机,只能选择放化疗为主的综合治疗[1-2]。近年来研究发现,由于患者肿瘤组织中相关基因的表达存在差异,相同分期的患者对同一种药物的疗效不同[3-4]。因此,对晚期肿瘤筛选化疗方案需要适合患者的个体情况,根据患者肿瘤相关基因的表达,制定个性化方案,以提高化疗效果,改善患者的预后及生活质量。
本研究选取2017 年1 月—12 月在南通大学附属海安医院肿瘤科住院的晚期食管癌患者60 例,应用PCR 法检测肿瘤组织中食管癌相关基因β 微管蛋白3(beta-tubulin gene3,TUBB3)和切除修复交叉互补1(excision repair crosscomplementing,ERCC1)mRNA 的表达,探究在晚期食管癌化疗方案选择中的价值。
1 资料与方法
1.1 一般资料 晚期食管癌患者60 例,采用随机数字表法分为标准组和个性化组各30 例。标准组中男性19 例,女性11 例,年龄62.13±4.32 岁;接受放射治疗22 例,无放射治疗8 例;低分化16 例,中高度分化14 例;TNM 分期:Ⅲ期8 例,Ⅳ期22 例;肿瘤部位:颈段1 例,中段18 例,下段11 例;美国东部肿瘤协作组(ECOG)评分:0 分8 例,1 分22 例;ERCC1 mRNA 阳性17 例,阴性13 例;TUBB3 mRNA阳性18 例,阴性12 例;病理分型:鳞状细胞癌27例,腺癌3 例。个性化组中男性21 例,女性9 例,年龄63.07±4.34 岁;接受放射治疗20 例,无放射治疗10 例;低分化18 例,中高度分化12 例;TNM 分期:Ⅲ期13 例,Ⅳ期17 例;肿瘤部位:颈段2 例,中段16 例,下段12 例;ECOG 评分:0 分6 例,1 分24 例;ERCC1 mRNA 阳性15 例,阴性15 例;TUBB3 mRNA 阳性16 例,阴性14 例;病理分型:鳞状细胞癌25 例,腺癌4 例,未分化癌1 例。两组患者一般资料比较,差异均无统计学意义(P>0.05)。纳入标准:(1)经病理确诊为食管癌;(2)经CT、MRI 等影像学检查诊断为晚期不可手术食管癌;(3)TNM 分期Ⅲ~Ⅳ期;(4)预计生存时间≥3 个月。所有患者及家属签署知情同意书。
1.2 化疗方法 标准组:采用PF 方案,顺铂15 mg/m2,5-氟尿嘧啶500 mg/m2,第1~5 天静脉滴注,21 天为一个周期,至少进行4 个周期化疗。个性化组:30 例中癌组织ERCC1 mRNA+、TUBB3 mRNA- 11 例,ERCC1 mRNA-、TUBB3 mRNA+ 12 例,双阴性3例,双阳性4 例。根据基因表达结果决定化疗方案。仅TUBB3 mRNA 阴性患者采用多西他赛化疗,仅ERCC1 mRNA 阴性患者采用顺铂化疗,双阳性患者采用多西他赛或顺铂化疗,双阴性患者采用标准组方案。顺铂15 mg/m2,第1~5 天静脉滴注,21 天为1个周期;多西他赛75 mg/m2,第1 天静脉滴注,21 天为一个周期,至少4 个周期。若治疗期间影像学提示病情进展,即按照标准组的PF 方案化疗,至少6 个周期。
1.3 检测方法 提取患者肿瘤组织RNA,采用PCR法检测TUBB3 和ERCC1 mRNA 的表达。采用一步法提取肿瘤组织中总RNA,反转录成cDNA,进行PCR 扩增,PCR 产物进行电泳分析,紫外灯下摄像。
1.4 疗效评估 采用实体瘤疗效评价标准[5]分为完全缓解(CR),部分缓解(PR),疾病稳定(SD)和疾病进展(PD)。治疗有效率=(CR 例数+PR 例数)/总例数×100%。毒副反应:按世界卫生组织(WHO)分级标准[6]评定,分为1~4 度。总生存期(OS)是指从化疗开始至患者疾病终末死亡的时间,无进展生存期(PFS)是指从化疗开始至首次发现疾病进展的时间。
1.5 统计学处理 运用SPSS 19.0 统计学软件对数据进行分析处理。计量资料以±s 表示,组间比较采用t 检验;计数资料以频数或率表示,组间比较采用χ2检验。采用Kaplan-Meier 方法进行生存分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组近期疗效比较 化疗4 个周期后个性化组CR 4 例(13.3%),PR 14 例(46.7%),SD 9 例(30.0%),PD 3 例(13.3%),治疗有效率60.0%;标准组CR 2例(6.7%),PR 7 例(23.3%),SD 15 例(50.0%),PD 6例(20.0%),有效率30.0%,个性化组治疗有效率高于标准组,差异有统计学意义(χ2=5.455,P=0.020)。
2.2 两组毒副反应比较 两组患者均按计划完成化疗方案,个性化组胃肠道反应和血红蛋白减少发生率分别为73.3%和63.3%,明显低于标准组的100.0%和90.0%,差异均有统计学意义(P<0.05)。两组其他毒副反应发生率比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组患者毒副反应比较 例(%)
2.3 两组PFS 和OS 比较 两组患者随访0~19 个月,随访中位时间为9 个月。个性化组中位PFS 为6个月(95%CI:5.273~6.772),标准组中位PFS 为4 个月(95%CI:3.463~4.682),两组比较差异有统计学意义(χ2=14.325,P=0.000),见图1。个性化组中位OS为13 个月(95%CI:12.275~13.725),标准组中位OS为11 个月(95%CI:9.707~12.293),两组比较差异有统计学意义(χ2=8.099,P=0.000),见图2。
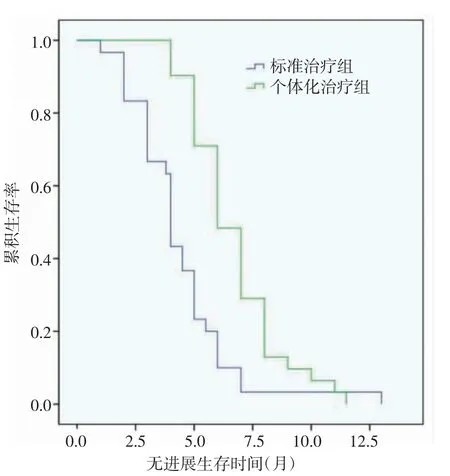
图1 无疾病进展时间曲线
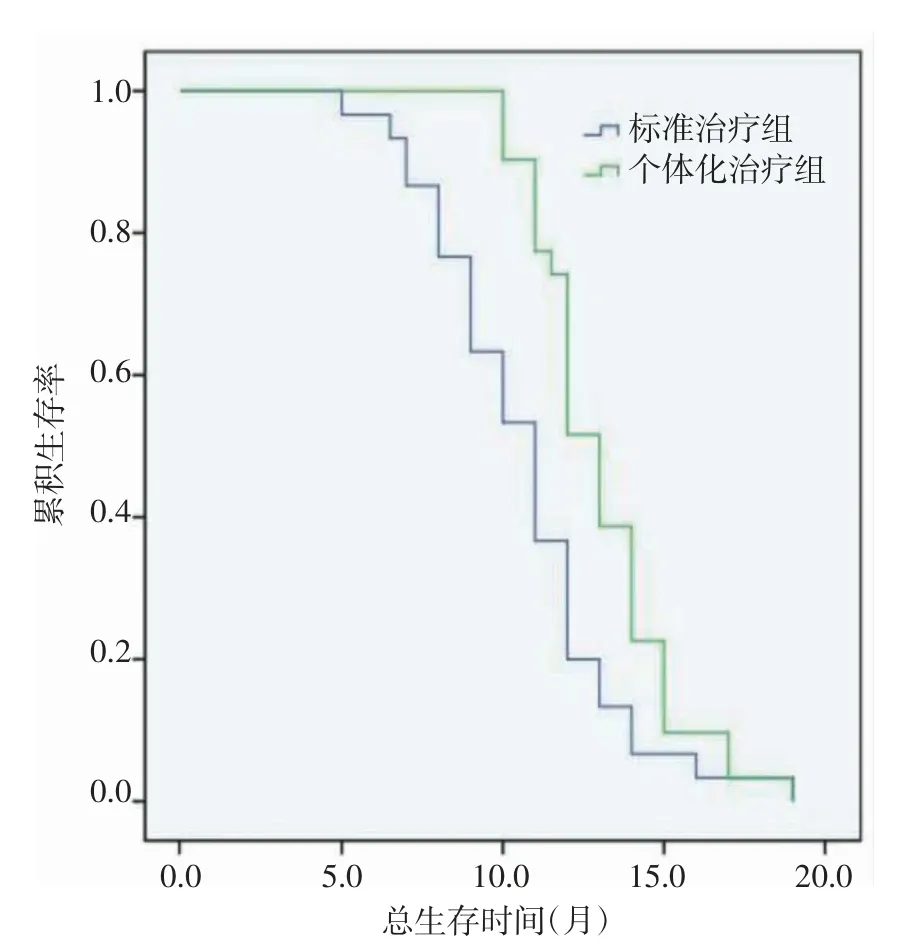
图2 总生存时间曲线
3 讨 论
在我国每年因食管癌死亡人数排在癌性死亡第四位,化疗是晚期食管癌常用的治疗方法,在一定程度上可控制疾病进展、改善患者生存质量,延长生存期[7]。目前对晚期食管癌普遍采用含顺铂的化疗方案,有效率高且较为经济,但并非对每个患者都有效[8]。由于各患者间存在差异,对同一化疗方案的反应不尽相同,因此针对每个个体选择敏感的方案是提高疗效的关键。近年来研究表明,多种肿瘤相关基因共同调节癌细胞对化疗的敏感性[9-11],在卵巢癌、睾丸癌、膀胱移行细胞癌、非小细胞肺癌及宫颈癌中ERCC1 的表达与顺铂耐药密切相关。TUBB3 表达与抗微管类药物的抗肿瘤疗效密切相关[12-14],TUBB3低表达患者对紫杉醇类药物敏感,高表达患者对紫杉醇类较不敏感。
我们前期研究发现ERCC1 和TUBB3 基因联合检测在中晚期食管癌同步放化疗中有一定的临床价值[15],本文研究联合检测ERCC1 和TUBB3 基因在晚期食管癌患者组织中的表达,探讨对患者个体化化疗方案选择的临床价值,以期提高化疗敏感性,并为判断患者的预后提供帮助。本研究个性化组对仅TUBB3 mRNA 阴性患者采用多西他赛化疗,仅ERCC1 mRNA 阴性患者采用顺铂化疗,双阳性患者采用多西他赛或顺铂化疗,双阴性患者采用标准组方案,标准组则一律采用5-Fu 联合DDP 方案化疗。结果显示,个性化组治疗有效率60.0%,显著高于标准组的30.0%,差异有统计学意义(P<0.05),表明根据患者癌组织中癌症相关基因的表达情况制定特定的化疗方案,能提高治疗有效率。同时,个性化组胃肠道反应和血红蛋白减少发生率分别为73.3%和63.3%,明显低于标准组的100.0%和90.0%,差异均有统计学意义(P<0.05),提示敏感的化疗药物可能会减轻毒副反应。此外,个性化组中位OS 和中位PFS 分别为13 个月和6 个月,长于标准组的11 个月和4 个月,差异均有统计学意义(P<0.05),说明个性化治疗可显著改善患者预后,其原因可能是个性化方案不仅提高治疗有效率,同时提高了患者生存质量及对化疗的耐受性。
综上所述,TUBB3 和ERCC1 基因联合检测对食管癌晚期患者选择化疗方案具有指导意义,根据TUBB3 和ERCC1 基因表达结果选择个性化化疗方案,可显著提高疗效,改善患者预后,降低化疗毒副反应发生率。
