沉默信息调节因子2相关酶1通过调控血管内皮生长因子A参与子痫前期的发病机制研究
2022-04-19刘金钰陈超杨星宇程蔚蔚
刘金钰,陈超,杨星宇,程蔚蔚
子痫前期(preeclampsia,PE)是一类以高血压为主要特征的妊娠期特有疾病,常伴有蛋白尿和母体器官功能障碍,其全球发病率约为2%~8%[1]。PE是产妇和围产儿死亡率升高的主要原因,其具体发病机制尚不清楚,基于其临床发病及预后特点,胎盘功能障碍被认为是PE病理进程中的关键因素。在PE中滋养层细胞侵袭相关分子及血管生成分子的表达发生变化,从而导致滋养细胞浸润不足及血管生成受阻,进而导致胎盘功能受损[2]。
沉默信息调节因子2相关酶1(silence information regulator 2 homolog 1,SIRT1)是一种蛋白脱乙酰化酶,在干细胞分化及细胞新陈代谢等多种生理过程中发挥作用,能参与调节细胞的代谢、衰老、增殖、凋亡等功能[3]。已有研究发现SIRT1在胎盘合体滋养层细胞和细胞滋养层细胞中均有表达[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一个家族,包括VEGFA、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子。VEGFA是VEGF家族中最重要、受研究最广泛的成员,是一种高度特异性的促血管内皮细胞生长因子。通常VEGF即指VEGFA。VEGFA可通过增加血管通透性、诱导血管内皮细胞的增殖和迁移、影响病理性血管形成等方式,参与血管生成依赖性疾病的发生发展[5]。
多项研究表明,SIRT1可通过影响VEGF家族功能发挥调节作用。SIRT1可通过影响VEGF的表达调控肿瘤细胞的生长、侵袭、转移等生物学行为[6],SIRT1也可通过抑制VEGF/AKT通路减轻骨关节炎患者软骨退变[7]。另一项研究表明SIRT1可抑制VEGF/Flk-1信号通路,发挥肾脏保护作用[8]。但目前尚无SIRT1与VEGFA在PE中共同作用的报道。本研究拟通过相关实验检测PE孕妇胎盘组织中SIRT1和VEGFA表达变化,从而探讨SIRT1通过影响VEGFA的表达导致PE发生的有关机制,并探索其相关性,进一步为PE的诊断与治疗提供依据。
1 资料与方法
1.1 一般资料
选取2019年7月至2021年3月于上海交通大学医学院附属国际和平妇幼保健院住院分娩的剖宫产PE孕妇24例为PE组,并选取同期健康妊娠的剖宫产孕妇16例为对照组。收集所有研究对象的年龄、分娩孕周、收缩压、舒张压、胎盘重量、新生儿体重及身长等基本情况,并计算体质量指数(body mass index,BMI)。本研究经本院伦理委员会批准通过,所有研究对象均知情同意并签字。
1.2 纳排标准
纳入标准:所有PE孕妇均符合第九版《妇产科学》中PE诊断标准;所有入组孕妇及其家属选择剖宫产分娩。排除标准:通过辅助生殖技术受孕者;孕前患有高血压者;严重的肾病、慢性高血压、自身免疫病、肝病、妊娠期糖尿病、胎盘早剥等其他产科并发症;不良孕产史;多胎妊娠。
1.3 主要试剂
引物由生工生物工程(上海)公司合成;反转录及实时荧光定量PCR试剂盒购自北京全式金生物;免疫组化抗体购自美国Abcam公司;Western blot抗体购自美国Proteintech公司;Trizol试剂、RIPA试剂及BCA蛋白定量试剂盒购自美国Thermo Fisher公司。
1.4 标本采集
所有研究对象胎盘娩出后,10 min内从胎盘母体面近脐带附着区域切取约1 cm×1 cm×1 cm胎盘组织2块,避开出血及钙化灶等部位。采用预冷的无菌PBS溶液漂洗去除血污,并用无菌纱布吸干水分,选取一块装入2 mL冻存管中,-80℃保存备用,另一块经4%多聚甲醛固定后包埋于石蜡中。
1.5 实时荧光定量PCR法检测相关基因mRNA表达
分离胎盘组织并用Trizol法提取组织总RNA,按照反转录试剂盒说明书操作将800 ng的RNA反转为cDNA,以18s rRNA为内参对照,检测SIRT1和VEGFA的mRNA相对表达,基因序列如下页表1所示。实验结果按2-ΔΔCt方法计算并统计分析。
1.6 免疫印迹(Western Blot)检测相关基因蛋白表达
取50 mg组织研磨,加入150 μL蛋白裂解液RIPA匀浆裂解,取上清液,测定蛋白浓度;取蛋白提取液20 μg 加入样品孔中,依次进行电泳、转膜、封闭、一抗孵育过夜、洗膜、二抗孵育1 h、洗膜,最后加入免疫印迹化学发光试剂,用化学发光检测仪检测蛋白表达水平。

表1 基因引物序列
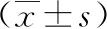
表2 两组孕妇基本临床资料比较
1.7 免疫组化法检测胎盘组织中SIRT1蛋白表达情况
取资料和方法1.4中石蜡包埋的胎盘组织,以4 μm的厚度连续切片,常规脱蜡水化,严格按照Abcam免疫组化试剂盒说明书操作。采用二氨基联苯氨显色液进行显色反应,用苏木素复染并将其在不同梯度乙醇中脱水,中性树胶进行封片,置于显微镜下进行观察,比较两组间SIRT1蛋白表达情况。从每个切片中随机选取10个高倍视野,计算视野中阳性染色细胞数量进行统计。
1.8 统计学分析
2 结果
2.1 两组孕妇基本临床资料比较
与对照组孕妇相比,PE组孕妇在分娩孕周、收缩压、舒张压、24 h尿蛋白水平方面,差异具有统计学意义(P<0.05),两组孕产妇年龄及BMI比较,差异无统计学意义(P>0.05),详见表2;PE组新生儿出生体重、胎盘重量、身长低于对照组,差异均有统计学意义(P<0.05),详见表3。
2.2 两组孕妇胎盘组织SIRT1和VEGFA的表达比较
PE组胎盘组织中SIRT1在mRNA及蛋白表达水平高于对照组,差异有统计学意义(P<0.05),见图1。
对两组胎盘样本石蜡切片中SIRT1染色情况比较,结果显示SIRT1大多数位于滋养细胞细胞核内,少量存在于细胞质中。与对照组孕妇比较,PE组SIRT1蛋白阳性表达率较高,差异有统计学意义(P<0.05),见下页图2。
PE组胎盘组织中VEGFA在mRNA及蛋白表达水平低于对照组,差异有统计学意义(P<0.01),见下页图3。
2.3 相关性分析
相关性分析显示,PE孕妇胎盘组织中SIRT1和VEGFA在mRNA水平的表达呈负相关(r=-0.358,P<0.05),见下页图4。同时,对两组孕产妇胎盘组织中SIRT1和VEGFA在mRNA水平的表达与孕妇及新生儿的一般资料进行相关性分析,发现SIRT1与孕产妇的分娩孕周(r=-0.507,P<0.01)、胎盘重量(r=-0.433,P<0.01)、新生儿出生体重(r=-0.365,P<0.05)及身长(r=-0.448,P<0.01)呈负相关,而VEGFA与孕产妇收缩压水平(r=-0.443,P<0.01)呈负相关,与新生儿出生体重(r=0.359,P<0.05)呈正相关,且差异有统计学意义,详见下页表4。
表3 两组新生儿临床资料比较
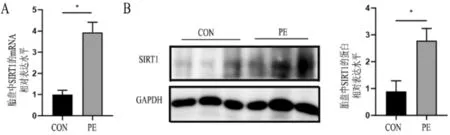
注:A为两组孕妇胎盘组织中SIRT1的mRNA表达水平;B为两组孕妇胎盘组织中SIRT1的蛋白表达水平。CON为对照组(*P<0.05)

注:两组孕妇胎盘组织中SIRT1的表达水平。CON为对照组(*P<0.05,**P<0.01,***P<0.001)

注:A为两组孕妇胎盘组织中VEGFA的mRNA表达水平;B为两组孕妇胎盘组织中VEGFA的蛋白表达水平。CON为对照组(*P<0.05,**P<0.01,***P<0.001)
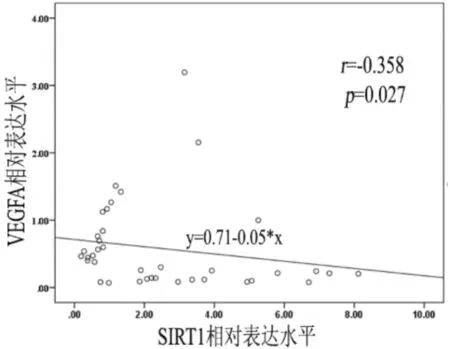
图4 PE胎盘组织SIRT1和VEGFA mRNA相关性分析(*P<0.05)

表4 研究对象一般资料与孕妇胎盘组织SIRT1、VEGFA表达水平的相关性分析
3 讨论
PE是导致母儿高死亡率以及造成母体多器官功能障碍的重要原因。PE患者在产后15年内罹患心血管疾病的概率增加2~7倍[9]。“两阶段论”是目前关于PE病理机制的主流学说,PE发病与胎盘绒毛膜外滋养层细胞浸润不足及炎症因子激活导致的血管内皮损伤与重铸障碍关系密切。密集分支的胎盘血管网络的发育是胎盘形成的关键,胎盘绒毛表面的滋养细胞在气体交换、营养、内分泌和对胎儿的免疫支持等方面起着举足轻重的作用。正常情况下,绒毛外滋养细胞侵入,诱导子宫螺旋动脉重构,使其管径扩张,胎盘血流灌注增加,以适应妊娠期的高血流量需要。而异常的螺旋动脉重塑,胎盘灌注不足和缺氧损伤以及由此导致的可溶性fms样酪氨酸激酶1(soluble fms-like tyrosin kinase-1,sFlt-1)的循环水平升高,被认为是与PE相关的主要病理生理过程之一[10]。
SIRT1可能通过影响滋养层细胞凋亡和胎盘血流灌注,调节母体氧化应激水平,参与PE发生。本研究通过免疫组织化学技术检测了PE孕妇胎盘组织中SIRT1的表达情况,结果显示,SIRT1蛋白主要表达于绒毛滋养细胞中,在绒毛间质细胞中亦有少量表达。与正常妊娠孕妇相比,PE孕妇胎盘组织中SIRT1的mRNA及蛋白表达水平较高。Nakamura K等[11]研究发现,在肝缺血期间,SIRT1的表达增加。缺氧状态下,SIRT1可通过激活AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK),调节自噬通量及炎症小体活化,发挥肾脏保护作用[12]。而肝脏、胰腺和大脑中 SIRT1 的缺失会显著增加活性氧 (ROS) 和炎症反应;SIRT1也可通过减少氧化应激抑制 LPS 诱导的 NLRP3 炎症小体激活。推测SIRT1高表达可能是机体预防组织损伤的自补偿机制。但同时,现有研究发现SIRT1可能会影响妊娠早期滋养细胞侵袭及血管形成。Lee KM等[13]研究表明,siRNA对SIRT1的敲低显著增强了滋养层细胞系Swan71的侵袭和迁移功能,并降低了MMP-2、MMP-9和EMT标志物的表达。SIRT1也能通过阻滞Akt/p38-MAPK信号传导反向调节自噬,降低HUVEC的增殖能力,使得其细胞毒性增加以及Fas表达增加。抑制 SIRT1 活性会降低 NDRG1 在滋养层细胞中的表达,而NDRG1表达增加可通过 PI3K/AKT 通路抑制人胎盘细胞中的血管生成,使滋养层细胞损伤加重[14]。SIRT1表达异常可能是导致PE患者滋养层侵袭不足及血管重铸障碍的重要原因。胎盘缺氧、缺血状态下,血管内皮组织损伤,导致PE和胎儿生长发育迟缓[15]。
本研究中,PE孕妇胎盘组织中VEGFA表达水平显著降低。VEGFA是对内皮细胞有特异性的生长因子,主要表达于血管内皮细胞中,参与血管形成。sFlt-1是VEGFA的受体,能够阻断VEGFA的生物活性,研究发现,在PE胎盘绒毛组织中,VEGFA/sFlt-1比值下降70%[16]。sFlt-1升高抑制了胎盘血管生成,VEGFA的低表达可抑制胎盘滋养细胞的分化、增殖,导致胎盘微血管形成减少,出现促/抗血管生成因子失衡。同时,sFlt-1可作为阻滞剂与母血中游离的VEGF结合,导致胎盘绒毛浸润能力下降,新生血管生成速度降低,进而导致母体血管内皮功能损伤,诱发或加重PE样症状。
本研究发现:孕妇胎盘中的SIRT1与VEGFA的表达水平呈负相关。且SIRT1与孕产妇的分娩孕周、胎盘重量、新生儿出生体重及身长呈负相关,而VEGFA与孕产妇收缩压水平呈负相关,与新生儿出生体重呈正相关。推测SIRT1可能通过抑制VEGFA表达影响滋养层血管生成,诱导内皮功能障碍,参与PE的发生发展。已有研究显示,SIRT1过表达强烈抑制视网膜微血管内皮细胞增殖和血管生成,而Yes相关蛋白(Yes-associated protein,YAP)可以通过HIF-1α上调VEGFA,SIRT1对血管生成的抑制作用受YAP/HIF1α/VEGFA表达轴拮抗[17]。大鼠脑微血管内皮细胞的血管新生调控可能是通过SIRT1-HIF-1α-VEGFA信号转导通路来完成的[18]。而SIRT1可通过抑制Wnt/β-catenin信号通路下调VEGFA表达,进而抑制内皮细胞增殖和血管新生[19]。
综上,我们发现,PE 孕妇胎盘组织中的SIRT1表达较高,VEGFA表达较低,二者具有显著负相关性,SIRT1可能通过负调控VEGFA表达,参与PE的发病机制。
