绵羊KCNH1基因的生物信息学分析
2022-04-18张小雪赵利明刘佳杨晓斌李冲
张小雪 赵利明 刘佳 杨晓斌 李冲



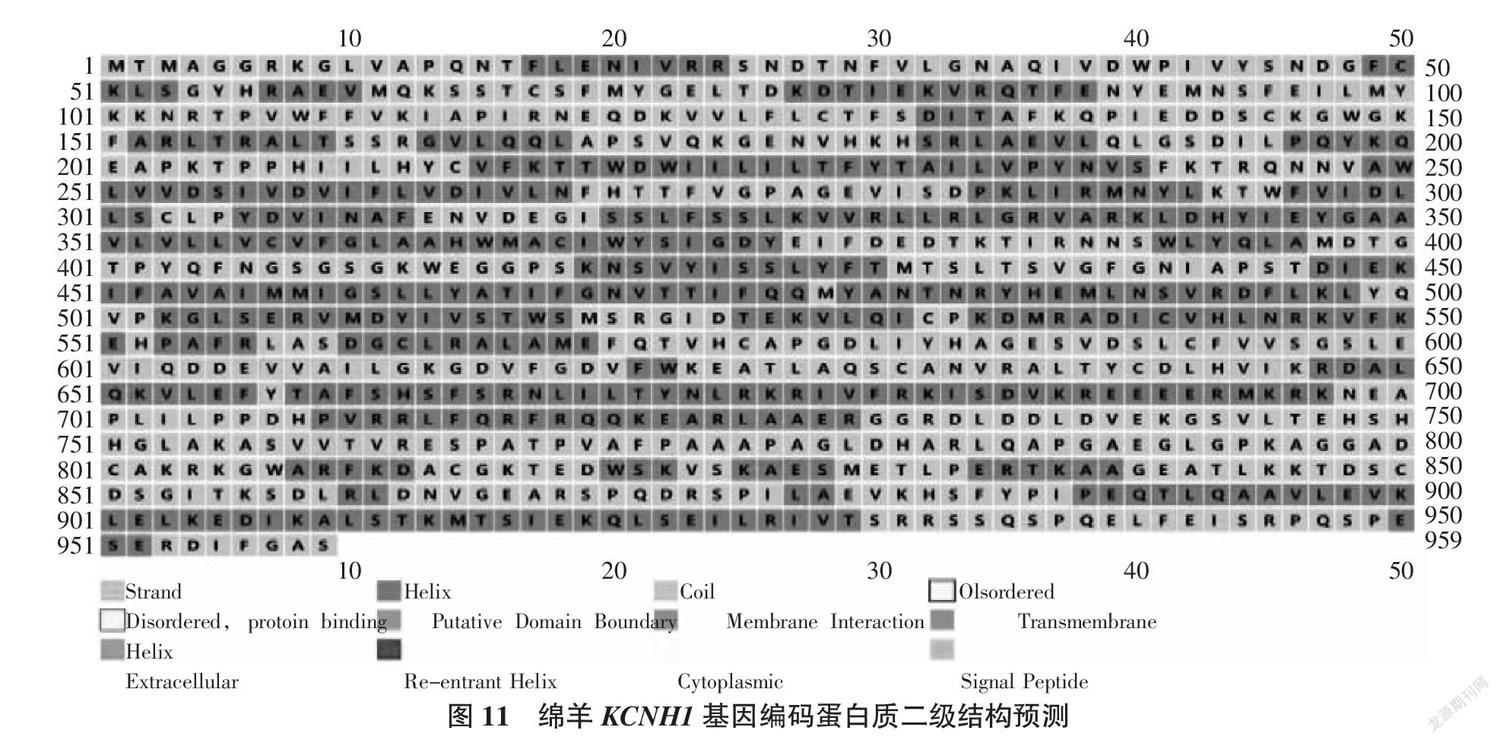
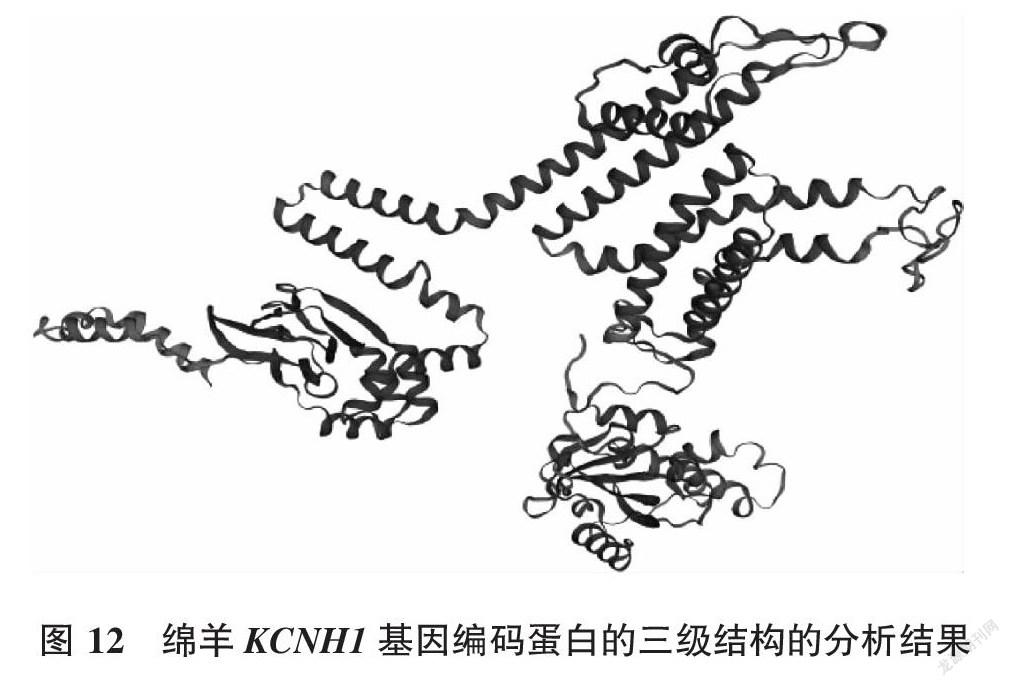


摘要:以绵羊钾电压门控通道H亚家族成员1(potassium voltage-gated channel subfamily H member 1,KCNH1)基因为研究对象,利用生物信息学数据库及其相关软件,对其进行生物信息学分析,以初步了解其结构和生物学功能。结果表明,绵羊KCNH1基因所含最大长度序列为2 961 bp,且编码986个氨基酸残基。KCNH1基因编码的蛋白质分子式为C4972H7816N1342O1447S40,其蛋白分子质量为110 827.28 KDa,理论等电点(pI)为7.52。亚细胞定位结果表明其编码产物主要可能定位于质膜(43.5%),其次为内质网 (34.8%),属于非分泌蛋白。KCNH1蛋白质中不存在信号肽序列,但存在5段跨膜结构区域,该蛋白的二级结构以α螺旋为主,三级结构主要由α螺旋盘曲缠绕的方式形成。
关键词:绵羊;KCNH1基因;生物信息学分析
中图分类号:S826 文献标志码:A 文章编号:1001-1463(2022)03-0039-07
doi:10.3969/j.issn.1001-1463.2022.03.009
Bioinformatics Analysis of Sheep KCNH1 Gene
ZHANG Xiaoxue, ZHAO Liming, LIU Jia, YANG Xiaobin, LI Chong
(College of Animal Science and Technology, Gansu Agricultural University, Lanzhou Gansu 730070, China)
Abstract:In this study, the potassium voltage-gated channel subfamily H member 1(KCNH1) gene of sheep was taken as the research object, and bioinformatics analysis was conducted using bioinformatics software to analyze sheep KCNH1 gene for understand its structure and predict its function. The results suggested that the maximum length sequence of sheep KCNH1 gene was 2 961 bp and encoded 986 amino acid residues. The molecular formula of the protein encoded by KCNH1 gene was C4972H7816N1342O1447S40, the molecular weight of the protein was 110 827.28 kDa, and the th-eoretical isoelectric point(pI) was 7.52. The results of subcellular localization showed that the coding products were mainly located in the plasma membrane(43.5%), followed by the endoplasmic reticulum(34.8%), which were non-secreted proteins. There is no signal peptide sequence in KCNH1 protein, but there are five transmembrane structure regions. The secondary structure of KCNH1 protein is dominated by α-helix, and the tertiary structure is mainly formed by the winding of α-helix.
Key words:Sheep;KCNH1 gene;Bioinformatics analysis
電压门控钾通道(Kv10.1钾通道),又称为ethera-go-go相关基因1,由KCNH1(钾电压门控通道),H亚家族成员1编码[1 ],其主要分布于中枢神经系统和癌细胞中。KCNH1通道包含1个N端PAS结构域、1个c端环核苷酸结合同源结构域(cNBHD),以及钙调素的N端和c端结合位点[2 ],且KCNH1通道受到包括活性氧在内的多种内源信号的调节[3 ]。目前有关于KCNH1基因的研究大多见于人类,如基因KCNH1突变与综合征性神经发育障碍相关,且支持S4结构域的功能重要性[1 ];KCNH1突变导致ZLS(指一种发育障碍,其特征是面部畸形,且伴有牙龈增大、智力残疾、指甲和终末趾骨发育不全或发育不全以及多毛症)[4 ];H亚家族(eagrelated),成员1 (KCNH1)钾通道是潜在的肿瘤标志物和癌症治疗靶点,被雌激素和人乳头状瘤病毒(HPV)致癌基因上调[5 ];人类冠状动脉扩张被认为与钾电压门控通道亚家族成员1 KCNH1(编码醚à go-go,EAG1或KV10.1蛋白)的基因变异有关[6 ];发育性和癫痫性脑病合并智力残疾(DEE)和遗传性广泛性癫痫(GGE)都存在着新的KCNH1突变[7 ];KCNH1通道对肿瘤发展和治疗有重大意义[8 ]等,而有关绵羊KCNH1基因的结构和功能研究较少,其生物学作用尚不清楚。
我们基于绵羊生物基因组数据库检索到的KCNH1基因序列,利用生物信息学方法,对绵羊KCNH1基因及其编码产物的理化性质、序列特征、蛋白质结构以及生物学功能进行了预测和分析,以期为进一步探索KCNH1基因及其编码蛋白基本结构和生物学功能提供线索。
1 材料与方法
1.1 序列来源
研究所用10个物种(绵羊、狗、水牛、鹿、猫、羊驼、兔、灰鼠、猪、人)的mRNA序列均来源于NCBI网站的GenBank数据库。其物种名称及GenBank登录号见表1。
1.2 方法
KCNH1基因的开放阅读框(Open reading frame,ORF)利用ORF Finder程序分析,采用Bioedit及ExPASy分析软件预测其基因编码产物的理化性质。亚细胞定位利用PSORT Ⅱ 预测[9 ]。采用Signalp 3.0软件预测蛋白潜在信号肽剪切位点。跨膜螺旋区域及蛋白保守结构域分析采用TMHMM程序和Smart软件完成。蛋白亲疏水性及其二级结构利用Prot Scale和Jpred分析预测。蛋白三级结构多序列比对及同源性分析利用Swiss-model和DNAMAN软件分析[10 - 12 ]。
2 结果与分析
2.1 绵羊KCNH1基因开放阅读框分析
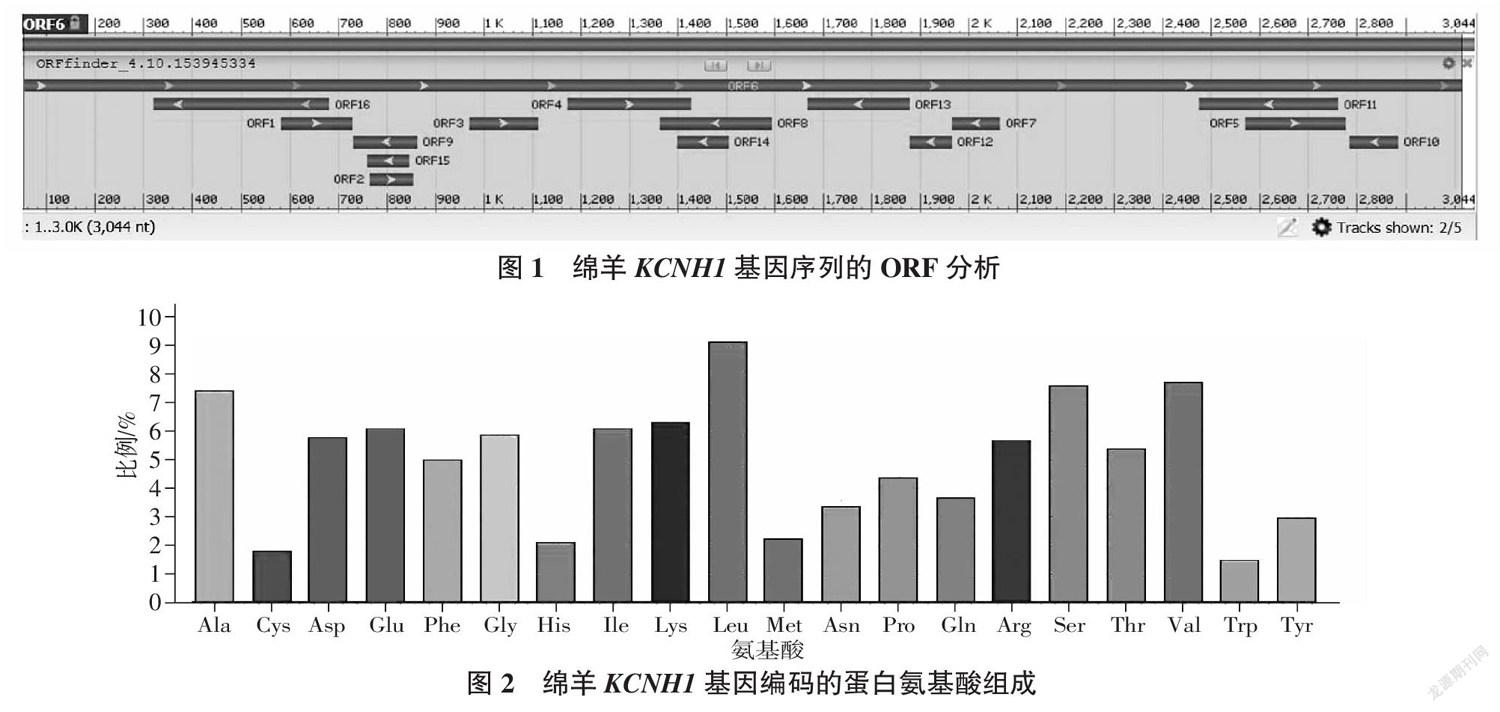
由 NCBI的开放阅读框查找器程序分析(图1)可知,绵羊KCNH1基因序列的ORF序列长度为2 961 bp,起始密碼子为ATG,共编码986个氨基酸。
2.2 绵羊KCNH1编码产物的理化性质分析
蛋白质的基本性质包括相对分子质量、氨基酸组成、等电点(pI)、半衰期、不稳定系数和总平均亲水性等[13 ]。通过Bioedit及ExPASy软件分析可知,绵羊的KCNH1基因共编码986个氨基酸,分子式为C4972H7816N1342O1447S40,分子质量为110 827.28 KDa,理论等电点pI为7.52。氨基酸组成如图2所示,其中Leu(亮氨酸)含量最多,所占比例为9.1%;Trp(色氨酸)含量最少,所占比例1.5%。负电荷残基总数(Asp+Glu)为117,正电荷残基总数(Arg+Lys)为118。基因编码产物半衰期为30 h,不稳定指数为45.07,确定绵羊KCNH1基因编码产物属于不稳定蛋白。
2.3 绵羊KCNH1编码产物的同源性比对及系统发育分析
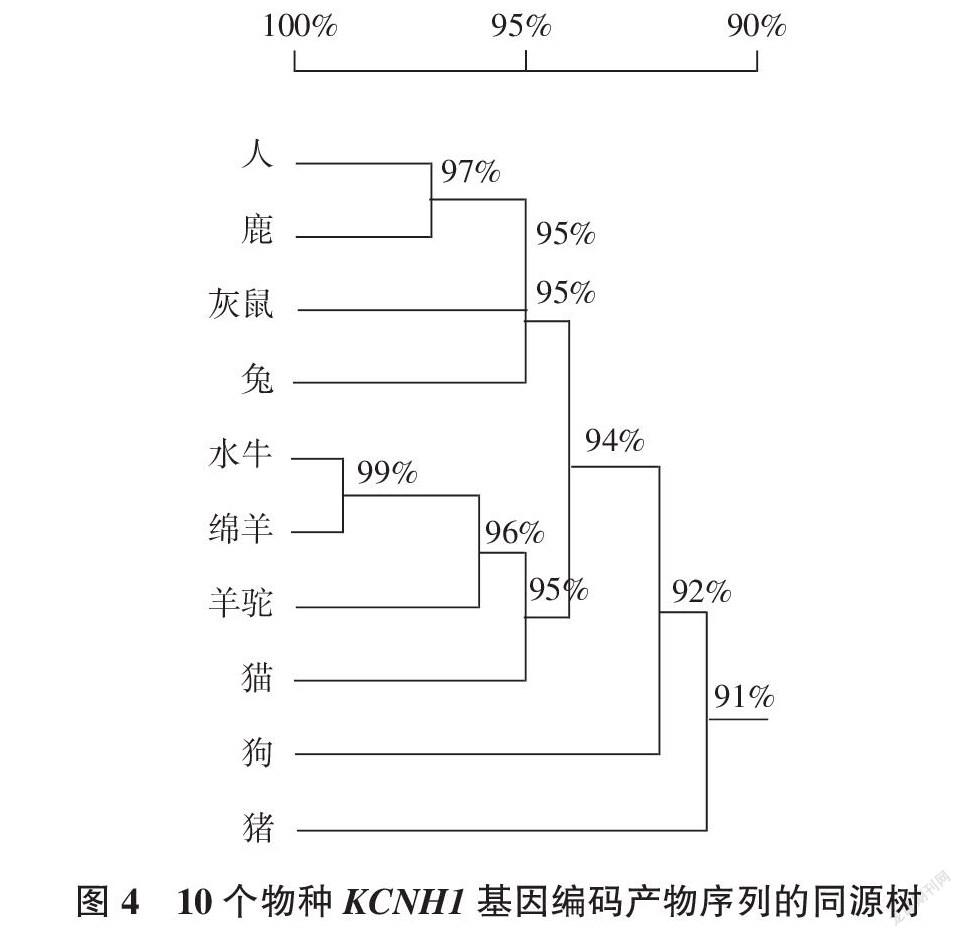
采用DNAMAN对绵羊、狗、水牛、鹿、猫、羊驼、兔、灰鼠、猪和人的KCNH1蛋白的多序列比对(图3)表明,KCNH1基因在这10个物种中都有表达,且绵羊与水牛的KCNH1氨基酸序列同源性较为相似,说明它们在进化过程亲缘关系较近。从KCNH1基因编码产物序列的同源树得出,在分析中选取的10个物种中,绵羊和水牛的同源性最高,可达99%(图4)。
2.4 绵羊KCNH1蛋白亚细胞定位
利用PSORTⅡ软件对绵羊KCNH1基因编码蛋白进行亚细胞定位的结果(表2)表明,绵羊KCNH1蛋白有43.5%的可能分布于质膜,有34.8%的可能分布于内质网, 有13.0%的可能分布于线粒体, 有4.3%的可能分布于囊泡分泌系统, 且有4.3%的可能分布于细胞核。由此预测,绵羊KCNH1基因最有可能定位于质膜中发挥生物学作用,其次在内质网中发挥生物学作用。
2.5 绵羊KCNH1蛋白潜在信号肽剪切位点预测
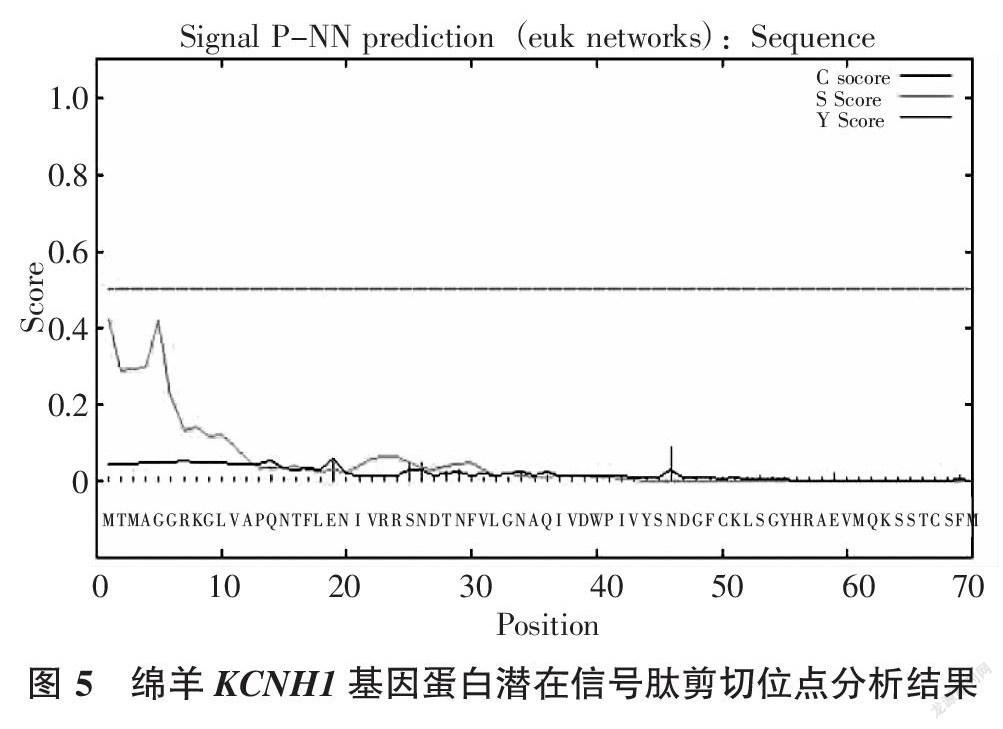
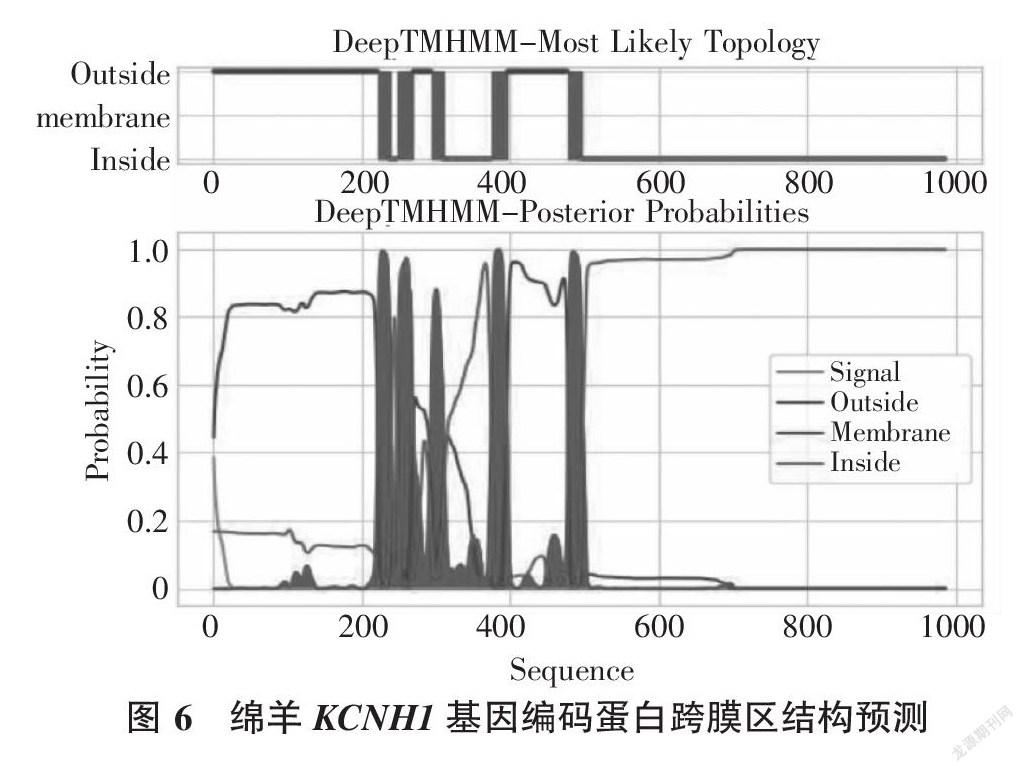
信号肽序列是指存在于分泌蛋白基因编码序列中、在起始密码子之后的一段富含疏水氨基酸多肽,能够指导蛋白质定位的序列。通过检测绵羊KCNH1蛋白潜在信号肽的存在情况可知该基因编的产物是否是分泌蛋白和跨膜蛋白的基本信息。用Signalp 3.0软件分析得出,绵羊KCNH1基因的编码产物最大C值为0.088,位于第46个氨基酸位点上;最大Y值为0.056,位于第19个氨基酸位点上;最大S值为0.422,位于第1个氨基酸位点上(图5)。用PSORTⅡ软件分析得到,绵羊KCNH1蛋白是跨膜蛋白,不存在信号肽(图6)。
2.6 绵羊KCNH1蛋白跨膜螺旋结构预测
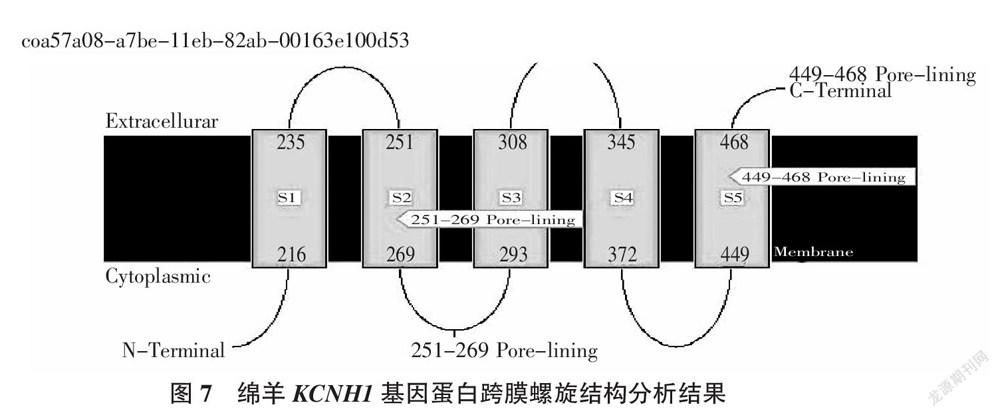
从TMHMM软件分析的结果(图7、图8)可知,KCNH1基因编码的蛋白质不存在信号肽,该蛋白是跨膜蛋白,蛋白链的N端位于膜内,C端位于膜外。共有5段跨膜区域,分别是216~235、251~269、293~308、345~372和449~468。
2.7 绵羊KCNH1蛋白保守结构域分析
通过Smart软件分析(表3)可知,绵羊KCNH1有8段保守结构域,分别是PAS(16~92)、PAC(94~ 136)、Pfam:lon_trans(217~483)、Pfam:lon_ trans2 (397~477)、cNMP (554~672)、low complexity (687~ 699)、low complexity (765~777)和coiled coil (898~926)(图9)。
2.8 绵羊KCNH1蛋白亲疏水性分析
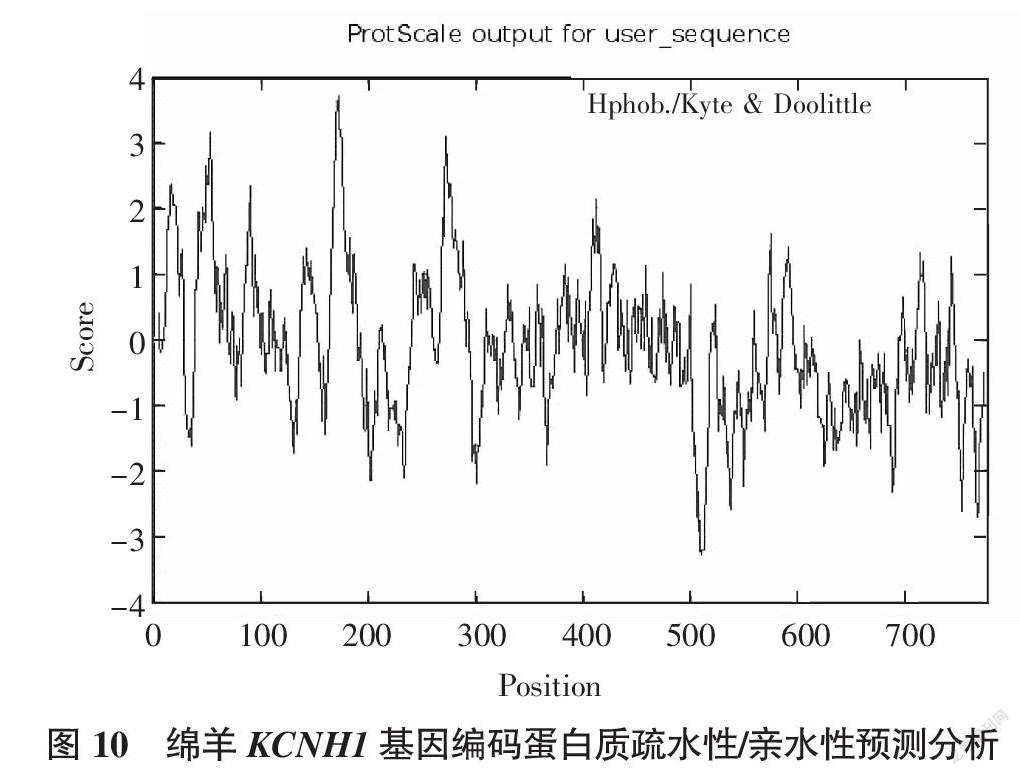
采用Prot Scale软件分析绵羊KCNH1蛋白亲疏水性可知,该基因编码蛋白疏水性最大疏水值为3.722,位于第382位氨基酸位点上;最小疏水值为-3.278,位于第719位氨基酸位点上。由此确认该基因编码的蛋白属于疏水蛋白(图10)。
2.9 绵羊KCNH1蛋白二级结构的预测
蛋白质的二级结构 (secondary structure)是指多肽主链骨架原子沿一定的轴盘旋或折叠而形成的特定的局部构象,不涉及氨基酸残基侧链的空间分布。蛋白质二级结构的主要形式有α螺旋、β折叠、β转角和无规卷曲[14 ]。通过Jpred软件分析得出,组成绵羊KCNH1蛋白二级结构有α螺旋(42.96%)、无规则卷曲(41.50%)、延伸链(12.20%)和β转角(3.34%),分别有412、398、117和32段,由此推断绵羊KCNH1蛋白二级结构主要为α螺旋,其次为无规则卷曲(图11)。
2.10 绵羊KCNH1蛋白三级结构预测与分析
三级结构( tertiary structure)是指多肽链在二级结构基础上的进一步卷曲折叠,通过借助次级键维系而形成的特定的三维构象。由Swiss-model软件分析可知(图12),绵羊KCNH1基因蛋白三级结构中无配基,且为单体蛋白。其中与它同源性最高的蛋白质是5k7l.1,且待测蛋白与模板蛋白的匹配度为-2.87。由图12可知,同源率为95.64%,且KCNH1基因编码蛋白的三级结构主要由α螺旋盘曲折叠形成。
3 结论
绵羊KCNH1基因的ORF长度为2 961 bp,编码986个氨基酸残基;亮氨酸所占比例最多,为9.1%;色氨酸所占比例最少,为1.5%;目的基因蛋白质的分子质量为110 827.28 KDa,理论等电点(pI)为7.52。KCNH1基因编码的产物为不稳定性蛋白。亚细胞定位的结果显示其在质膜中的可能性最大,为43.5%。KCNH1基因编的码产物在多种物种中氨基酸序列相似程度极高,且绵羊与水牛在系统发育树中距离最近。KCNH1基因的编码产物中不存在信号肽,为非分泌性蛋白,且发现了跨膜区,故该蛋白是跨膜蛋白。该基因编码的蛋白有5段跨膜结构。KCNH1编码的蛋白为疏水蛋白。绵羊KCNH1基因编码产物的二级结构主要以α螺旋为主,三级结构主要由α螺旋盘曲折叠形成。
参考文献:
[1] FUKAI R,SAITSU H,TSURUSAKI Y,et al. De novo KCNH1 mutations in four patients with syndromic developmental delay,hypotonia and seizures[J]. Journal of Human Genetics,2016,1:381-387.
[2] SAHOO N,SCHNHERR R,HOSHI T,et al. Cysteines control the N- and C-linker-dependent gating of KCNH1 potassium channels[J]. Biochimica Et Biophysica Acta,2012,1818(5):1187-1195.
[3] BO H,TOKAY T,ZHANG G,et al. Eag1 K + Channel:endogenous regulation and functions in nervous system[J]. Oxidative Medicine & Cellular Longevity,2017,
2017(2):7371010.
[4] KORT?譈M,FANNY,CAPUTO V,et al. Mutations in KCNH1 and ATP6V1B2 cause Zimmermann-Laband syndrome[J]. Nature Genetics,2015,47(6):661-667.
[5] RAMIREZ A,HINOJOSA L M,GONZALES J,et al. KCNH1 potassium channels are expressed in cervical cytologies from pregnant patients and are regulated by progesterone[J]. Reproduction,2013,146(6):615-623.
[6] NOORI M R,ZHANG B,PAN L. Is KCNH1 mutation related to coronary artery ectasia[J]. BMC Cardiovascular Disorders,2019,19(1):1-2.
[7] WREDE R V,JEUB M,ARIZ I,et al. Novel kcnh1 mutations associated with epilepsy: broadening the phenotypic spectrum of kcnh1-associated diseases[J]. Genes,2021,12(2):7-9.
[8] 王玉琴,田志龍,施会彬,等. 湖羊肌肉营养特点及肌纤维组织学特性[J]. 动物营养学报,2017,29(8):2867-2874.
[9] NAKAI K,HORTON P. PSORT:a program for detecting sorting signals in proteins and predicting their subcellular localization[J]. Trends in Biochemical Sciences, 1999,24(1):34-36.
[10] 张小雪,潘香羽,李发弟,等. 绵羊ESR基因生物信息学分析[J]. 甘肃农业科技,2014(9):30-33.
[11] 宋雅萍,李彦霞,郭文婧,等. 绵羊GP5基因的生物信息学分析[J]. 甘肃农业科技,2020(10):54-59
[12] 靳泽希,冯 芬,邓晓银,等. 绵羊NRCAM基因的生物信息学分析[J]. 甘肃农业科技,2020(12):19-24.
[13] 袁 媛,黄璐琦. 中药资源转录组分析操作指南[M]. 上海:上海科学技术出版社,2016.
[14] 孔繁良. 基于二级结构的蛋白质三级结构预测[D]. 济南:济南大学,2016.
收稿日期:2022 - 02 - 18
基金项目:国家畜禽良种联合攻关计划项目(19210365);甘肃农业大学伏羲青年英才培养计划项目(Gaufx-03Y11)。
作者简介:张小雪(1984 — ),女,湖北武汉人,副教授,主要从事动物遗传育种与繁殖研究及教学工作。联系电话:(0931)7631225。Email:zhangxx@gsau.edu.cn。
通信作者:李 冲(1986 — ),男,甘肃崇信人,副教授,博士,主要从事动物营养与饲料科学研究及教学工作。联系电话:(0931)7631225。Email:lichong@gsau.edu.cn。
