茶树PSY基因的比较基因组学 及在黄化种中的表达
2022-04-15林馨颖杨如兴王鹏杰陈雪津郭永春叶乃兴
林馨颖, 杨如兴, 王鹏杰, 陈雪津, 郭永春, 高 婷, 叶乃兴
(1.福建农林大学园艺学院,福建 福州 350002;2.福建省农业科学院茶叶研究所,福建 福州 350013)
类胡萝卜素是一类广泛存在于自然界的次生代谢产物,是由异戊二稀组成的一类重要的萜类物质[1],在植物生长发育过程中,不仅参与外界刺激的应答反应,也与光合作用和光保护效应有关[2].类胡萝卜素合成通路中的牻牛儿基牻牛儿基焦磷酸(GGPP)经八氢番茄红素合成酶(phytoene synthase, PSY)催化产生八氢番茄红素,该步反应是合成类胡萝卜素的关键步骤[3].若植物PSY基因功能失活,类胡萝卜素合成受阻,植物将出现白化现象[4].近年来,PSY基因被广泛鉴定,如:拟南芥(Arabidopsisthaliana)含1个PSY基因[5];普通烟草(Nicotianatabacum)含3个PSY基因[6]等.
茶树[Camelliasinensis(L.) O. Kuntze]是我国具有重要利用价值的叶用作物[7].类胡萝卜素是一类重要的光合色素,在茶树发育过程中起到光保护和抗氧化等作用[8].茶树中的类胡萝卜素参与叶片色泽的形成,是茶树黄化变异的关键代谢组分.有研究认为,茶树叶绿体发育受到光照的影响,当类胡萝卜素合成途径受到阻碍时,植物光保护能力下降,叶绿体更易受到光氧化损伤,导致茶树产生黄色叶片[9].迄今,茶树类胡萝卜素合成途径中关键酶的基因已经得到克隆与验证[8],其中也有茶树PSY基因的研究报道,如:Devajit[10]利用cDNA末端快速扩增的3′-RACE和5′-RACE克隆了茶树PSY基因的全长,并对低温敏感型黄化变异茶树中的基因表达进行比较,发现PSY基因的表达高于同植株的绿色叶片,但并未对其进行相关生物信息学分析;冯琳[11]在茶树‘农抗早’和黄化种‘御金香’叶片生长发育过程的研究中发现,茶树PSY基因的表达量存在变化,整体表达量较低.
‘福安大白茶’(编号:GS13003-1985)和‘福云6号’(编号:GS13003-1987)是全国茶树优良品种.本研究以其黄化突变种福黄1号和福黄2号为主要材料,从‘黄棪’、‘铁观音’和‘舒茶早’茶树基因组数据库中获得PSY基因.利用生物信息学方法分析茶树PSY基因的生物学功能,并运用实时荧光定量PCR技术分析茶树PSY基因在‘福安大白茶’、‘福云6号’、福黄1号、福黄2号和‘黄金芽’中的表达量,探究PSY基因在茶树芽叶发生黄化突变过程的调控作用,旨在为探究茶树黄化种的变异机制提供参考.
1 材料与方法
1.1 材料
试验材料为2021年3月在福建省宁德市蕉城区八都镇茶树品种示范茶园采集的‘福安大白茶’、‘福云6号’、福黄1号、福黄2号和‘黄金芽’春梢一芽二叶.用液氮冷冻固定所获得的样品,置于冰箱(-80 ℃)保存备用.以上5个样品均设置3次重复.
1.2 总RNA的提取及cDNA的合成
采用植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取5个茶树样品的总RNA;采用NanoDrop 2000超微量分光光度计检测RNA的浓度和纯度;采用1%凝胶电泳检测RNA的质量;采用试剂盒(北京全式金生物技术有限公司)将RNA逆转录合成cDNA,用于实时荧光定量PCR检测.
1.3 茶树PSY基因的鉴定
从Pfam数据库(https://pfam.xfam.org)下载PSY蛋白的结构域信息(PF00494),利用HMMER软件(https://plants.ensembl.org/hmmer/index.html)进行鉴定.以拟南芥PSY蛋白序列(拟南芥基因组数据库)为种子序列,利用NCBI数据库(https://www.ncbi.nlm.nih.gov/)和茶树品种‘黄棪’、‘铁观音’、‘舒茶早’基因组数据库进行BLAST比对,获得同一性>90% ,且E值<10-10的所有茶树PSY蛋白序列.利用SMART网站(http://smart.embl-heidelberg.de/)和CDD网站(https://www.ncbi.nlm.nih.gov/cdd/)对所得到的序列进行同源性和结构域分析,进一步验证是否具有完整结构域[12].
1.4 茶树PSY基因的生物信息学分析
利用在线网站ExPASY(https://www.expasy.org)分析茶树PSY基因的理化性质,包括基因的编码序列、开放阅读框、分子质量、等电点、蛋白质疏水性;采用SignalP 4.1 Server在线软件(http:// www.cbs.dtu.dk/services/SignalP/)进行信号肽分析;利用在线工具WOLF PSORT(https://wolfpsort.hgc.jp)进行亚细胞定位预测;采用NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)、FoldIndex(https://fold.weizmann.ac.il/ fldbin/findex)、SOPMA、Swiss-Model(https://swissmodel.expasy.org/)在线软件分别进行氨基酸序列磷酸化位点、折叠无序化、蛋白质二级和三维结构预测;采用DNAMAN7.0软件对相关蛋白进行多序列比对;采用MEGA7.0软件构建系统发育进化树,校验参数值设置为1 000,其他为默认值[13];使用MEME工具(http://meme-suite.org/tools/meme)对蛋白的保守基序进行分析,设置基序数量的参数值为10,其余为默认值[14];从茶树基因组中提取PSY基因转录起始位点2 000 bp的序列,利用在线网站PlantCARE(http://bioinformatics.psb.ugent.be/ webtools/plantcare/html)预测启动子的顺式作用元件;从茶树基因组数据库检索PSY基因的位置信息,使用TBtools软件[15]可视化该基因在染色体上的位置.
1.5 实时荧光定量PCR检测
以‘福安大白茶’、‘福云6号’、福黄1号、福黄2号和‘黄金芽’茶树样品的总RNA为模板,逆转录合成cDNA用于实时荧光定量PCR检测.通过Primer3plus在线网站设计引物序列(表1),选取茶树GAPDH(GE651107)作为内参基因[16].采用CFX96 Touch荧光定量PCR仪[伯乐生命医学产品(上海)有限公司],参照Transstart®Tip Green qPCR superMix试剂盒(北京全式金生物技术有限公司)所示的反应体系和反应方法进行实时荧光定量PCR检测.反应程序设为:94 ℃预变性30 s;94 ℃变性5 s,60 ℃延伸30 s,40个循环.试验结束后,采用2--ΔΔCT算法计算表达量[17].后续柱状图采用Prism 8软件制作,并用SPSS 17.0软件对样本间的显著性进行分析.
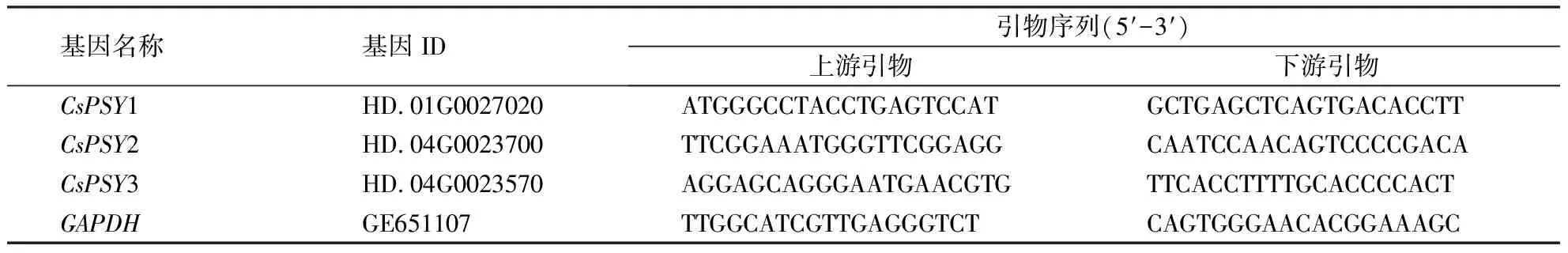
表1 茶树PSY基因的引物序列Table 1 Primer sequences of PSY gene in C.sinensis
2 结果与分析
2.1 茶树PSY基因的鉴定及序列
从‘黄棪’茶树基因组数据中鉴定到3个PSY基因,分别命名为CsPSY1、CsPSY2、CsPSY3;从‘铁观音’茶树基因组中鉴定到2个PSY基因,分别命名为TGY-PSY1、TGY-PSY2;从‘舒茶早’茶树基因组中鉴定到4个PSY基因,分别命名为CSS-PSY1、CSS-PSY2、CSS-PSY3、CSS-PSY4.表2显示:茶树PSY基因编码的蛋白序列长度为645~1 506 bp,氨基酸个数为214~501,其中,CsPSY1(HD.01G0027020)、TGY-PSY1(CsTGY01G0002454)、CSS-PSY1(CSS0002725)编码的蛋白序列长度均为1 269 bp,氨基酸个数均为422;分子质量为24.23~56.56 ku;理论等电点为4.96~8.71,除CsPSY3和CSS-PSY4编码的蛋白外,其余PSY基因编码的蛋白为碱性蛋白(等电点大于7);茶树PSY蛋白均是亲水性的,疏水性的平均值低于0.亚细胞定位预测结果显示,CsPSY3和CSS-PSY2分别定位于细胞膜和线粒体上,其他茶树PSY基因都定位于叶绿体上.
2.2 茶树PSY系统发育进化树和蛋白序列
将获得的茶树PSY蛋白序列与19种其他物种的22条PSY蛋白序列构建系统发育进化树.结果(附件图IA,扫OSID码可见)显示,CsPSY1、CSS-PSY1和TGY-PSY1编码的蛋白序列与柿子、葡萄、木瓜的一致性较高,亲缘关系较近,而与棉花、苦瓜、南瓜等的一致性较低.基序分析结果(附件图IB、IC,扫OSID码可见)显示,CsPSY1、CSS-PSY1和TGY-PSY1编码的蛋白,其保守基序与其他物种(除香瓜外)相似,且排列顺序相同.由此可见,CsPSY1、CSS-PSY1和TGY-PSY1编码的蛋白保守性高,稳定性好.CsPSY2、CsPSY3、CSS-PSY2、TGY-PSY2、TGY-PSY3和TGY-PSY4编码的这6条蛋白序列存在差异.不同物种的PSY成员包含基序1、2、9,这表明特有的基序可能赋予茶树PSY蛋白特定的作用.
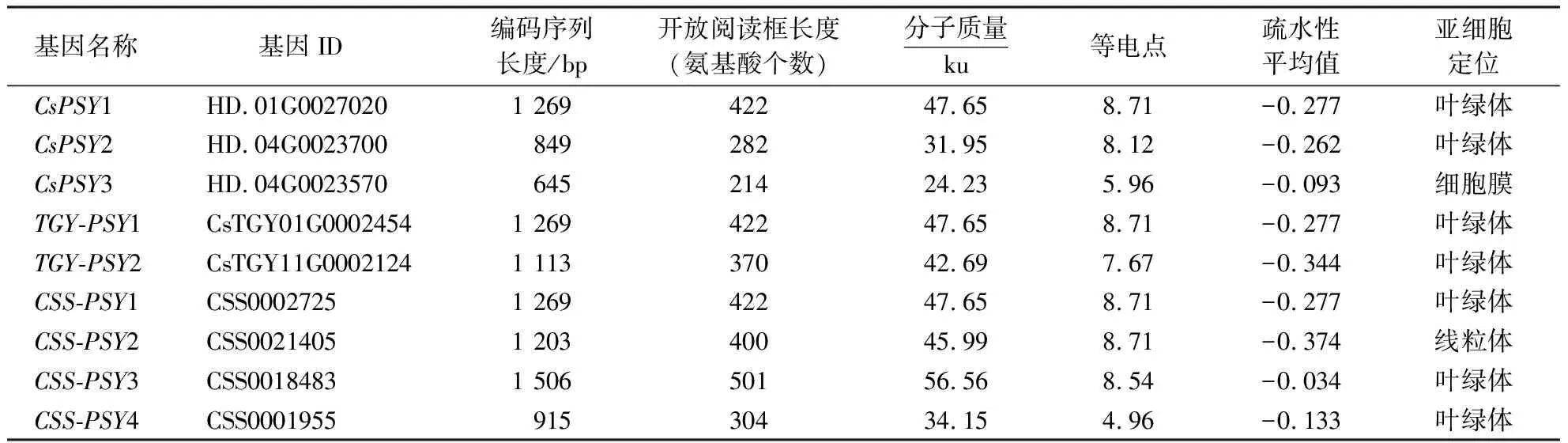
表2 茶树PSY蛋白生物学信息Table 2 Bioinformatics analysis of PSY proteins in C.sinensis
拟南芥PSY蛋白序列含有高度保守的DXXXD结构域,将茶树PSY蛋白序列与拟南芥进行比对,同样发现茶树具有DXXXD结构域(附件图Ⅱ,扫OSID码可见),这表明茶树与拟南芥的PSY蛋白序列可能发挥相似的功能.
2.3 茶树PSY蛋白磷酸化位点与折叠状态
茶树PSY蛋白磷酸化位点预测结果(附件图ⅢA,扫OSID码可见)显示,PSY均含有丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)磷酸化位点,CsPSY1编码的蛋白分别含有24、10和7个,CsPSY2编码的蛋白分别含有12、8和7个,CsPSY3编码的蛋白分别含有7、6和6个.茶树PSY折叠无序化分析结果(附件图ⅢB,扫OSID码可见)显示:CsPSY1和CsPSY2编码的蛋白分别有2、1个无序化区域,而CsPSY3编码的蛋白没有无序化区域.总体上看,茶树PSY基因编码的蛋白无序化状态不明显.
2.4 茶树PSY蛋白结构预测
PSY蛋白的二级结构由α-螺旋、β-折叠、无规则卷曲和延伸链构成.茶树蛋白结构预测结果(附件图ⅣA,扫OSID码可见)显示,CsPSY1编码的蛋白的α-螺旋、β-折叠、无规则卷曲和延伸链结构占比分别为54.98%、4.03%、30.33%和10.66%,CsPSY2编码的蛋白占比分别为48.94%、4.61%、36.52%和9.93%,CsPSY3编码的蛋白占比分别为59.35%、3.74%、28.50%和8.41%.茶树PSY蛋白三维结构模型预测结果(附件图ⅣB)显示,CsPSY2与CsPSY3编码的蛋白高度相似,结构域高度保守.二级结构与三维结构的推测结果相吻合,无规则卷曲和α-螺旋是茶树PSY蛋白的主要组成部分.
2.5 茶树PSY基因结构与启动子顺式作用元件预测
茶树PSY基因的内含子与外显子比较结果(图1)显示:CsPSY1由6个外显子和5个内含子构成;CsPSY2和CsPSY3由4个外显子和3个内含子构成.茶树PSY基因染色体位置分布情况(图2)显示,CsPSY1位于第1条染色体(Chr1)上,CsPSY2和CsPSY2位于第4条染色体(Chr4)上.
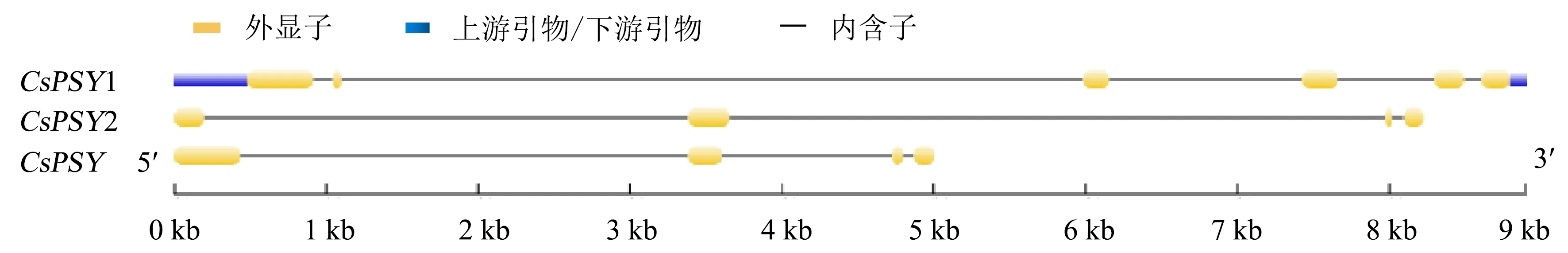
图1 茶树PSY基因结构Fig.1 Gene structure analysis of PSY genes in C.sinensis
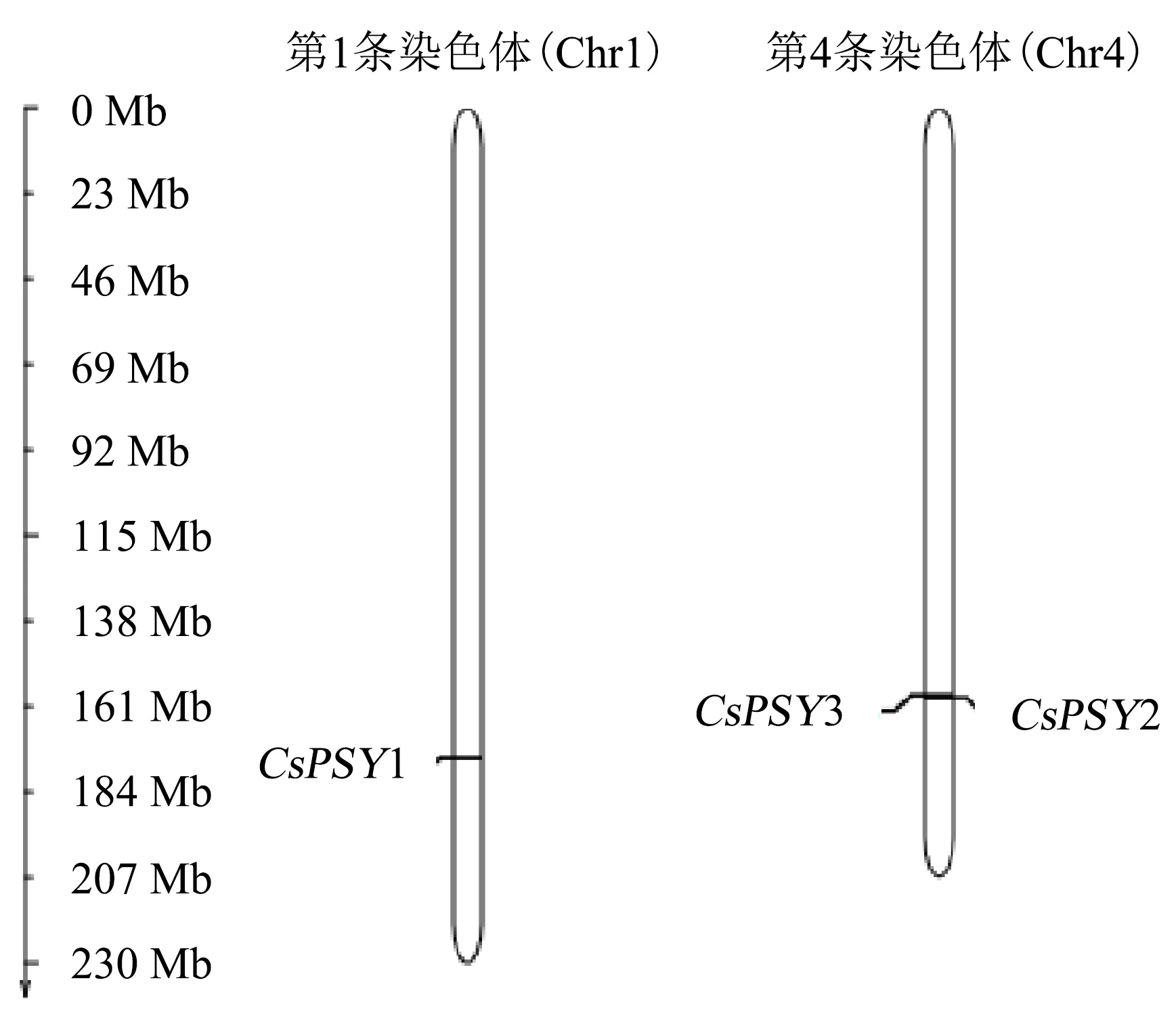
图2 茶树PSY基因在染色体上的分布Fig.2 Chromosomal distribution of PSY genes in C.sinensis
利用PSY基因转录起始位点2 000 bp启动子序列对茶树PSY基因顺式作用元件的功能进行分析,结果(图3)显示,PSY基因共含有23种顺式作用元件.其中,生长作用顺式元件有4种,分别为参与蛋白代谢调节的顺式作用元件(O2-site)、生理昼夜节律调控元件(circadian)、胚乳表达相关的元件(GCN4-motif)、分生组织表达相关的元件(CAT-box);激素响应顺式元件有5种,分别为脱落酸响应元件(ABRE)、茉莉酸甲酯响应元件(CGTCA-motif、TGACG-motif)、水杨酸响应元件(TCA-element)、赤霉素响应元件(P-box);光响应顺式元件有10种,分别为ACE、BOX4、GATA-motif、GT1-motif、G-BOX、G-box、TCT-motif、AE-box、LAMP-element、Gap-box.PSY基因顺式作用元件与光响应相关的个数最多,这暗示了PSY基因在茶树光响应中发挥着较大的潜在作用.此外,4种胁迫响应顺式元件存在于PSY基因的启动子区域,包括参与干旱响应元件(MBS)、厌氧诱导响应元件(ARE)、防御和应激响应元件(TC-rich)、低温响应元件(LTR).
2.6 PSY基因在茶树黄化种中的表达
对‘福云6号’、‘福安大白茶’、福黄1号、福黄2号和‘黄金芽’PSY基因的表达情况进行分析.结果(图4)表明:CsPSY1和CsPSY3在茶树黄化种‘黄金芽’、福黄1号和福黄2号中均有不同程度的表达,且表达量较高;CsPSY2在‘黄金芽’中的表达量最高,其次为福黄1号,而在福黄2号中的表达量较低.其中,CsPSY1在福黄1号中的表达量是CsPSY2和CsPSY3的3.93、2.98倍,在福黄1号中的表达量是‘福安大白茶’的37.56倍;CsPSY2在福黄2号中的表达量是CsPSY1和CsPSY3的14.56、24.76倍,在福黄2号中的表达量是‘福云6号’的141.43倍.

图3 茶树PSY基因转录起始位点2 000 bp启动子区顺式作用元件Fig.3 cis-elements in the promoter region (2000 bp upstream of start codon) of PSY gene in tea plants
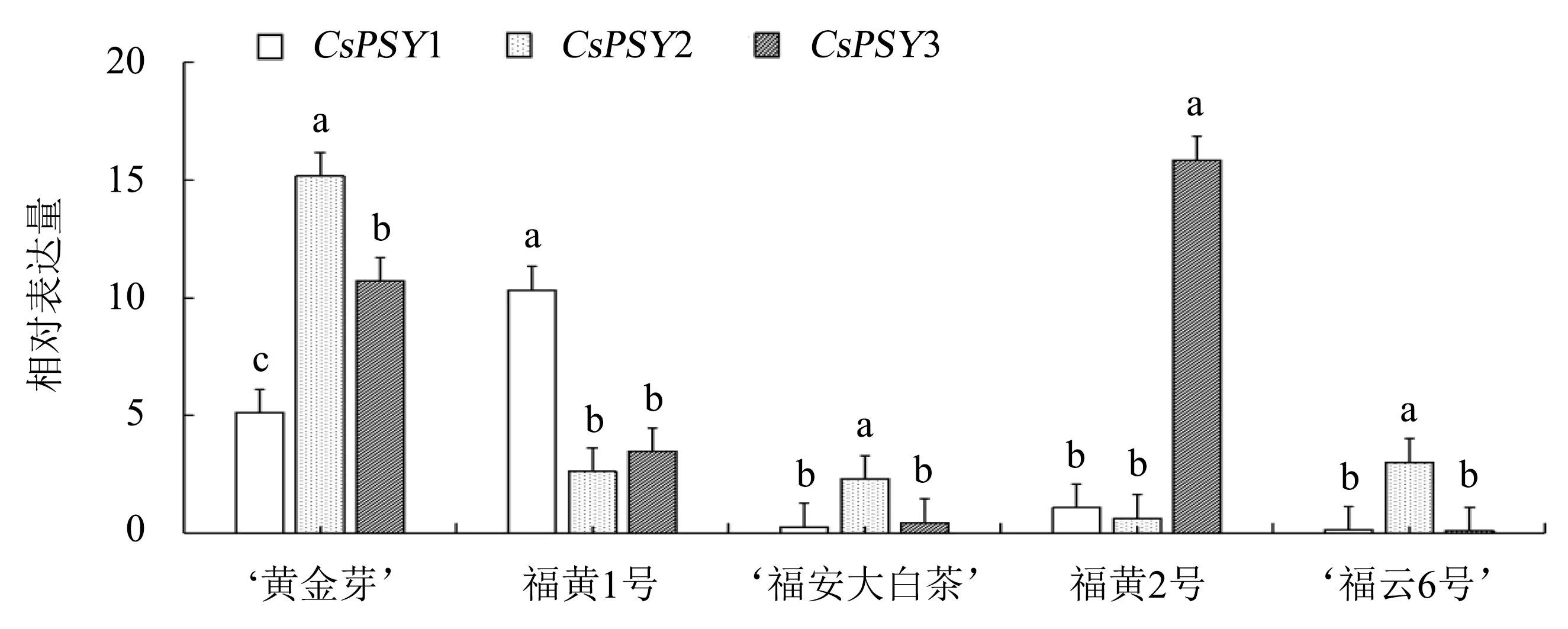
图柱上附不同字母表示差异显著(P<0.05),附相同字母表示差异不显著(P>0.05).图4 PSY基因在茶树黄化种中的表达量Fig.4 Expression level of PSY genes in albino tea cultivars
3 讨论
茶树PSY基因具有光调控茶树类胡萝卜素合成通路的重要位点,其表达丰度影响茶树体内类胡萝卜素的合成与积累[3].本研究通过分析茶树品种‘黄棪’基因组数据得到3个PSY基因,并对其生物信息及表达特性进行了分析.对PSY蛋白结构域分析发现,茶树PSY蛋白具有高度保守的蛋白活性位点DXXXD,该位点是判别PSY基因所编码的蛋白是否具有酶活力的重要依据,在西瓜和拟南芥中也存在同样的结构域[18].茶树和多个物种的蛋白序列具有较高的一致性,保守基序相似,尤其是CsPSY1编码的蛋白,说明茶树PSY是一类具有高度保守的酶类,这与在番茄中的研究结果[19]相似.对茶树PSY基因的染色体序列及基因结构分析发现,CsPSY2和CsPSY3均位于第4条染色体上,且具有一样的外显子和内含子数量,表明两者高度同源.前人研究表明,糜子PmPSY2和PmPSY4编码的蛋白主要在叶绿体中合成[20],对茶树PSY基因亚细胞定位预测发现,CsPSY1和CsPSY2定位在叶绿体上,表明PSY基因参与的类胡萝卜素合成也可能是在叶绿体中完成.茶树PSY基因序列的顺式作用元件分析结果显示,PSY基因存在大量光响应元件,如ACE、BOX4、GATA-motif等,以及部分与胁迫、激素应答、生长发育响应相关的元件.
PSY对植物色泽的形成起重要作用[3].如:当PSY基因沉默时,小麦黄色素含量显著下降[21];CaPSY1在辣椒果实着色的过程中发挥作用,呈现红色和黄色果实中的PSY基因表达量显著高于其他颜色的果实[22].本研究所用材料福黄1号、福黄2号和‘黄金芽’是茶树的黄化突变种,其新梢叶片呈现黄色,PSY基因在‘黄金芽’中均有较高的表达量;CsPSY1和CsPSY3在福黄1号、福黄2号中也有不同程度的表达,且表达量较高.与绿叶品种相比,CsPSY1在福黄1号中的表达量是‘福安大白茶’的37.56倍,CsPSY2在福黄2号中的表达量是‘福云6号’的141.43倍.前人研究表明,低温敏感型黄化变异茶树PSY基因的表达量在黄化叶片中的表达量高于同植株的绿色叶片[10].冯琳[11]分析了类胡萝卜素合成途径中的PSY、八氢番茄红素脱氢酶(PDS)等基因在‘农抗早’和黄化种‘御金香’中的表达,发现这些基因在不同品种中的表达均有差异.由此推测PSY基因的高表达可能会导致福黄1号和福黄2号类胡萝卜素含量发生变化,导致其芽叶颜色发生变化.
本研究在茶树品种‘黄棪’、‘铁观音’和‘舒茶早’基因组中分别鉴定出3、2、4个PSY基因,对‘黄棪’基因组鉴定出的PSY基因进行了生物信息学功能鉴定,用实时荧光定量PCR技术分析茶树黄化种福黄1号、福黄2号和‘黄金芽’的表达信息,旨为进一步探究茶树黄化种类胡萝卜素的合成调控机制提供参考.
