草原短尾羊TBXT基因RACE 克隆及胚胎各个时期表达量分析
2022-04-15霍雨佳智达夫苏红杨宏新窦傲蕾曹贵方
杨 光,霍雨佳,智达夫,苏红,杨宏新,窦傲蕾,曹贵方*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.内蒙古自治区基础兽医学重点实验室,内蒙古呼和浩特 010018)
草原短尾羊是呼伦贝尔地区特有的绵羊品种,由于其肉质鲜美、蛋白含量高和脂肪含量低,深受广大消费者喜爱。有研究通过对草原短尾羊和巴尔虎羊尾部进行X 光观察发现,相较于巴尔虎羊,草原短尾羊尾椎骨存在畸形;在基因组重测序结果和DNA 测序结果中发现,短尾羊群体(T-box Transcription Factor T)基因发生c.G334T 错义替换,推测草原短尾羊的短尾性状主要由尾椎骨畸形引起,且与基因的突变相关。该处突变可能会引起Brachyury 蛋白功能上的改变,进而影响该蛋白与下游靶基因的结合,从而导致草原短尾羊尾椎骨畸形。草原短尾羊群体中也存在尾部长短差异,所以也有研究指出绵羊尾部长度的不同与Brachyury蛋白表达存在“剂量效应”。是T-box 转录因子家族中最早发现的成员,也是中胚层发育的标志基因,在基因突变小鼠中出现尾部变短的表型;进一步对小鼠进行基因型检测发现短尾鼠均为突变杂合子,纯合突变小鼠胚胎发育第10 天由于尿囊无法正常合成导致死亡,并且在其他短尾表型动物中同样发现基因突变会导致尾骨发育不良。mRNA 主要表达在小鼠胚胎发育时期,除在脊索细胞中能够检测到mRNA,在健康成年小鼠其他部位几乎不表达;对绵羊的研究发现,mRNA 主要在胚胎的脊索细胞和原条中表达,mRNA 表达部位随着胚胎发育时间的推移而不断变化。目前,绵羊胚胎发育过程中mRNA 具体的表达趋势还鲜见报道。NCBI 数据库中绵羊mRNA 序列共有3 种可变剪切体,长度分别为1 311 bp(登录号:XM_027972732)、1 308 bp(登录号:XM_027972733)、1 134 bp(登录号:XM_004011450);但在实验过程中有时会出现与以上均不匹配的另一种mRNA 可变剪切体。为了更深入地研究形成绵羊短尾性状的机制,本实验获取不同时期草原短尾羊胚胎,克隆cDNA全长序列并对其蛋白质理化性质进行分析,为研究草原短尾羊Brachyury蛋白质功能奠定基础。
1 材料与方法
1.1 实验动物 草原短尾羊由呼伦贝尔鄂温克锡尼河镇苏和巴特尔家庭牧场提供,公羊母羊自然交配当天记为短尾羊胚胎第0 天,分别在胚胎14、16、20 d 和25 d对母羊进行宰杀,从母体子宫内解剖获取草原短尾羊胚胎并迅速放入液氮中保存。
1.2 主要试剂 RNA fast 200 总RNA 极速抽提试剂盒购自上海飞捷生物技术有限公司;SanPrep 柱式DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司;SMARTer RACE 5'/3'Kit、DNA Markers、In-Fusion HD Cloning Kit 均购自TaKaRa 公司;Trans T1 Chemically Competent Cell 购自北京全式金生物技术有限公司;5 min TA/Blunt-Zero Cloning Kit、2×Phanta Max Master Mix(Dye Plus)、ChamQ SYBR Color qPCR Master Mix、HiScript III 1st Strand cDNA Synthesis Kit (+gDNA wiper)、质粒小提试剂盒购自诺唯赞生物(南京)公司。
1.3 引物设计及合成 根据NCBI 数据库中所登记的绵羊(Glyceraldehyde-3-Phosphate Dehydrogenase;登录号:NM_001190390)和(登录号:XM_027 972732)mRNA 序列设计qPCR、3'RACE 和5'RACE引物,引物序列发送至生工生物工程(上海)股份有限公司进行合成,引物序列见表1。

表1 实验用引物序列
1.4 草原短尾羊胚胎RNA 的提取及cDNA 合成 将草原短尾羊14、16、20 d 和25 d 胚胎剪碎后放入液氮中研磨,并按照RNA fast 200 总RNA 极速抽提试剂盒说明书进行总RNA 提取。将提取后总RNA 按照HiScript III 1st Strand cDNA Synthesis Kit(+gDNA wiper)说明书进行反转录,产物于-20℃保存。
1.5 实时荧光定量PCR 将草原短尾羊各个时期胚胎cDNA 统一稀释至100 ng/μL 作为模板,进行实时荧光定量PCR 检测基因mRNA 表达量。反应体系为:2×ChamQ SYBR Color qPCR Master Mix 1 μL、ddHO 7.2 μL、上下游引物(10 μmol/L)各0.4 μL、cDNA 1 μL。反应程序如下:预变性95℃ 30 s、循环反应95℃10 s、60℃ 30 s、95℃ 15 s 共40个循环;熔解曲线反应60℃ 60 s、95℃ 15 s。每个时期的胚胎均设置3个重复孔检测。反应结束后使用Bio-Rad CFX 96 自带软件进行分析,将软件中输出的Ct 进行2计算,并将计算出的结果使用GraphPad Prism 9 软件绘制柱形图。使用软件中的Independent-Samples T Test 进行F检验和T 检验。
1.6基因的RACE 克隆基因已知片段克隆:将草原短尾羊胚胎cDNA 作为模板,Brachyury 上、下游引物进行PCR 扩增。反应体系如下:上、下游引物(10 μmol/L)各2 μL、cDNA 1 μL、ddHO 20 μL、2×Phanta Max Master Mix(Dye Plus)25 μL。反应程序如下:预变性95 ℃ 3 min;循环程序共30个循环包括变性95℃ 15 s、退火60℃ 15 s、延伸72℃ 3 s;彻底延伸72 ℃ 5 min。将扩增后的产物连接至pCE2 TA/Blunt-Zero 载体并转化至Trans T1 大肠杆菌中,涂至具有氨苄抗性的固体LB 平板,挑取单克隆菌落用LB 液体培养基培养16 h 并提取质粒,将质粒送往生工生物工程(上海)股份有限公司测序。基因3'RACE 和5'RACE扩增按照SMARTer RACE 5'/3'Kit 说明书进行。3'RACE和5'RACE 产物无缝克隆连接至Lineareized pRACE vector,无缝克隆连接体系和连接条件按照In-Fusion HD Cloning Kit 说明书进行。将连接产物转化至Trans T1 大肠杆菌中,涂至具有氨苄抗性的固体LB 平板,挑取5个单克隆菌落,用LB 液体培养基培养16 h 并提取质粒,将质粒送往生工生物工程(上海)股份有限公司测序。
1.7 草原短尾羊基因序列分析 将测序后的序列使用DNAMAN 软件进行拼接后获得基因cDNA全长序列,使用DNA star 软件将基因的蛋白质编码区(CDS)翻译成氨基酸序列并输入NCBI Blast进行序列比对,将比对后结果筛选并使用Mega 7 软件进行系统进化树构建,方法使用邻接法(Neighbor-Joining),自聚值为1000;使用SignalP 4.1(www.cbs.dtu.dk)网页工具预测蛋白质信号肽;使用Swiss modle(beta.swissmodel.expasy.org)网页工具预测Brachyury蛋白质三级结构;使用ProtScale(web.expasy.org)网页工具预测Brachyury 蛋白质亲疏水性;使用PSIPRED v4.0(bioinf.cs.ucl.ac.uk) 和SOPMA(prabi.ibcp.fr)网页工具预测Brachyury 蛋白质二级结构和计算各类二级结构的比例。
2 结果与分析
2.1 草原短尾羊各个时期胚胎基因相对表达量鉴定 如图1 所示,基因在草原短尾羊16 d 胚胎表达量高于其他胚胎时期,14 d 胚胎时期略低于16 d胚胎,20 d 胚胎mRNA 的表达量远低于16 d 胚胎时期,在25 d 胚胎时期mRNA 几乎不表达,说明14 d 至20 d 胚胎正处于中胚层细胞分化阶段,在25 d 胚胎内中胚层细胞分化已停止。
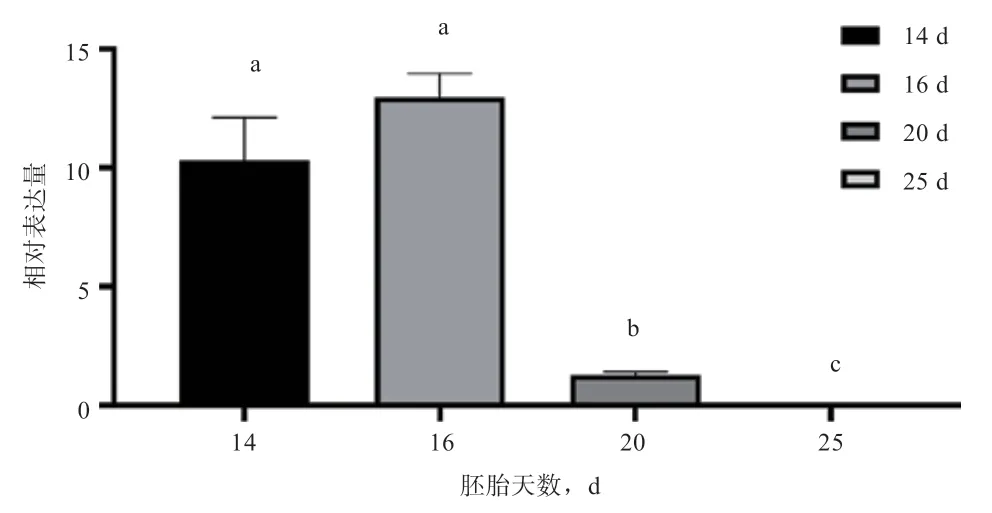
图1 TBXTmRNA 在草原短尾羊各个时期胚胎中的相对表达量
2.2基因的RACE 克隆 如图2 所示,以草原短尾羊16 d 胚胎cDNA 为模板进行基因cDNA全长克隆结果,其中第1 轮3’RACE 巢式PCR 产物经过1% 琼脂糖凝胶电泳显示结果为涂带,5’RACE 巢式PCR 产物经过1% 琼脂糖凝胶电泳结果显示条带位置 在100 bp左右;将 第1 轮3’RACE 和5’RACE 巢式PCR 产物稀释后作为模板进行第2 轮巢式PCR,第2 轮3’RACE 巢式PCR 产物电泳后显示条带在2 000 bp至1 000 bp之间,第2 轮5’RACE巢式PCR 产物电泳后显示条带在750 bp 至500 bp 之间,已知片段在2 000 bp 至1 000 bp 之间,条带符合预期片段大小。
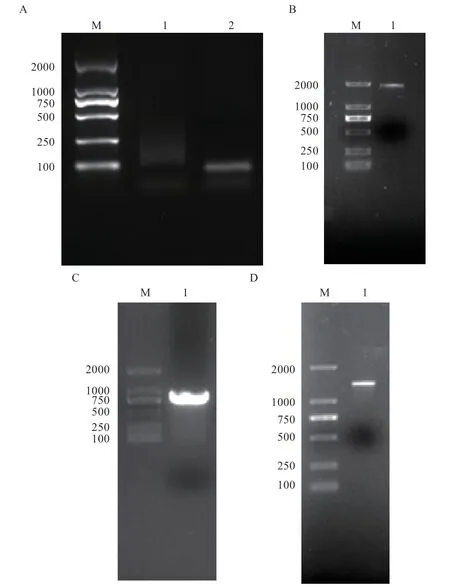
图2 草原短尾羊TBXT基因电泳检测
2.3 草原短尾羊基因序列分析 如图3 所示,将测序后的序列使用DNAMAN 软件进行序列拼接获得草原短尾羊基因cDNA全长序列共2 426 bp,其中开放阅读框1 335 bp,起始密码子为ATG,终止密码子为TGA,通过软件翻译预测编码444个氨基酸,等电点为6.912,分子量为48 328.56 道尔顿。并将拼接后的cDNA全长序列上传至NCBI 数据库(登录号:MZ146381);3’非编码区(3’UTR)和ployA 尾长度为763 bp,5’非编码区(5’UTR)长度为328 bp;对该基因进行核苷酸序列组成分析后发现腺嘌呤(A)含量为22.67%、鸟嘌呤(G)含量为28.44%、胞嘧啶(C)含量为30.05%和胸腺嘧啶(T)含量为18.76%。鸟嘌呤(G)和胞嘧啶(C)所占比率为58.49%,高于腺嘌呤(A)和胸腺嘧啶(T)所占比率41.43%。

图3 草原短尾羊TBXTcDNA全长序列和预测氨基酸序列
如图4 所示,将预测后草原短尾羊氨基酸序列输入NCBI 网站中Protein BLAST 进行序列比对,结果显示草原短尾羊Brachyury 与山羊、羚羊、牛、鹿、海豚、猪、狗、豹、人、羊驼相似性分别为95%、94%、94%、94%、91%、90%、90%、90%、90%、90%;并将以上序列下载后使用Mega 7 软件进行系统进化树构建,自举值为1 000,结果显示草原短尾羊与山羊属同一进化分支,与人和羊驼进化距离较远。
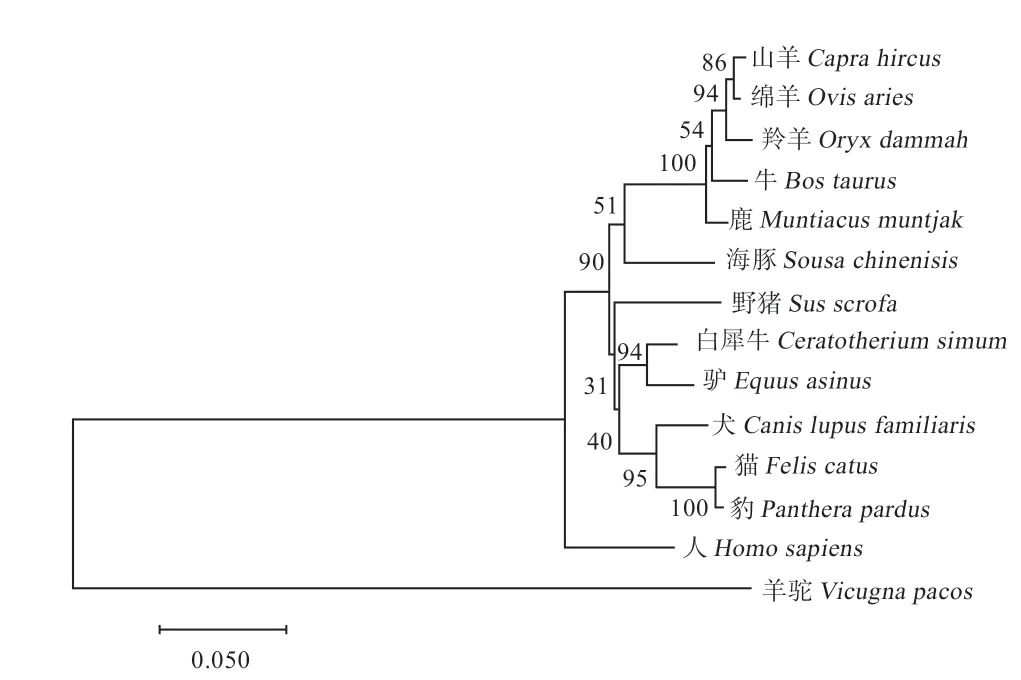
图4 预测Brahcyury 氨基酸序列构建系统进化树
如图5A 所示,将预测后草原短尾羊氨基酸序列输入Swiss modle 网页工具使用同源建模法预测Brachyury 蛋白质三级结构,QMEAN 值为-1.04,可信值在-4~0 内,表示该模型可信度较高,如图5B 所示,使用ProtScale 网页工具预测Brachyury 蛋白质亲疏水性,结果表示Brachyury 蛋白为疏水蛋白;如图5C 和表2 所示,Brachyury 蛋白无规则卷曲结构占比最多占整体结构的56.53%,-螺旋、片层和-弯曲分别占总体的21.40%、16.22%和5.86%。
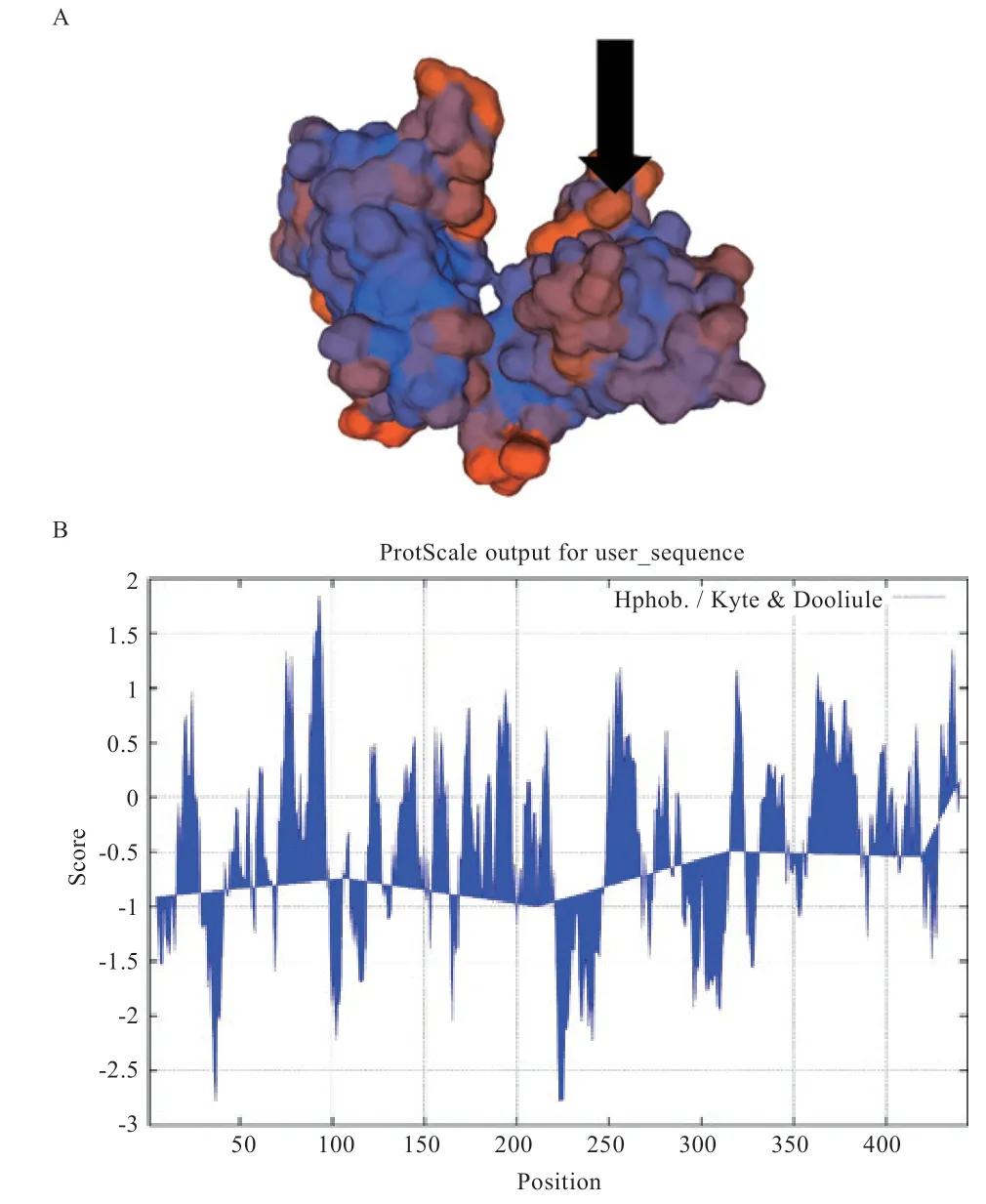

图5 Brachyury 蛋白理化性质分析

表2 各类二级结构占Brachyury 蛋白的比例
3 讨 论
在绵羊的早期胚胎发育过程中,伴随着中胚层细胞的分化,mRNA 的表达量逐渐降低;最后该基因仅在脊索细胞中表达。mRNA 主要表达部位为胚胎中的原条,其功能为维持原条中表皮细胞的迁移能力。本研究发现草原短尾羊16 d 胚胎中mRNA 表达量最高,表明该时期的绵羊胚胎中胚层细胞分化较为旺盛,结合Michel 等人的研究可以发现,此时的mRNA 可能表达于胚胎原条中部和尾部。在16 d 后mRNA 的表达量逐渐降低,推测胚胎中原条逐渐退化成脊索细胞。在小鼠胚胎中的研究发现,Brachyury 是脊椎动物胚胎发育过程中的关键因子,许多参与上皮细胞间充质转化的基因需要Brachyury 的激活才能促使体节的形成;由于基因突变,胚胎原条中的表皮细胞迁移能力受损,导致胚胎的后部没有脊索细胞,即使胚胎前部有少部分脊索细胞但不能正常分化,导致小鼠体节的缺失或发育异常。在小鼠胚胎发育过程中mRNA 最高表达时期为第8.5 天,此时小鼠胚胎中原条向中胚层祖细胞分化,Brachyury作为转录激活剂调节这一过程,而小鼠胚胎8.5 d 可能与16 d 绵羊胚胎所处的发育阶段相互对应,推测胚胎所处时期同为中胚层细胞分化和胚胎体轴延伸时期,Clements 等认为在胚胎发育过程中mRNA 表达的梯度很可能与表皮生长因子的调控作用正相关,然而在绵羊胚胎发育过程中这一复杂的调节机制亟待深入探究和证实。
本研究以16 d 胚胎cDNA 为模板,使用RACE 技术克隆草原短尾羊基因cDNA全长,所获得的开放阅读框长度均大于NCBI 和Ensmble 数据库中所公开的序列,经过序列对比后发现主要的Gaps 部位集中在第4 外显子和第5 外显子内,在不同组织或者同一组织的不同发育阶段,可变剪切的形式不是一成不变的,可变剪切形式的增多极大地丰富了真核动物的蛋白质多样性;在绵羊胚胎中得到mRNA 还具有哪些生物学意义需要进一步实验证实。
既作为胚胎发育时期的重要转录因子,也作为对草原短尾羊短尾性状成因研究中的候选基因,对其蛋白功能上的研究十分必要,对突变Brachyury 蛋白与野生Brachyury 蛋白在结构上差异的认知,有助于深入讨论突变后的Brachyury 蛋白如何影响下游靶基因的结合。有研究针对短尾羊和大尾羊的杂交实验表明,由于绵羊中c.334G>T 错义替换导致绵羊尾部变短,同时也有其他研究中指出,影响草原短尾羊和巴尔虎羊尾部长短差异的原因在于尾部的脂肪沉积,由此可以推测影响草原短尾羊尾部表型的原因可能不止一种。由于前人关于绵羊基因的研究较少,本实验结果可作为参考并从草原短尾羊16 d 胚胎中获取高丰度的mRNA,进一步体外制备Brachyury 蛋白,探究其突变位点对草原短尾羊尾椎骨发育的影响。
4 结 论
本研究对14、16、20 d 和25 d 草原短尾羊胚胎中mRNA 表达量进行研究,发现16 d 胚胎中表达量最高并以其cDNA 为模板,成功克隆cDNA 序列全长序列,为研究绵羊短尾性状的形成机制奠定理论基础。
