超米兰标准肝细胞癌肝移植术后复发预测模型的建立
2022-04-14张炜琪陈池义谭玉莹黄亚北蒋文涛
张炜琪, 谢 炎,, 陈池义, 贺 健,, 谭玉莹, 黄亚北, 张 骊, 蒋文涛
1 天津医科大学一中心临床学院, 天津 300070; 2 天津市第一中心医院 肝移植科, 天津 300192
肝细胞癌(HCC)是世界上第六大常见癌症,并且是肿瘤相关死亡的主要原因之一[1]。肝移植是治疗HCC最有效的方法之一,对于符合米兰标准的患者,肝移植术后5年存活率可达70%[2-3]。但米兰标准对于患者的要求较为苛刻,为了扩大受益人群,超米兰标准肝癌肝移植患者的数量逐渐增加,这同时也增加肝移植术后肿瘤复发的风险[4]。
肿瘤复发是患者肝移植术后死亡的常见原因之一,严重影响患者预后[4-5]。已有研究[6-8]表明,肿瘤的病理特征以及患者血清甲胎蛋白(AFP)对肿瘤的复发、转移具有重要提示作用。此外,全身炎症反应可通过上调细胞因子促进血管生成、DNA损伤和肿瘤侵袭[9-11],因此中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)作为一种简单的炎症指标,与HCC患者肝移植术后复发的联系也越来越被人们所认可[12-13]。本研究的目的是根据患者术前及术后相关指标建立一个预测超米兰标准HCC患者肝移植术后复发的模型,用于评估超米兰标准HCC患者术后复发的风险,以便合理指导治疗。
1 资料与方法
1.1 研究对象 回顾性分析2014年8月—2018年7月在天津市第一中心医院接受首次原位肝移植的超米兰标准HCC患者的临床资料。所有患者术前均根据影像学检查排除大血管侵犯和远处转移,HCC的诊断由术后病理得出。
1.2 纳入与排除标准 纳入标准:患者年龄在18~70岁;首次原位肝移植;术前未发现远处转移及大血管侵犯;术后病理学检查证实为超米兰标准的HCC。排除标准:混合性肝癌;多器官联合移植;术前合并其他部位的肿瘤;临床及病理资料缺失。
1.3 研究方法
1.3.1 手术和术后管理 所有患者均接受公民逝世后器官捐献的ABO血型相合的供肝,并由相同经验的医师进行原位肝移植。术后采用三联免疫抑制方案,包括他克莫司 (FK506)、霉酚酸酯(MMF)和激素。术中及术后第4天加用巴利昔单抗20 mg。术后3个月开始加用雷帕霉素并适当将FK506减量,使雷帕霉素和FK506的血药浓度分别维持在5~8 μg/L和2~3 μg/L,此时密切监测患者血常规、肝功能等指标以早期发现可能的排斥反应,根据患者具体情况决定是否需要加用吗替麦考酚酯。当发现肿瘤复发时,停用FK506,单用雷帕霉素并使其血药浓度维持在5~8 μg/L。
1.3.2 病理检查及免疫组化染色 术后病理检查及免疫组化染色由两位病理学专家进行盲法评估。如果两位病理学专家初始评估不一致,则重新评估结果至达成共识。
1.3.3 随访 采用门诊或电话方式进行随访。术后2年内每2个月随访1次,此后每6个月随访1次。随访期间常规行影像学及检验学检查。当怀疑转移或复发时,则通过MRI或增强CT进一步评估。主要观察终点是肝移植术后肿瘤复发。无复发生存时间定义为肝移植至肿瘤复发的时间,对于中途失访或死亡的患者,则为肝移植至最后一次随访的时间。总体生存时间定义为肝移植至患者死亡的时间,对于中途失访的患者,则为肝移植至最后一次随访的时间。随访截止日期为2021年7月31日。根据随访期间肿瘤是否复发,将患者分为复发组和未复发组。
2 结果
2.1 一般资料 患者基线资料见表1。本研究共纳入117例患者,其中男104例,女13例,平均(54.28±9.52)岁,共42例(35.9%)患者在随访期间死亡,46例患者中途失访,中位随访时间24(1~74)个月。术后3年生存率为53.1%,术后5年生存率为49.0%。53例(45.3%)患者术后复发,其中52例(98.1%)于术后3年内复发,中位复发时间为6(1~52)个月。其中3例患者在将免疫抑制剂转为雷帕霉素时肝功能发生轻度异常,经多学科会诊讨论后考虑轻度排斥反应,在予以加用吗替麦考酚酯及保肝等对症治疗后,肝功能逐步恢复正常。
2.2 单因素Cox回归分析结果 患者年龄、肿瘤最大直径、术前血清AFP、NLR、KLI的最佳截断值分别为54岁(AUC=0.638,95%CI:0.544~0.725,P=0.007)、5 cm(AUC=0.710,95%CI: 0.619~0.790,P<0.001)、769 ng/mL(AUC=0.726,95%CI:0.636~0.804,P<0.001)、3.75(AUC=0.715,95%CI:0.624~0.795,P<0.001)、0.25(AUC=0.712,95%CI:0.621~0.792,P<0.001)(图1)。其中MELD评分(AUC=0.507,95%CI:0.413~0.601,P=0.898)对于术后复发的预测能力较差,且MELD评分常被用来评估受者术后存活情况,故该因子被排除在外,未做进一步分析。单因素分析显示,肿瘤最大直径>5 cm、卫星灶、门静脉癌栓、微血管侵犯、AFP>769 ng/mL、NLR>3.75、免疫组化染色AFP、CK19阳性以及 KLI>0.25均是影响患者术后无复发生存时间的因素(P值均<0.05)(表2)。
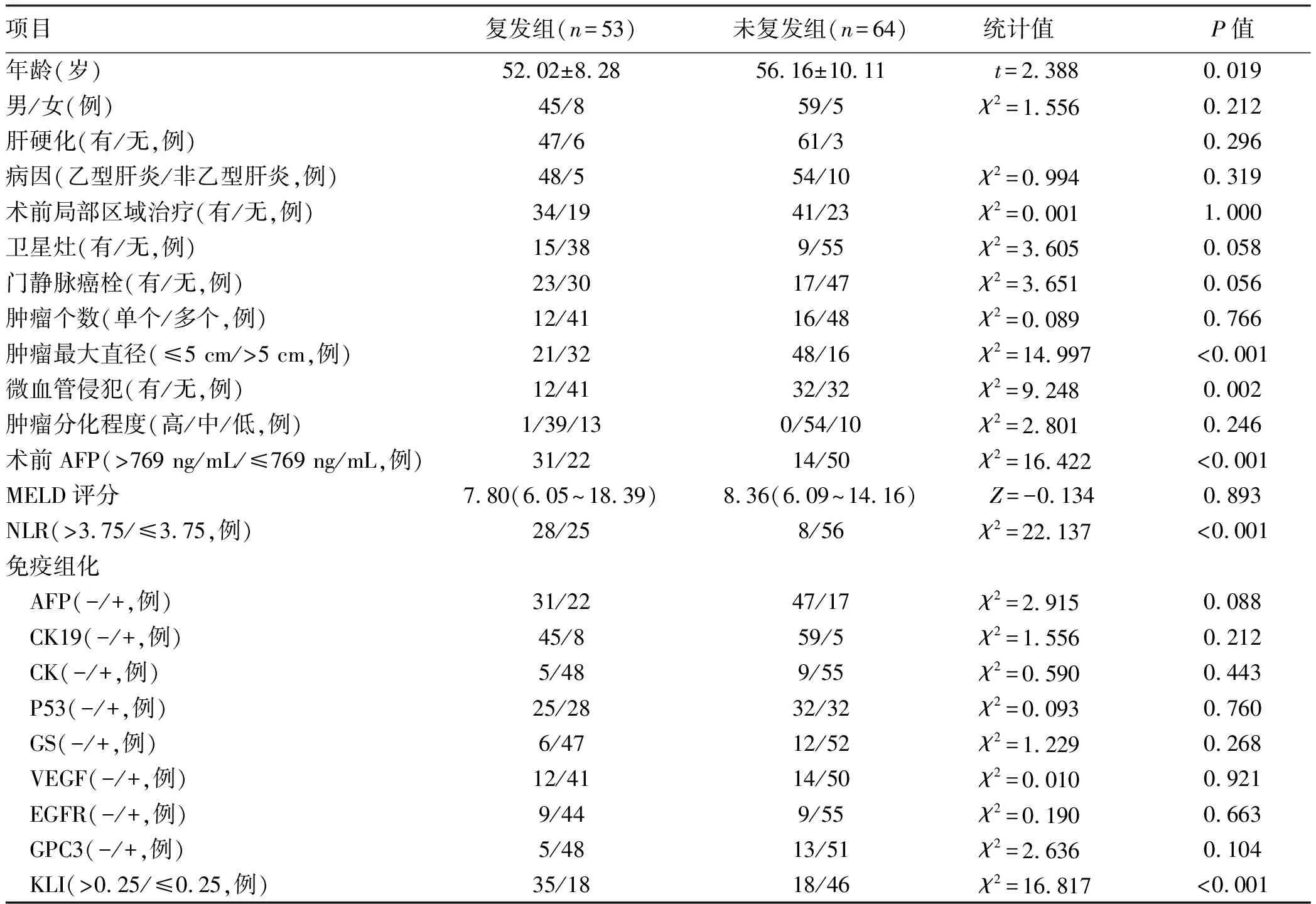
表1 117例患者的一般资料Table 1 The general data of 117 patients
2.3 多因素Cox回归分析筛选模型变量 在将上述9个变量进行多变量分析之前,对预测变量进行了多重共线性评估。各组间方差膨胀因子均小于10,容忍度大于0.2,说明各因素之间不存在共线性问题[15]。随后将上述9个指标纳入多因素分析。Cox多因素回归分析结果显示只有KLI>0.25、术前血清AFP>769 ng/mL,NLR>3.75是影响患者术后复发的危险因素(P值均<0.05)(表2)。
2.4 建立模型 根据多因素Cox回归分析的结果,用KLI、AFP、NLR三个因子构建肝移植术后HCC复发预测模型。根据每个因子的β系数赋予相应得分。KLI>0.23得1分,AFP>769 ng/mL和NLR>3.75分别得1.5分,其余均得0分,将所得评分相加即为总分,个人总分为4分(表3)。Hosmer-Lemeshow检验显示P=0.184,说明该模型拟合优度良好。模型AUC为0.843(95%CI:0.764~0.903,P<0.001),最佳截断值为1.25,具有良好的灵敏度(88.7%)及特异度(70.3%)(图2)。
比较不同得分之间的无复发生存率发现,得分0~1分的患者具有较低的复发率以及较好的无复发生存率,而1.5~4分的患者复发率较高,无复发生存率较低。因此将患者分为低危组(0~1分)和高危组(1.5~4分),log-rank检验显示高危组患者术后3年、5年无复发生存率(10.9%、10.9%)明显低于低危组患者(84.1%、72.0%)(χ2=29.425,P<0.001)。比较这两组患者的总体生存率,发现高危组患者术后3年、5年总生存率(36.8%、36.8%)也明显低于低危组患者(81.9%、74.5%)(χ2=14.800,P<0.001)(图3)。

表2 单因素及多因素Cox回归分析结果Table 2 The results of univariate and multivariate Cox regression analysis

图2 新HCC复发预测模型的预测能力Figure 2 The performance of the new model for predicting HCC recurrence表3 基于多因素Cox回归分析β系数的模型得分Table 3 The score of the model based on β coefficient ofmultivariate Cox regression analysis
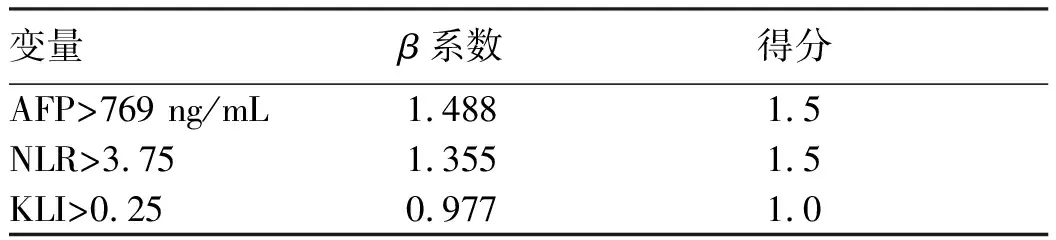
变量β系数得分AFP>769 ng/mL1.4881.5NLR>3.751.3551.5KLI>0.250.9771.0
3 讨论
超米兰标准HCC患者肝移植术后肿瘤复发使其预后不能令人满意。现有研究[16]报道了多种与肝移植术后HCC复发有关的检验学及病理学参数。Ma等[17]发现肿瘤个数、肿瘤最大直径以及术前AFP水平等指标与HCC复发有关,并将其纳入到模型构建中,获得了比单一因素更为有效的预测模型。Shimamura等[18]根据影像学及血清学检查使用血清AFP、肿瘤直径及个数等指标也构建了一个评价效果良好的模型。但这两种模型均不是针对超米兰标准HCC的患者。本研究根据患者术前NLR、AFP水平以及KLI,构建了一个针对超米兰标准HCC患者的预测模型且预测效能良好。
术前高NLR反映出机体的低淋巴细胞和高中性粒细胞状态。前者表明机体对肿瘤的免疫反应较差,后者反映了VEGF的水平,而VEGF与肿瘤血管生成及肿瘤进展密切相关[12]。术前高NLR已被证明与多种实体肿瘤的不良生存结果相关[19-21]。在Motomura等[12]的研究中,无论HCC患者是否符合米兰标准,NLR≥4的患者活体肝移植术后5年无复发生存率均低于NLR<4的患者。术前高NLR是影响患者术后复发的重要危险因素。
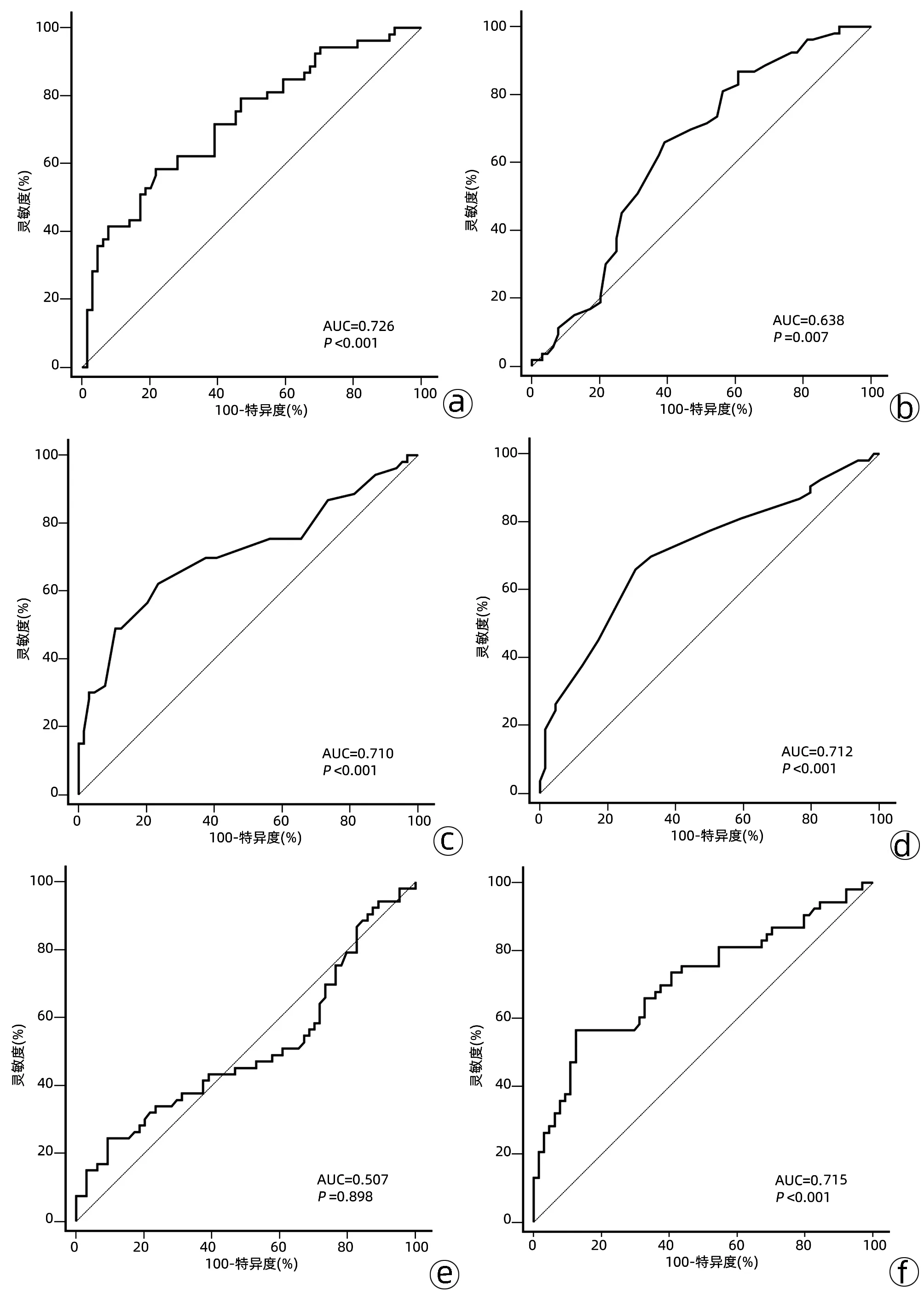
注:a,术前血清AFP;b,年龄;c,肿瘤最大直径;d,KLI;e,MELD评分;f,NLR。
AFP用于肝癌的诊断和复发监测已有数十年的历史[22]。现有研究也表明,AFP水平是肝移植术后肿瘤复发的独立危险因子,其预测HCC复发的能力也在多种预测模型中被强调[18,23-26]。但在不同的研究中,AFP水平预测肝癌复发的截断值是不同的。本研究根据ROC曲线取得的最佳截断值能很好的将不同的患者区分开。但仅考虑AFP显然是不够的,笔者纳入了包括AFP在内的3个肿瘤相关指标,发现其预测价值要优于单一AFP。
Ki67是一种核蛋白,被认为是细胞增殖的敏感标志,反映了恶性肿瘤细胞的比例,与肿瘤的进展和转移相关[27-28]。多项研究[29-32]发现,高KLI在前列腺癌、肺癌、食管癌、乳腺癌等多种癌症中与患者的预后密切相关。在HCC中,ki67的表达被认为与肝癌细胞的增殖和恶性生物学活性有关,并且高KLI的肝癌易发生侵袭和转移[7]。然而,关于ki67的表达与HCC患者肝移植术后肿瘤复发研究较少。Zhang等[7]虽然发现肿瘤组织ki67阳性与肝移植术后HCC复发相关,但他并没有给出KLI,也没有量化ki67与肝移植术后HCC复发的关系。本研究根据免疫组化评估KLI,找到了能将不同危险程度的患者区分开的最佳截断值,并且发现KLI>0.25是肝移植术后HCC复发的重要危险因素。随后将其纳入到预测模型中,并取得了良好的预测价值。

图3 两组患者的无复发生存率与总体生存率比较Figure 3 The comparison of recurrence-free survival and overall survival between the two groups
本研究也存在一定的局限性。首先本研究是一项单中心、回顾性研究,且大部分患者病因都是乙型肝炎,这可能会造成一定的选择偏倚。其次由于样本量的限制,也使得本研究的结果需要更多的外部样本量来验证。
总之,超米兰标准的肝癌肝移植要慎重进行,本研究根据患者术前NLR、AFP水平以及KLI建立了一个有效预测此类患者肝移植术后复发的模型,有助于更精准地把握此类患者的肝移植指征,并为肝移植术后的随访和治疗提供一定的参考。
伦理学声明:本研究于2021年8月17日经天津市第一中心医院医学伦理委员会批准,批号:2021N071KY。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张炜琪负责资料收集,数据分析及文章撰写;蒋文涛负责课题设计,研究指导,审校并最终定稿;谢炎、陈池义、贺健、谭玉莹、黄亚北、张骊参与数据收集和分析。
