西湖水域外来生物福寿螺的种类鉴定及种群遗传多样性研究
2022-04-13李迦南赵星星钱周兴杨倩倩俞晓平
李迦南 赵星星 王 恩 王 道 钱周兴 张 洋 杨倩倩 俞晓平
(1. 中国计量大学生命科学学院, 杭州 310018; 2. 杭州西湖风景名胜区凤凰山管理处, 杭州 310002;3. 浙江省自然博物院, 杭州 310012)
福寿螺隶属于腹足纲Gastropoda新进腹足目Caenogastropoda瓶螺科Ampullariidae福寿螺属Pomacea, 是原产于南美洲、中美洲和加勒比地区的一类大型淡水螺[1]。当前, 福寿螺入侵亚洲、欧洲、北美洲和大洋洲的许多国家和地区, 被列入世界100种危害最大的入侵生物名单[2], 也是我国首批公布的外来入侵有害生物之一。福寿螺在我国最早于1981作为食用螺引入到台湾地区, 随后引入广东省中山市, 并在之后掀起的养殖热中引至全国各地[3—5]。由于福寿螺口味差, 未能产生良好的市场效益而被大量弃养或逃逸到农田、湿地等自然生境。因具有繁殖力强、成熟周期短、适应性和耐受力强等特点, 加上缺乏本土天敌控制, 福寿螺种群迅速在我国南方地区扩散及暴发, 造成巨大经济损失[4,6]。它们不仅严重为害水稻幼苗及多种水生蔬菜[7], 并且破坏水生生态系统平衡[8,9]。此外, 福寿螺作为广州管圆线虫等多种人畜共患寄生虫的中间宿主, 严重威胁着人类身体健康[10]。
由于福寿螺种间形态近似, 种内形态特征多变,基于形态特征鉴别种类十分困难[11]。最新研究表明, 福寿螺在入侵地广泛发生了种间渐渗杂交, 导致卵形态特征趋同, 基于形态特征鉴别种类难度进一步增大[12]。近年来, 国内外研究学者基于DNA条形码技术极大程度地解决了福寿螺种类鉴定的难题, 并基于形态与分子特征结合方法构建了福寿螺综合分类系统。Rawlings等[13]基于线粒体12S—16S rDNA及线粒体COⅠ基因序列分析, 从小管福寿螺P. canaliculata中鉴别出近缘种孤岛福寿螺P.insularum; 进一步地, Hayes等[11]通过形态学结合分子系统学研究将其归并为斑点福寿螺P. maculata的同物异名。Lv等[14]和Yang等[15]基于DNA条形码分析从我国福寿螺样品中鉴别出一个隐种; Yang和Yu等[16]利用系统的螺壳、软体解剖学、卵及幼螺形态特征描述, 将这一隐种命名为隐秘福寿螺P.occulta。当前, 小管福寿螺、斑点福寿螺和隐秘福寿螺是在我国湿地生态系统中严重危害的3个种。
近年来, 种间杂交渐渗的新发现成为了福寿螺系统进化研究的焦点。在原产地及入侵地均检测到小管福寿螺和斑点福寿螺的杂交渐渗种群[17,18]。杂种的生物学特性(如耐低温水平)[19]、形态特征(如卵形态)[12]呈现小管福寿螺和斑点福寿螺的中间型。一般来说, 杂种可以理解为不同物种间交配形成的新生命体, 也可以更广泛地理解为形态可区分或遗传间断的群体间的个体交配产生的后代, 这个后代与父母本物种或者群体在形态或者遗传上是连续的, 并且没有形成自己独特的遗传特征[20,21]。
当前, 福寿螺在西湖、西溪国家湿地公园、洱海等景区水域大量发生, 景观及湿地的生物多样性受到了严重的威胁。由于福寿螺在水面上方产卵,卵块呈鲜红色, 在春夏繁殖高峰期, 大量卵块附着在水生植物、石壁及建筑物上, 与景区绿色的主体背景形成强烈对比, 引起游客不适, 引发社会的广泛关注[22]。然而有关福寿螺在景区的种类、分布特点及种群遗传多样性尚未有系统报告。本研究以杭州西湖景区为例, 在系统调研福寿螺分布情况的基础上, 结合连续6年采集的样本开展种类鉴定及种群遗传多样性分析, 以期为景区螺害的综合治理提供理论指导。
1 材料与方法
1.1 西湖水域福寿螺样品采集与发生调研
2017年至2020年春夏季连续开展了杭州西湖水域福寿螺样品的采集, 包括成螺及卵块共计82个样品(表 1和图 1)。于2020年7月在福寿螺发生盛期, 对杭州西湖水域及杭州植物园和太子湾公园水域(30°13′51″—30°15′58″N, 120°07′34″—120°10′09″E)开展福寿螺发生调研。在西湖水域沿岸每100 m为一个调查点, 在杭州植物园和太子湾公园的水域沿岸每50 m为一个调查点。每个调查点仔细观察是否有福寿螺卵块及成螺, 记录每个福寿螺栖息地景观植物种类。

图1 西湖水域的福寿螺形态图Fig. 1 Morphology of apple snails from the West Lake A—C. 雌螺; D. 雄螺, 均为小管福寿螺A—C. female; D. male, four snails are all P. canaliculata
1.2 种类分子鉴定
DNA提取、PCR及测序从福寿螺成螺中取约10 mg腹足、卵块中取单粒卵, 使用血液/细胞/组织基因组DNA提取试剂盒(天根生化科技有限公司)提取样品基因组DNA, 具体步骤参考试剂盒说明书。每个样品获取的DNA溶液均溶解于200 μL的ddH2O中, 使用超微量紫外分光光度仪(Nano-Drop, ND-1000)检测浓度及纯度后, 置于–20℃保存。
使用通用引物对LCO1490(5′-GGTCAACA AATCATAAAGATATTGG-3′)和HCO2198(5′-TAAACTTCAGGGTGACCAAAAAATCA-3′)[23]扩增线粒体COⅠ基因的DNA条形码区段。PCR扩增在25 μL的体系反应中进行, 包括为12.5 μL的TaKaRa PremixTaq, 9.5 μL的ddH2O, 1 μL的基因组DNA, 上下游引物(10 μmol/L)各1 μL。PCR循环条件为94℃预变性3min; 94℃变性30s, 50℃退火30s,72℃延伸1min, 共34个循环; 72℃延伸10min, 4℃终止反应(PCR扩增体系及条件参考Yang等[5])。
使用1%的琼脂糖凝胶检测PCR扩增产物, 将有单一明亮条带的扩增产物送由生工生物工程(上海)股份有限公司纯化并测序。使用Geneious 11.1.5软件结合人工方式对获取的原始序列中的模糊碱基进行校正并剪切引物。
线粒体COⅠ数据集及单倍型分析从Gen-Bank中下载分别于2015年和2016年采集自杭州西湖的福寿螺样品的线粒体COⅠ序列共计38条(表 1)。结合本研究测定的序列, 使用Geneious 11.1.5软件进行全局比对并剪切齐末端后, 形成共计120条序列的602 bp的线粒体COⅠ数据集。使用DnaSP 5软件计算线粒体COⅠ数据集的单倍型, 并使用Geneious 11.1.5软件分析单倍型的多态位点数。
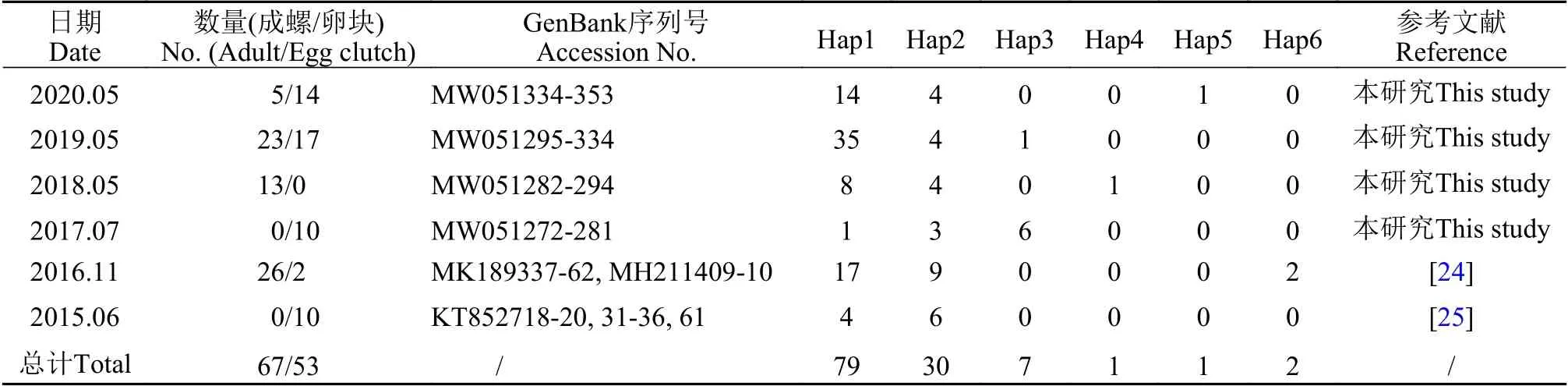
表1 西湖水域福寿螺样品、序列及单倍型分布信息表Tab. 1 Samples, sequences, and haplotype distribution of the apple snails from the West Lake
1.3 杂交渐渗分析
遗传距离及系统发育关系分析由于已有研究表明, 我国野外种群的福寿螺主要包括小管福寿螺、斑点福寿螺和隐秘福寿螺3个种, 因而从GenBank下载了3种福寿螺的线粒体COⅠ序列各3条用于比较分析, 包括阿根廷种群的小管福寿螺(P. canaliculata_AR, GenBank序列号: EF514961),巴西种群的斑点福寿螺(P. maculata_BR, EF514999),日本种群的小管福寿螺(P. canaliculata_JP, AB433765)和斑点福寿螺(P. maculata_JP, AB433777), 中国种群的小管福寿螺(P. canaliculata_CN, KP310268)、斑点福寿螺(P. maculata_CN, KP310490)和隐秘福寿螺(P. occulta_CN1-3, KT852790, KT852789,KP310451)。
利用Geneious 11.1.5软件基于Kimura 2-parameter(K2P)遗传距离模型计算西湖种群福寿螺各单倍型序列及其与参考序列间的相似度。以神秘福寿螺(EF515067)为外群, 分别构建邻接法(Neighbor-joining, NJ)、最大似然法(Maximum likelihood,ML)和贝叶斯法(Bayesian inference, BI)系统发育树。其中, 分别使用MEGA X软件基于K2P模型构建NJ树, 置信值设置为1000次; 利用IQ-Tree 1.6.12构建ML树, 置信值设置为1000次, 其中由内置的ModelFinder软件计算的最佳模型为HKY+F+I;使用MrBayes 3.2.5软件构建BI树, 运行4个马尔可夫(MCMC)链5000000代, 每1000代储存一次树, 利用burnin参数舍弃前25%后, 计算合一树。
种群遗传多样性分析利用DnaSP 5软件计算种群遗传多样性参数, 包括单倍型多样性(Haplotype diversity,Hd)、核苷酸多样性(Nucleotide diversity,π)和核苷酸平均差异数(Average number of nucleotide difference,k), 并进行Tajima’sD中性检验。使用SPSS软件对2018—2020年和2015—2017年的遗传多样性参数进行显著性分析。
已有报道表明, 我国分布福寿螺广泛发生种间遗传渐渗, 且同一卵块的不同个体因多父性或杂交分离而产生不同渐渗型[12]。因而, 本研究针对2015—2020年采集的65头小管福寿螺成螺样品, 开展基于核基因EF1α分型的种间杂交渐渗分析, 具体参考Yang等[12]建立的特异引物多重PCR方法。
2 结果
2.1 西湖水域福寿螺发生情况
在西湖水域福寿螺的发生调研中, 通过目测福寿螺卵块的发生共43个调查点发现了福寿螺, 成螺仅在曲院风荷景区的一个样点发现。成螺个体大,螺高5.36—7.60 cm, 螺宽4.04—5.74 cm, 螺壳较厚,壳面光滑、呈绿色或橄榄绿色, 缝合线深、凹入,螺旋尖的高度低, 壳口内侧颜色红褐色(图 1)。调研结果表明, 福寿螺仅分布于苏堤以西的水域, 其中西里湖西岸、茅家埠北岸、杭州花圃景区及岳湖的曲院风荷景区发生密度较高, 在茅家埠南岸、西里湖南部及乌龟潭发生密度低。在苏堤以东的西湖外湖、北里湖和三潭印月景区均未发现有福寿螺分布。北部的杭州植物园、南部的小南湖和太子湾公园的水域沿岸未发现有福寿螺分布(图 2)。
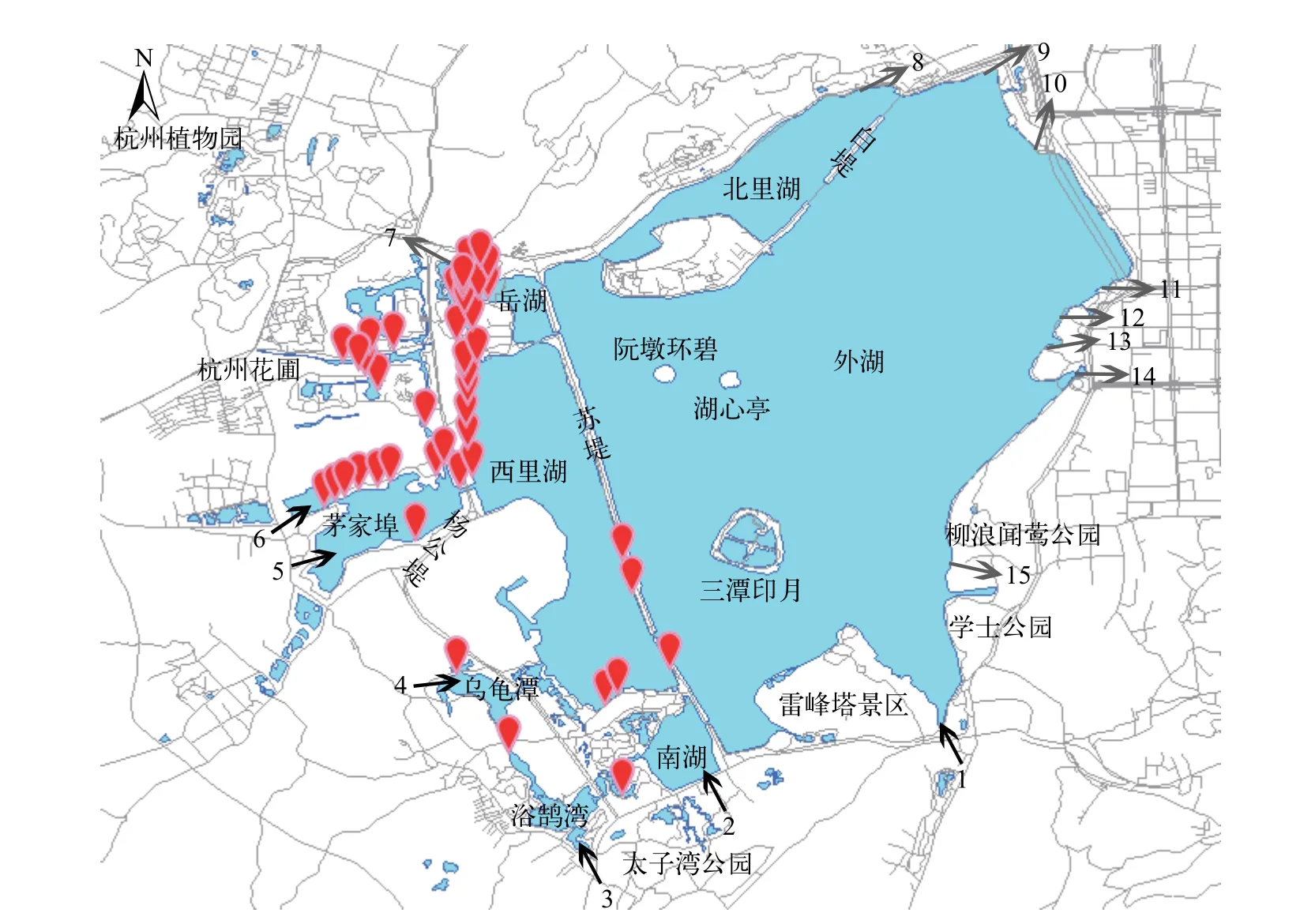
图2 西湖水域福寿螺的分布情况Fig. 2 Distribution of the apple snails in the West Lake坐标符号表示福寿螺的发生地点; 黑色箭头为进水口, 1—6分别为莲花峰、小南湖、浴鹄湾、乌龟潭、茅家埠1、茅家埠2进水口; 灰色箭头为出水口, 7—15分别为岳湖、北里湖、圣塘闸、五公园、一公园、大华饭店、涌金闸、涌金池、柳浪出水口The coordinates indicate the location of the apple snails; the black arrow indicate the inlet of the West Lake, 1—6. Lianhuafeng, Xiaonanhu,Yuhuwan, Wuguitan, Maojiabu 1, Maojiabu 2 the grey arrow indicate the outlet of the West Lake, 7—15. Yuehu, Beilihu, Shengtangzha,Wugongyuan, Yigongyuan, Dahuafandian, Yongjinzha, Yongjinchi, Liulang
西湖水域福寿螺的分布地点均有大型水生及半水生植物覆盖, 没有植物栽培的水域未观察到福寿螺成螺及卵块。其中, 卵块附着的大型挺水植物主要包括: 荷花Nelumbo nucifera(在19个栽培荷花的调查点中的14个点发现福寿螺卵, 14/19)、再力花Thalia dealbata(9/15)、芋Colocasia esculenta(4/16)、黄菖蒲Iris pseudacorus(2/8)、香蒲Typha orientalis(1/4)、萍蓬草Nuphar pumilum(1/4)、水葱Schoenoplectus tabernaemontani(1/5)和菖蒲Acorus calamus(1/5)等。其中, 在荷花和再力花种植区发现福寿螺卵块的比例较高。
2.2 西湖福寿螺种类鉴定
本研究测序获得了于2017—2020年采集自西湖水域的福寿螺线粒体COⅠ序列82条, 序列长度为602 bp, 均已提交至GenBank(序列号MW051272-MW051353)。采集自2015—2020年西湖水域福寿螺的120条线粒体COⅠ序列集共生成6个单倍型,其中Hap1-Hap6分别包含79条、30条、7条、1条、1条和2条序列(表 1)。在6个单倍型序列中共发现了79个多态位点, 占分析位点总数的13.12%(图 3)。

图3 西湖福寿螺线粒体COⅠ基因单倍型变异位点Fig. 3 Variation sites of mitochondrial COⅠ gene haplotype in the apple snails from the West Lake
根据序列相似度, 西湖水域的福寿螺线粒体COⅠ单倍型与GenBank序列可分为3个组。其中,Hap1-5与不同地理种群的小管福寿螺为一组, 相似度≥94.63%, 而与斑点福寿螺和隐秘福寿螺相似度≤89.60%, 其中Hap1和Hap4-Hap5与P. canaliculata_AR的相似度≥99.16%, Hap2-3与P. canaliculata_JP和P. canaliculata_CN的相似度≥97.82%;Hap6与不同地理种群的斑点福寿螺为一组, 序列相似度≥98.32%, 与小管福寿螺序列相似度≤89.93%,与隐秘福寿螺相似度≤94.13%; 隐秘福寿螺序列间为一组(表 2)。
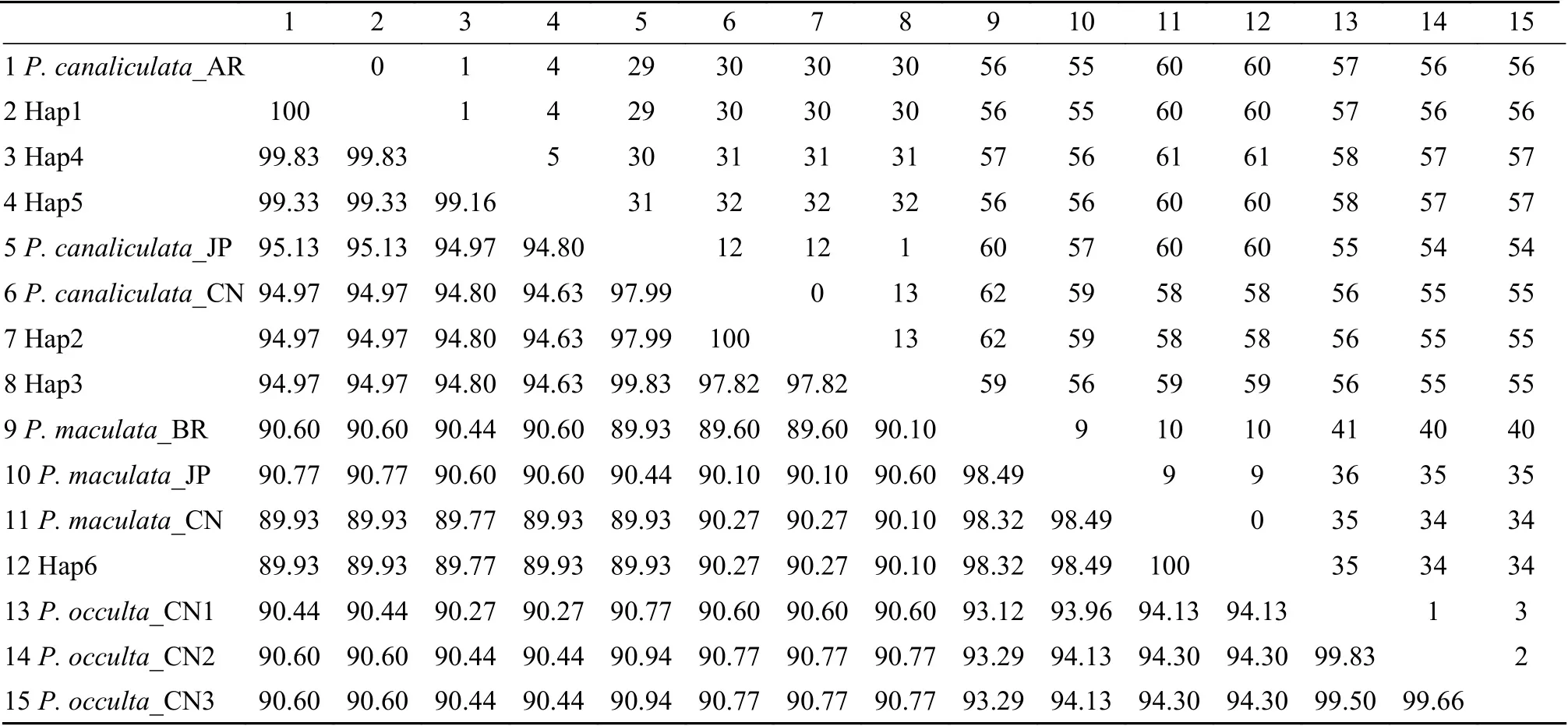
表2 西湖福寿螺单倍型序列与GenBank下载序列的相似性及碱基差异数Tab. 2 Similarity and number of variation sites among the haplotypes and sequences retrieved from GenBank
尽管置信值不同, NJ、ML和BI系统发育树呈现一致的系统分枝结构。其中, Hap1-5与小管福寿螺聚类为一枝, Hap6与斑点福寿螺聚类为一枝, 且具有较高的置信值(图 4)。在小管福寿螺分枝内,Hap1、Hap4-5与P. canaliculata_AR聚为亚枝, 表明具有较近的系统发育关系, 而Hap2-3分别与P. canaliculata_CN和P. canaliculata_JP具有较近的系统发育关系(图 4)。

图4 西湖水域福寿螺的单倍型及GenBank序列构建的系统发育树Fig. 4 The phylogenetic trees reconstructed by the haplotypes of apple snails from the West Lake and the GenBank sequences系统发育分支节点依次为NJ/ML/BI置信值, 仅显示>50%的数值The branch nodes of phylogenetic trees denote NJ/ML/BI bootstrap supports, and only>50% values are displayed
相似度分组与NJ系统发育分枝结果一致表明,Hap1—5与小管福寿螺的基因序列的一致性达94.63%—100%, Hap6与斑点福寿螺的基因序列的一致性达98.32%—100%。综合系统发育关系和遗传距离分析结果表明, 本研究中120个样本包括小管福寿螺118个和斑点福寿螺2个。
2.3 西湖福寿螺种群遗传多样性
西湖水域仅检测到一个斑点福寿螺单倍型, 单倍型多样性低; 小管福寿螺共形成5个单倍型。不同年份的小管福寿螺单倍型多样性Hd为0.229—0.600, 核苷酸多样性π为0.011—0.027, 核苷酸平均差异数k为6.797—16.000; 总体单倍型多样性Hd为0.488, 核苷酸多样性π为0.023, 核苷酸平均差异数k为13.494。统计分析表明, 2018—2020年和2015—2017年间的小管福寿螺种群遗传多样性无显著性差异。中性检验结果显示, 2017年和2019年小管福寿螺种群的Tajima’sD为负值, 其他年份均为正值, 总Tajima’sD为2.334, 表现出显著偏离中性(P<0.05); 2015年和2016年种群的Tajima’sD分别为2.443和2.956, 达到极显著性检验标准(P<0.01),其他年份的Tajima’sD均无显著性(表 3)。
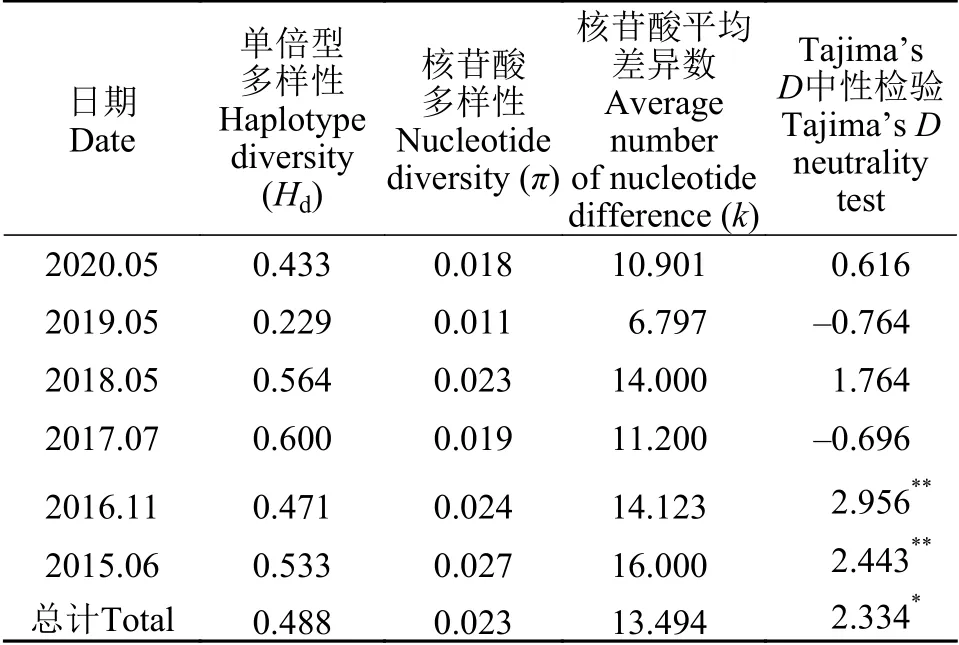
表3 小管福寿螺种群内的遗传多样性分析Tab. 3 Population genetic diversity of P. canaliculata from the West Lake
2.4 杂交渐渗分析
基于特异引物多重PCR的方法针对核基因EF1α进一步检测到3种不同的杂交渐渗型, 包括单一125 bp扩增产物小管福寿螺型(C型), 单一151 bp扩增产物斑点福寿螺型(M型), 及同时生成125和151 bp两条扩增产物小管福寿螺-斑点福寿螺杂合型(B型; 图 5)。经线粒体COⅠ序列分析, 2015—2020年采集自西湖水域的65头小管福寿螺(C型),结合核基因型可分为15头CC型(23.08%)、15头CM型(23.08%)和35头CB型(53.84%)。
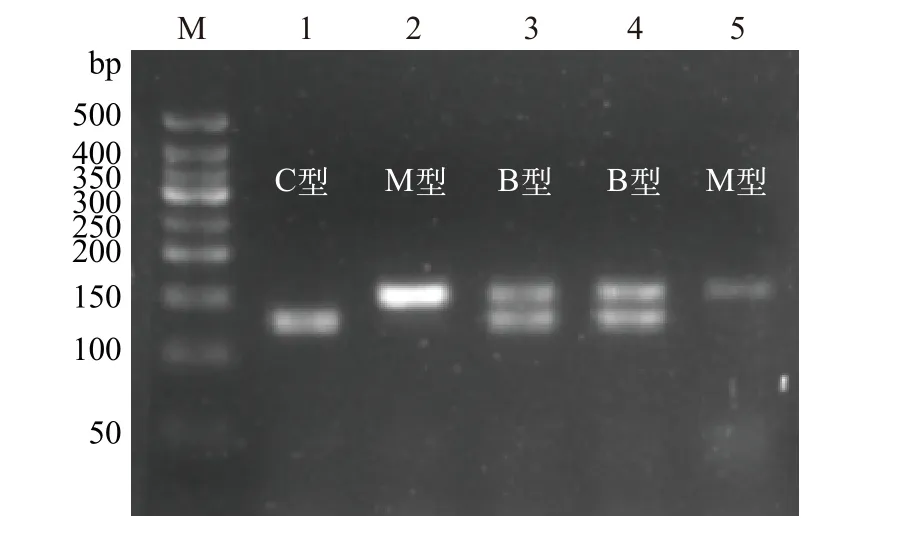
图5 基于EF1α基因多重PCR扩增的西湖福寿螺杂交渐渗型检测Fig. 5 Introgressive hybridization of the apple snails from the West Lake based on EF1α gene multiplex PCR methodM为50 bp DNA ladder, 1—5为西湖水域采集的小管福寿螺样品, 分别为C, M, B, B, M型M. 50 bp DNA ladder, 1—5: samples of P. canaliculata collected in the West Lake, represent C, M, B, M type
3 讨论
福寿螺自19世纪80年代引入我国以来, 已在我国南方各省(自治区、直辖市)广泛扩散, 对湿地系统的生物多样性和功能产生重要影响, 例如危害水生植物、捕食本土淡水生物、改变蜉蝣生物组分变化等[25]。本研究调研了杭州西湖水域福寿螺的发生情况, 以苏堤为界, 福寿螺集中分布在苏堤以西的水域, 西北部发生较密集, 南部堤岸及东南部水域分散分布; 其他水域均未发现福寿螺。调研结果表明, 西湖水域的福寿螺分布范围总体得到了较好的控制。此外, 西湖水域的福寿螺主要分布在有大型水生植物生长的浅水区。水生及半水生植物可为福寿螺在新区定殖提供必要条件, 并对扩散有促进作用[26]。福寿螺取食范围广, 对不同的植物的取食程度差别较大。叶建人等[26]根据取食率与生长率的关系将福寿螺寄主植物分为多食快长型、少食快长型、少食慢长型与多食慢长型。在非农业湿地中, 福寿螺发生与危害程度受植物组成影响较大[27,28]。例如, 福寿螺尤其喜欢营养成分高且干物质含量低的植物, 对苋Amaranthus gangeticus、节节草Commelina diffusa、蕹菜Ipomoea aquatica和浮萍Lemna minor等取食量大; 相反, 对干物质含量高的植物, 如许多常见大型挺水植物包括芦苇Phragmites australis、荷花、芋和萍蓬草等取食量较少[28]。西湖水域分布的大型挺水植物多为福寿螺不喜食或取食后生长速率缓慢的植物, 这可能是限制种群发展的重要因素之一。然而, 在苏堤以东有多处大面积景观植物种植区, 尚未有福寿螺发生,具有较高的定殖风险, 需加强防控。
福寿螺属是所在瓶螺科种类鉴定最困难的类群[1]。基于DNA条形码技术的分子鉴定结果显示,西湖水域分布的福寿螺包括小管福寿螺和斑点福寿螺2种, 其中以小管福寿螺为优势种群。虽然隐秘福寿螺已在我国广泛扩散, 在浙江省亦有发生报道[15,16,29], 尚未在西湖水域检测到该物种。已有研究表明, 斑点福寿螺在我国集中分布在四川盆地和浙江省, 在浙江仅局限于江干区的局部水域[15], 本研究在西湖水域发现斑点福寿螺进一步扩大了我们对其分布范围的认识。当前已报道的基于线粒体COⅠ序列分析, 共在全国检测到24个小管福寿螺单倍型和3个斑点福寿螺单倍型[5,14], 我们在西湖分别检测到的两种福寿螺的其中5个和1个单倍型,具有较低的种群遗传多样性。不同年份群体间的Taijima’sD中性检验结果表明近几年的福寿螺种群总体上达到一个动态平衡, 未经历明显的种群扩张[30]。已有研究表明, 因同一物种不同群体之间存在遗传差异, 引入外来种群可能与已定殖种群进行杂交, 群体之间发生基因交流, 进而影响已定殖种群的遗传多样性和遗传结构[31]。福寿螺已在杭州西湖景区入侵扩散十余年, 通过对近3年(2018—2020)与2015—2017这3年的福寿螺遗传多样性指标进行显著性分析, 包括单倍型多样性Hd、核苷酸多样性π和核苷酸平均差异数k, 发现西湖福寿螺的遗传多样性无显著差异, 表明近6年西湖水域的福寿螺的遗传多样性比较稳定, 推测没有新引入种群。
基因渐渗是提升种群遗传多样性的重要机制之一[12]。核基因EF1α序列中包含快速进化的内含子, 能够为近期进化提供系统发育信息[32,33], 被用于检测福寿螺种间杂交渐渗的分子标记[17]。Yang等[12]基于核基因EF1α序列分析, 发现所检测的单个小管福寿螺的卵块中均能检测到C型、M型和B型3种基因型, 可能与多父性生殖策略有关, 同时幼螺和卵中杂种的比例显著高于成螺, 推测可能与不同杂交渐渗型的卵孵化率和幼螺存活率不同有关。本研究中基于核基因EF1α和线粒体COⅠ基因的种间杂交渐渗检测结果表明, 西湖水域的小管福寿螺发生了较高比例的种间遗传渐渗, 纯种比例为23.08%, 杂种包含53.84%的CB型和23.08%的CM型个体。Yang等[12]针对全国242头小管福寿螺开展种间基因渐渗研究, 发现CM型仅在南部沿海种群中检测到。与全国小管福寿螺相比, 西湖福寿螺中CM型所占比例明显增高。此外, 在日本、韩国野外种群中发现的CM杂交型也很少[12,17], 认为可能与斑点福寿螺耐低温能力显著低于小管福寿螺有关[19,34]。例如, 在日本低温北部仅有小管福寿螺分布, 斑点福寿螺分布于南部及中部且发生比例向高纬度逐渐降低, 杂种相较于斑点福寿螺更向北扩散[17]。西湖福寿螺CM型福寿螺较多, 可能是由于相对于浅水的稻田等湿地系统, 湖泊具有更稳定的生境,且在淤泥底部冬季仍可以保持较高的温度[35]。
福寿螺幼螺和成螺虽具有一定的主动扩散能力, 但自然扩散以随水流传播的方式为主。西湖苏堤东西两侧湖水通过宽5—10 m的六个桥孔相连,受风生流、风浪和进出水口等多种因素综合影响流场流态较复杂[36]。此外, 2003年实施的西湖引水工程(从钱塘江引水至西湖), 设有6个进水口和9个出水口, 福寿螺随水流在湖内扩散及向周边河流、公园和湿地等扩散的风险较大。鉴于福寿螺对景观及湿地生态系统的严重危害, 应加强对景区的发生监测, 并采取措施加强防控。例如可通过设置防螺网, 阻止福寿螺随水流扩散。此外, 应加强防控福寿螺的人为扩散风险, 如在景观植物引种时, 要仔细观察去除种苗茎干上附着的卵块和螺, 设定无福寿螺发生的码头及通行桥孔, 设立警示牌提醒游客请勿携带等。
4 结论
当前, 西湖水域发生的福寿螺集中分布在苏堤以西, 岳湖水域发生密度最高。西湖分布有小管福寿螺和斑点福寿螺两种, 种群遗传多样性低。西湖福寿螺中较不耐低温的CM型比例较高, 可能与湖泊生境冬季淤泥底部可以保持较高的温度有关。西湖景区福寿螺随水流及人为携带在湖内及向湖外水域扩散的风险较高, 因而有必要加强对景区福寿螺的发生监测, 并采取措施防控福寿螺的扩散。
致谢:
感谢高跃、周焱、金钰婕、郭雨涵、刘浩文、刘苏汶、贺超、蒲佳佳在福寿螺发生调研及样品采集中的贡献, 感谢庞利铮在植物鉴定中予以的帮助!
