鳜plin2生物信息学分析、组织表达及其在肝脏脂肪蓄积中的作用
2022-04-13高俊杰梁旭方蔡文静庄武元
高俊杰 梁旭方 蔡文静 庄武元
(1. 华中农业大学水产学院, 华中农业大学鳜鱼研究中心, 武汉 430070; 2. 农业农村部淡水生物繁育重点实验室/农业动物遗传育种与繁殖教育部重点实验室, 武汉 430070)
细胞内脂滴(Lipid droplet, LD)在维持细胞能量稳态、新陈代谢和信号传导中起着不同的作用[1,2]。最近研究揭示了脂滴包被蛋白(Perilipin, PLIN)在LD的发生和调节LD上的蛋白质运输中的重要性[3,4]。PLINs是最丰富的脂滴包被蛋白, 在中性脂质代谢中起着核心作用[5]。哺乳动物的PLIN蛋白质N端具有一个保守的PAT结构域, 最近一些研究表明, PLIN家族蛋白参与了中性脂质储存和利用的调控[6,7]。在哺乳动物中, 具有组织特异性的脂滴包被蛋白已经进化并赋予其不同的功能[8,9]。然而, 大多数关于PLIN蛋白功能的研究都是在哺乳动物系统中进行的, 主要集中在中性脂质代谢上, 而对非哺乳动物脊椎动物的研究相对较少。
在PLIN家族的5个成员中,plin2是一个在大多数组织中普遍表达的50 kD的蛋白质, 在脂滴的形成和稳定, 长链脂肪酸的吸收和脂质积累中起着关键作用[10—12]。Plin2水平受细胞内脂滴和三酰甘油含量的正调节[12]。随着脂肪组织中的脂肪细胞成熟,plin2逐渐被plin1取代, 但在其他组织中plin2仍然作为主要脂滴相关蛋白发挥作用[7]。此外, 一些证据表明plin2在脂肪肝的诱发中起着重要作用[13,14]。研究发现plin2基因缺失可防止肥胖和胰岛素抵抗,并显著降低肝脏甘油三酯和胆固醇水平[15]。因此,plin2蛋白被认为是治疗哺乳动物脂肪肝形成的潜在靶点。
脂肪肝是目前养殖鱼类普遍存在的一种生理病理现象。鳜(Siniperca chuatsi)是主要原产湖北的我国传统名贵肉食性鱼, 肉质丰腴细嫩, 营养价值高, 是我国淡水养殖的理想选择[16]。但是鳜等肉食性鱼类对糖类利用能力较差, 饲料中碳水化合物过多会使其营养成分不平衡和能量摄入过多, 最终导致脂肪肝形成及生长速度下降[17]。对于鱼类plin2的功能及plin2是否可以作为水产养殖中预防脂肪肝的潜在靶点, 目前还没有系统的研究。本研究对鳜plin2基因进行了相关生物学分析和表达特征进行了研究。此外, 我们还探究了在鳜肝脏脂肪蓄积状态下plin2基因表达情况。本研究将有助于进一步了解plin2在鱼类肝脏中发挥的作用, 并为解决水产养殖业中的脂肪肝问题提供一定的理论依据。
1 材料与方法
1.1 实验用鱼及饲养条件
实验用鱼来自湖北武汉华中农业大学鳜研究中心。120尾鳜(80±5) g随机分为2组, 每组设置3个平行, 每缸(350 L)20尾并暂养于华中农业大学循环水系统2周, 水温维持在(23.0±0.5)℃, pH 7.1—7.5,溶氧为7.5—7.8 mg/L, 光照周期为自然光照周期。所有的鱼在驯化后投喂人工饲料。分别投喂含不同碳水化合物饲料, 对照组和实验组分别含0淀粉和20%淀粉, 饲料配方在本实验室先前研究中已描述[18], 所有饲料成分均购自武汉高龙饲料有限公司。在为期8周养殖期间每天早上9:00和下午17:30喂食2次。饲养试验结束饥饿6h后每缸随机捕获6尾鱼, 用MS222(50 mg/L)进行麻醉。获取肝脏组织并在液氮中冷冻后保存于–80℃进行后续实验。
1.2 不同亚型plin2基因序列分析
根据已公开的鳜基因组数据库(http://genomes.igb-berlin.de/cgi-bin/hgGateway?db=sinChu7)获得plin2a和plin2b序列, 通过Editseq[19]和Clustal W2[20]软件将鳜CDS(Coding sequence)序列转为氨基酸序列并将鳜和刺鱼(Gasterosteus aculeatus)其他物种的plin2基因进行氨基酸多重序列比对(表 1)。通过对哺乳动物plin2氨基酸序列比对鳜PAT结构域和11-mer重复结构域进行鉴定, 通过Expert Protein Analysis System (https://web.expasy.org/protscale/) 预测鳜plin2的亲水性。通过GenBank和ENSEMBL数据库调取了人、斑马鱼和刺鱼等3个物种的plin2氨基酸序列, 进行鳜plin2基因共线性分析。
表1 不同物种plin2氨基酸序列信息Tab. 1 Amino acid sequence information of plin2 in different species
1.3 PLIN家族进化树分析
系统进化树重建使用了人(Homo sapiens)、小鼠(Mus musculus)、黑猩猩(Pan troglodytes)、斑马鱼(Danio rerio)、刺鱼(Gasterosteus aculeatus)、罗非鱼(Oreochromis niloticus)、草鱼(Ctenopharyngodon idella)、斑点雀鳝(Lepisosteus oculatus)、腔棘鱼(Latimeria chalumnae)、日本青鳉(Oryzias latipes)、半滑舌鳎(Cynoglossus semilaevis)、红鳍东方鲀(Takifugu rubripes)、攀鲈(Anabas testudineus)、亚马逊帆鱼(Poecilia formosa)和绿河豚(Tetraodon nigroviridis)等其他物种的PLIN家族氨基酸序列,且均从GenBank和ENSEMBL数据库中获得。用ClustalW2对鳜与上述物种的PLIN家族进行氨基酸序列多重比对后, 通过GBLOCKs选取合适的保守区序列用于后续分析。利用ModelFinder寻找最佳的核苷酸替代模型: JTT+G4(BIC), 再通过Phylo-Suite[21]软件使用贝叶斯法重建系统进化树。贝叶斯法分析同时运行2个独立的反应, 每个反应4条马尔科夫链, 共运行100万代。
1.4 鳜plin2基因组织表达检测
从暂养于华中农业大学鳜鱼研究中心循环水系统中随机抽取6尾鳜, 用MS222(50 mg/L)进行麻醉后采集鳜脾脏、脑、肝脏、脂肪、肌肉、肠道、胃、肾脏和心脏等组织样本, 使用RNAiso Plus(TaKaRa)抽提鳜不同组织和肝脏细胞总RNA,通过多功能酶标仪(Bio-Tek)和1%琼脂糖凝胶电泳检测提取RNA的纯度和浓度。采用HiScript®ⅡReverse Transcriptase(Vazyme)反转录合成cDNA,用ChamQ SYBR qPCR Master Mix试剂盒(Vazyme)进行RT-qPCR, 所用引物见表 2。RT-qPCR反应体系: ChamQ SYBR qPCR Master Mix(Vazyme)10 μL,上游引物和下游引物各0.4 μL, 模板cDNA 1 μL, 用ddH2O将反应体系补足到20 μL。反应程序为95℃,预变性5min, 然后40个循环: 95℃变性15s, 57℃退火30s, 72℃延伸45s, 溶解曲线以0.5℃/s速率从95℃降到65℃, 每隔6s采集1次数据信号。

表2 鳜组织表达引物列表Tab. 2 Primers used for the study
1.5 鳜肝脏细胞分离与培养
用麻醉剂MS222(50 mg/L)将鳜麻醉, 剪断尾鳍放血完全后, 用75%的酒精擦拭鱼体。以下操作均在无菌条件下进行, 从腹腔内小心取出肝脏, 并转移至含有DPBS的细胞培养皿中, 清洗血块后用解剖刀将肝组织剪成1—2 mm3左右的组织块, 放入AIM试剂中浸泡1h, 且隔30min换一次试剂。吸走AIM并将肝组织剪碎后转入15 mL无菌离心管中,用0.25%胰蛋白酶28℃恒温消化30min, 每5—7min用含10% FBS的M199培养基中和消化收集细胞1次。细胞悬液经100 mm细胞筛网过滤, 以去除组织碎片, 1000 r/min, 5min收集细胞于15 mL无菌离心管, 并用红细胞裂解液和DPBS清洗2遍以去除血液红细胞。随后1000 r/min, 5min用M199基础培养基漂洗1次, 最后将收集的鳜肝细胞重悬于M199完全培养基中。将细胞接种于细胞培养板, 接种密度约为2×106个细胞/mL, 根据本实验室先前研究结果, 选用0.1 mmol/L浓度的棕榈酸钠处理肝细胞构建高脂模型[22], 并将处理好的细胞放于28℃含5%CO2细胞培养箱中进行培养48h, 在倒置相差显微镜下观察鳜肝脏原代细胞的生长情况。之后提取鳜肝细胞总RNA, 进行RT-qPCR相关检测。
1.6 统计分析
用SPSS Statistics 19.0软件对数据进行分析。以鳜核糖体蛋白L13a (Ribosomal protein L13a,rpl13a)作为内参基因, 采用2–∆∆Ct方法计算相对基因表达水平[23]。单样本t检验(One samplet-test)用来检测数据分布的正态性; 独立样本t检验(Independent samplet-test)用来分析2个样本之间的差异; 单因素方差分析(One-way ANOVA)用来检验多个样本之间的差异性; 数据均以平均值±标准误(mean±SE)表示, 差异显著度为显著(P<0.05)和极显著(P<0.01)。
2 结果
2.1 鳜plin2基因序列分析
将鳜plin2a和plin2b目的序列进行生物学信息比对分析, 其中plin2a基因包含一个1344 bp的ORF(Open Reading Frame), 编码447个氨基酸;plin2b基因包括一个1011 bp的ORF, 编码336个氨基酸。鳜plin2基因序列与其他物种进行氨基酸多重比对显示, 鳜plin2a与刺鱼plin2a具有高度一致性(75%), 与哺乳动物和斑马鱼中报道的plin2相比, 序列同源性为57%—59%。鳜plin2b与刺鱼plin2b同源性下降到55%左右, 而与斑马鱼和哺乳动物plin2报道的氨基酸序列相比同源性处于相对较低水平(34%—40%)。通过分析发现鳜plin2具有与其他同源基因一样的结构域, 表现出一个N-末端PAT结构域和一个11-mer重复结构域。根据哺乳动物plin2的疏水特性, 鳜plin2a和plin2b均没有预测到有助于膜定位的疏水序列的大区域, 这表明鳜plin2内的区域可能在空间上聚集在一起形成疏水分子的识别表面。
2.2 plin2基因共线性分析
对Plin2基因进行共线性分析表明, 鳜plin2a和plin2b分别位于6号和9号染色体, 人类plin2基因位于9号染色体(图 1)。人与鳜plin2a具有共线性的基因共有12个, 但临近基因dennd4c、haus6和zdhhc21排列顺序不同; 人与鳜plin2b具有共线性的基因共有14个, 但临近基因acer2、smu1b、dnajal和aptx排列顺序不同(图 1)。Plin2在斑马鱼中位于15号染色体, 而刺鱼与鳜表现一致, 分化为plin2a和plin2b两个亚型, 分别位于7号和9号染色体(图 2)。斑马鱼与鳜plin2两个亚型都表现为没有临近基因,然而刺鱼plin2两个亚型与鳜的上下游基因则表现出高度的一致性(图 2)。
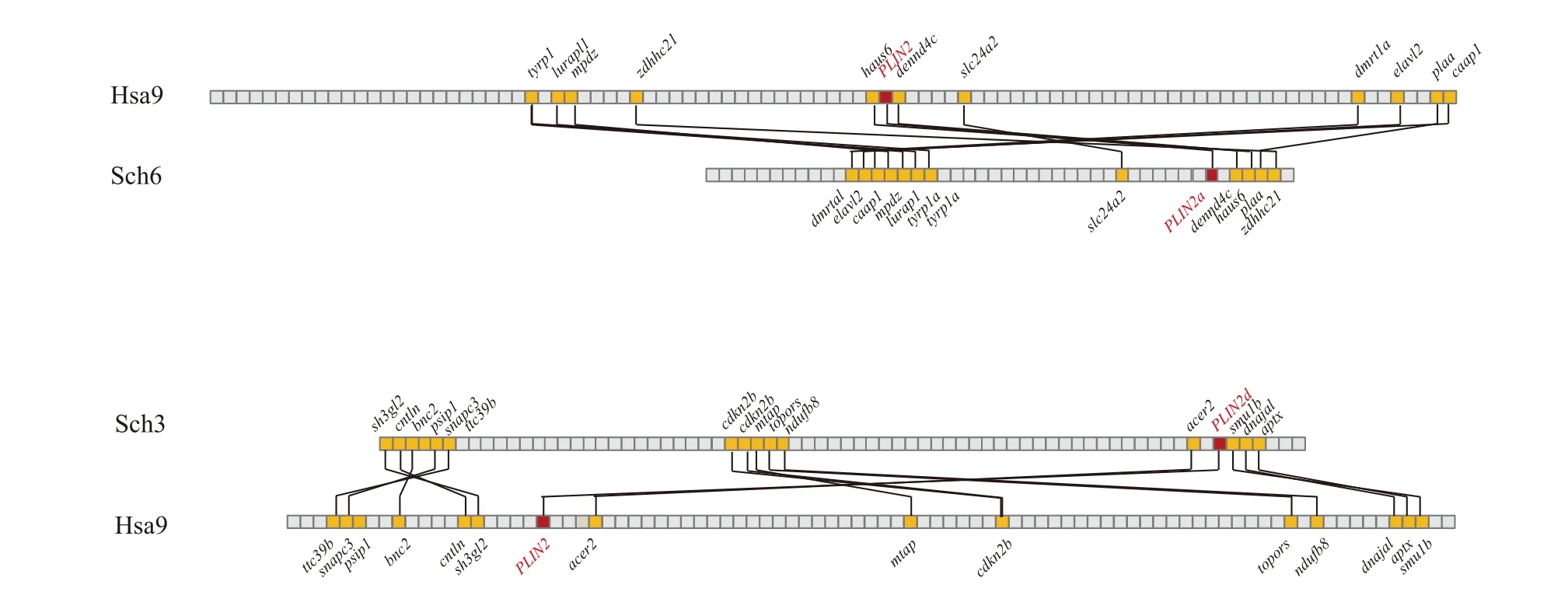
图1 鳜和人plin2基因共线性Fig. 1 Syntenic analysis for plin2 genes in S. chuatsi and H. sapiens
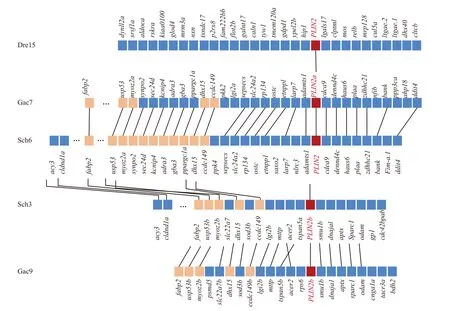
图2 鳜和其他硬骨鱼类plin2基因共线性Fig. 2 Syntenic analysis for plin2 genes in S. chuatsi and other teleost species
2.3 plin2进化分析
使用贝叶斯法重建鳜与其他物种PLIN家族的系统进化树(图 3), 聚类关系主要分为硬骨鱼plin2,哺乳类plin2、plin1、plin3和plin6五个部分, 哺乳动物plin3-plin5分布于其中(图 3a)。系统发育结果显示PLIN家族可以分为两大支, 其中分支Ⅰ包括plin1-plin5, 分支Ⅱ只包括plin6(图 3b)。分支Ⅰ又可以分为plin5、plin1/plin3/plin4及plin2三个分支。其中鳜plin2a与刺鱼、红鳍东方鲀和绿河豚在进化距离上较为接近, 鳜plin2b则与攀鲈最为接近。
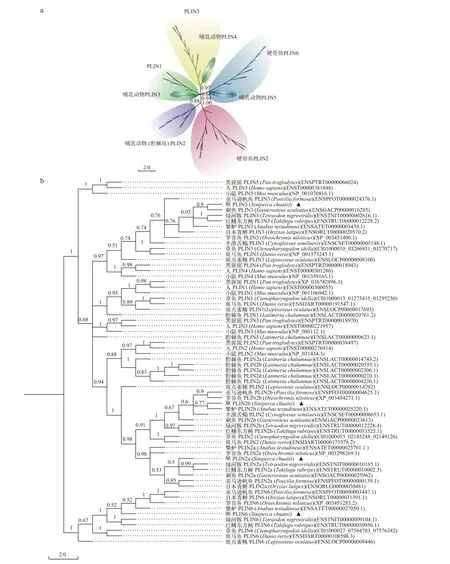
图3 根据PLIN家族氨基酸序列构建的系统进化树Fig. 3 The phylogenetic tree derived from the amino acid sequences of PLIN genesa. PLIN家族聚类关系; b. 鳜和其他物种plin2系统发育分析a. Clustering analysis based on PLIN family; b. Phylognentic tree of S. chuatsi and other species plin2
2.4 鳜plin2基因表达分布
分别对鳜的脾、脑、脂肪、肌、肠、胃、肾和心等9个组织进行plin2a和plin2b基因相对表达分析(图 4)。Plin2a基因在鳜的肝脏中表达最高, 其次是脂肪和脾脏组织, 在其他组织中相对表达较低(图 4A)。相反plin2b基因在鳜的肝脏中几乎不表达, 在肾脏组织中表达最高, 其次是胃、脂肪和脑组织, 在其他组织中相对表达较低(图 4B)。
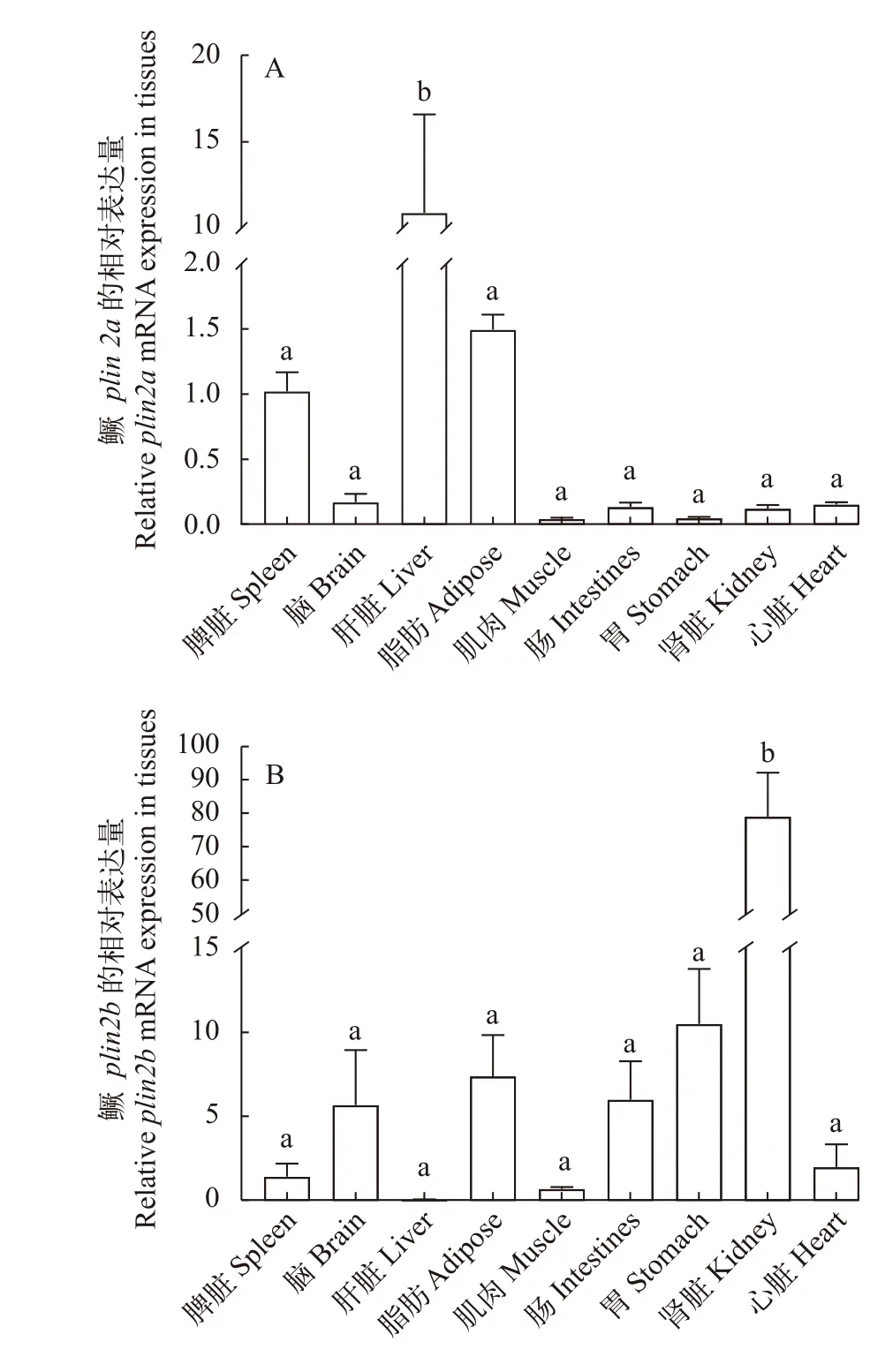
图4 鳜plin2a和plin2b在不同组织中的相对表达量Fig. 4 The relative expression of plin2a (A) and plin2b (B) genes in different tissues of S. chuatsi标准差上方不同字母表示差异显著(P<0.05); 下同Different letters above the error bars indicate significant differences(P<0.05). The same applies below
2.5 高碳水化合物对plin2基因表达影响
我们先前的研究表明, 随着饲料碳水化合物含量增加到20%, 鱼体脂质含量逐渐升高, 同时组织学分析显示, 碳水化合物含量添加20%组肝脏组织中出现大量脂滴, 进而诱发了肝脏脂肪变性。如图 5所示, 与对照组相比, 高糖组肝脏中的plin2a基因转录水平极显著上调(P<0.01)。
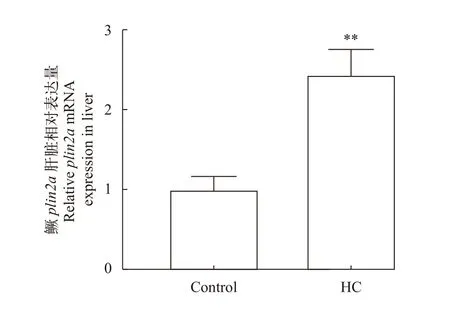
图5 高糖饲料对鳜肝脏 plin2a mRNA 水平的影响Fig. 5 Effects of high-carbohydrate diet on plin2a mRNA of S.chuatsi liver标准差上方**表示差异极显著(P<0.01)**. extremely significant differences (P<0.01)
2.6 棕榈酸钠刺激鳜肝脏细胞对plin2表达影响
用0.1 mmol/L棕榈酸钠构建的鳜肝脏原代细胞其细胞生长状态和形态与正常培养的鳜肝脏原代细胞相比, 没有受到显著影响(图 6)。
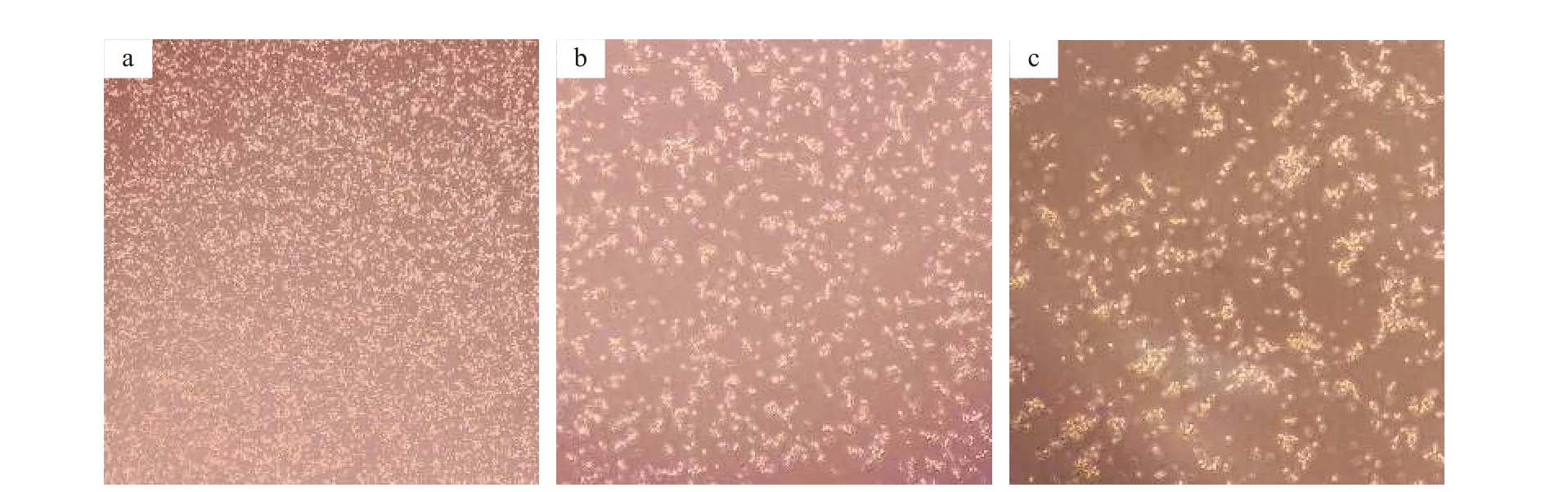
图6 倒置相差显微镜下观察的鳜肝脏原代细胞形态Fig. 6 Observation of S. chuatsi hepatocytes under inverted phase contrast microscopea. 鳜肝脏原代细胞正常培养24h (40×); b. 鳜肝脏原代细胞正常培养48h (100×); c. 鳜肝脏原代细胞经0.1 mmol/L PA刺激培养48h(100×)a. Morphology of hepatocytes cultured for 24h (40×); b. Morphology of hepatocytes cultured for 48h (100×); c. Morphology of hepatocytes cultured with 0.1 mmol/L PA for 48h (100×)
与正常鳜肝细胞相比, 用0.1 mmol/L棕榈酸钠构建的鳜肝脏原代细胞高脂模型中plin2a表达水平显著增加(P<0.05; 图 7)。
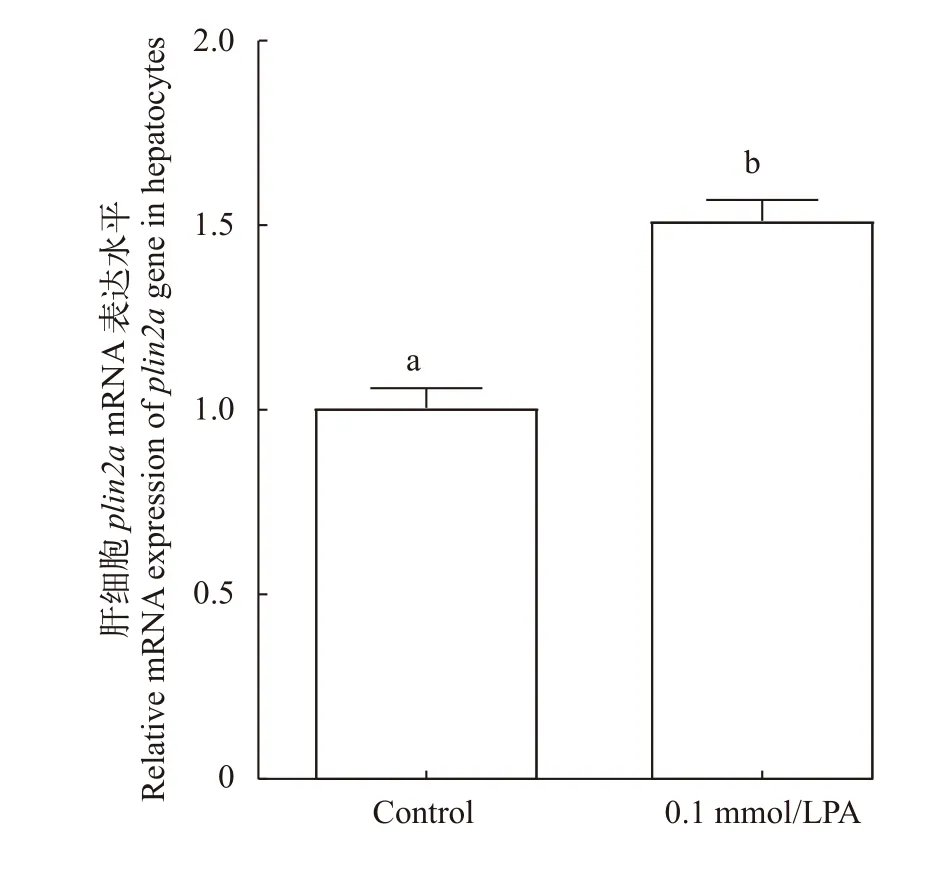
图7 棕榈酸钠刺激鳜肝细胞 plin2a mRNA 水平的影响Fig. 7 Effects of palmitate on plin2a mRNA of S. chuatsi hepatocytes
3 讨论
3.1 鳜plin2的分子特征
脂滴包被蛋白PLIN家族是主要的脂滴蛋白, 在脂滴形成和甘油三酯代谢中起重要作用。与哺乳动物PLIN基因家族相比, 硬骨鱼类PLIN家族的组成更具物种特异性和复杂性[24]。然而, 对于PLIN家族研究主要集中在哺乳动物中, 而在硬骨鱼中对PLIN家族的研究较少[25]。在PLIN家族中,plin2一般位于中性脂滴的多种组织和培养细胞系中, 被认为在哺乳动物脂肪肝的形成中起到至关重要的作用[26]。本研究对鳜plin2基因的序列和组织表达情况进行了鉴定和分析。此外, 本研究探究了在鳜肝脏脂肪处于蓄积状态下plin2的表达变化情况。
先前研究表明, 斑马鱼和穴居鱼保持着plin2的一个拷贝, 与人类的plin2同源[27]。而在硬骨鱼基因组复制过程中产生的plin2基因, 如刺鱼和亚马逊帆鱼保留了两个亚型, 分别命名为plin2a和plin2b[24]。在鳜基因组中, 经过分析比对发现与刺鱼和亚马逊帆鱼相同, 产生了plin2a和plin2b两个亚型, 而plin2的加倍现象, 可能会导致其在鳜糖脂代谢中的作用更加复杂。同源性分析还表明, 鳜plin2a基因与刺鱼plin2a基因具有高度的同源性, 但鳜plin2b与刺鱼plin2b基因同源性并不是很高。在鳜plin2a和plin2b中发现了包括PAT结构域和11-mer重复结构域在内的人类PLIN蛋白的定义特性。高度保守的N-末端PAT结构域被认为参与了plin2的脂滴稳定和蛋白酶体降解; 11-mer重复结构域可能与C-末端结构域协同调节乳脂分泌有关[5,27]。这些结构域的保守性表明, 鳜plin2可能是针对脂滴, 其功能可能与甘油三酯的储存和动员有关。蛋白质的亲疏水性对于其折叠具有重要作用, 在我们对鳜plin2蛋白亲疏水性预测后, 发现鳜plin2两个亚型都不具有大面积疏水或亲水域。有研究发现在对小鼠plin2以及plin3蛋白序列进行疏水预测中, 其N端PAT结构域和11-mer重复区域中观察到疏水性/亲水性片段的交替模式[7,12]。同时2种蛋白质未预测到大段的疏水序列, 这表明在空间上, 其蛋白质中的区域可能汇聚在一起从而形成了较大的疏水性配体识别表面发挥功能。
3.2 鳜plin2的系统发育分析
聚类分析将PLIN家族大致分为5类,plin2明显地分为硬骨鱼和哺乳动物两部分, 其余PLIN家族分类并不十分明显, 这可能是由于物种选择数目不多的问题。系统发育分析主要将PLIN家族分为两大支, 其中分支Ⅰ包括plin1-plin5, 分支Ⅱ只包括plin6。分支Ⅰ进化分析显示鳜plin2a与刺鱼、红鳍东方鲀和绿河豚在进化距离上较为接近, 鳜plin2b则与攀鲈最为接近。脊椎动物PLIN基因家族是在脊椎动物辐射的基础上进行了两轮全基因组复制而产生的, 共有4个基因:plin1、plin2、plin4-plin5-plin3集群祖先和plin6[24,29]。其中plin6作为PLIN家族的额外分支, 是硬骨鱼特有的[24]。经过一系列串联复制和分化后产生了现在PLIN家族中的plin3、plin4和plin5基因, 完成了人类PLIN家族的5个基因库。在硬骨鱼基因组复制后, 4个PLIN家族基因变成了8个基因, 除plin2外其余的基因都恢复为单一拷贝, 本研究对鳜PLIN系统发育重建中也支持上述发现。
3.3 鳜plin2的组织表达分布
一般认为plin2存在于中性脂滴的多种组织和培养细胞系中, 包括乳腺、肝脏、骨骼肌、小鼠脂肪细胞和人肝癌细胞等[2,30]。本研究结果表明鳜plin2的2个亚型的组织表达情况有很大差异,plin2a基因在鳜的肝脏中表达最高, 其次是脂肪和脾脏组织。然而plin2b基因在鳜的肝脏中几乎不表达, 与其他组织相比, 在肾、胃、脂肪和脑组织中的表达水平更高。基于plin2组织表达结果, 我们推测plin2a和plin2b在鳜脂滴形成和脂肪蓄积中的功能发生了分化,plin2a可能在鳜肝脏脂肪合成和分解中发挥更加重要的功能, 而plin2b可能主要在肾、胃、脂肪等其他组织发挥作用。
3.4 鳜plin2与肝脏脂肪蓄积密切相关
鳜等肉食性鱼类对于糖类物质利用能力差, 本实验室先前研究表明当饲料中过量添加淀粉(20%)会造成鳜肝脏脂肪蓄积[18]。为了进一步探究plin2a对鳜肝脏脂肪蓄积的影响, 首先我们通过过量投喂碳水化合物诱导了鳜肝脏中的脂质含量增加。另外, 哺乳动物体内plin2的丰度与细胞内脂质水平直接相关, 而plin2水平的升高则与脂肪堆积引起的疾病有关[28]。研究表明, 与正常人的肝细胞相比, 脂肪性肝病患者肝细胞中plin2的表达水平上调[11,14]。在喂食高脂肪或酒精饮食的小鼠中, 在酒精性肝病的实验模型中,plin2表达上升并且包裹大量的脂滴[31]。因此, 我们同时构建了鳜肝细胞高脂模型研究plin2a的作用。本研究参考了Yang等[32]利用棕榈酸钠诱导了草鱼肝细胞脂肪蓄积以及实验室先前工作[22],采用棕榈酸钠添加剂来诱导鳜肝细胞的脂肪蓄积,先前本实验室研究表明用0.1 mmol/L PA对鳜肝脏原代细胞进行刺激后, 其甘油三酯水平显著增加且脂滴荧光强度增加, 因此我们选择该浓度进一步研究plin2功能作用[22]。我们的结果表明, 与不添加淀粉组相比, 鳜肝脏plin2a的mRNA表达水平极显著增加。在细胞水平上同样发现通过棕榈酸钠构建的鳜肝细胞高脂模型中, 细胞内plin2a的表达水平显著增加。有研究表明,plin2作为肝脏组织中最丰富的脂滴蛋白, 与脂肪酸摄取以及脂解关系密切[11]。当肝脏敲除plin2的小鼠饲喂高脂饲料后, 其肝脏脂肪水平降低, 同时脂肪合成相关基因的表达受到抑制[14,15]。在哺乳动物中plin2过量表达会造成肝细胞中甘油三酯沉积, 从而导致脂肪变性。而抑制plin2表达可能在防止肝脏脂肪蓄积具有一定作用[31]。基于上述发现, 我们推测plin2a可能影响肝脏中脂肪合成和脂滴增加, 是鳜肝脏脂肪蓄积的重要调节因子。
综上所述, 我们在本研究中鉴定出鳜plin2的2个亚型, 生物信息学分析和组织表达分布情况表明不同亚型之间可能出现功能分化, 当鳜肝脏处于脂肪蓄积状态下plin2a表达上升, 说明该亚型可能在肝脏脂质代谢中行使一定的功能。因此, 需要进一步研究plin2对鳜肝脏脂质代谢的作用机制, 为阐明和预防鳜脂肪肝形成提供一定的理论依据。
