冬凌草甲素的药理活性及作用机制研究
2022-04-13王淑静张家宁
付 玉,王淑静,张家宁*
(1. 哈尔滨商业大学 药学院,黑龙江 哈尔滨 150076;2. 厦门医学院 基础医学部,福建 厦门 361023)
冬凌草甲素(oridonin)是唇形科香茶菜属冬凌草的主要成分。大量研究表明,冬凌草甲素具有多种药理活性,如抗肿瘤、抗炎、神经保护及抗菌等。其较强的抗肿瘤活性成为国内外学者的研究热点,现已发现冬凌草甲素对口腔癌[1]、卵巢癌[2]、结肠癌[3]及乳腺癌[4]等有显著的抑制作用,其对急性髓细胞白血病的治疗已进入临床试验阶段[5]。
1 冬凌草甲素的理化性质
冬凌草甲素是一种贝壳杉烷型二萜类化合物。分子式为C20H28O6,相对分子质量为364.44。为无色棱柱状结晶,味道极苦,不溶于水,微溶于乙醚、甲醇、乙醇等有机溶剂。冬凌草甲素有良好的稳定性,在人体内有良好的吸收、分布、代谢、排泄和安全性(ADME/Tox)。研究表明,冬凌草甲素化学结构中,与环外亚甲基共轭的环戊烷酮结构为其抗癌活性中心(结构见图1),此活性中心的环外双键变成饱和键或裂环时,则抗癌作用消失[6]。
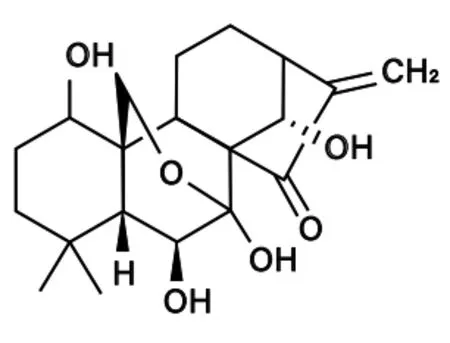
图1 冬凌草甲素活性中心结构
2 冬凌草甲素的药理作用
冬凌草甲素是冬凌草的主要成分,1967年首次被鉴定,1973年合成[7]。大量研究表明,冬凌草甲素在肿瘤治疗、抗炎及神经保护等方面取得了重大进展[8]。
2.1 抗肿瘤作用
研究表明,冬凌草甲素对肿瘤有很强的治疗作用,且不易产生耐药性[9]。其具有广谱抗肿瘤活性,可抑制多种肿瘤细胞的增殖、调控肿瘤细胞凋亡、诱导肿瘤细胞自噬、抑制肿瘤细胞迁移、侵袭和转移等。
2.1.1 抑制肿瘤细胞增殖 肿瘤细胞在人体内具有持续增殖性,无限增殖是恶性肿瘤细胞的生物学特性之一,是区别于正常细胞和良性肿瘤细胞最显著的生物学特征。冬凌草甲素可通过调控细胞周期来阻断多种肿瘤细胞的增殖。细胞周期中G1到S和G2到M是调控肿瘤细胞生长最为重要的两个阶段,这两个阶段的分子水平变化复杂活跃,易受多种因素影响。冬凌草甲素可将胃癌细胞SGC-7901阻滞在G2/M期,抑制SGC-7901细胞增殖,诱导细胞凋亡和自噬[10]。黄坷坷等[11]研究发现,冬凌草甲素可将食管癌细胞KYSE-150、KYSE-450阻滞在G2/M期,抑制食管癌细胞增殖。此外,冬凌草甲素可通过磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)信号通路诱导雄激素非依赖型前列腺癌细胞PC3和DU145的G2/M细胞周期阻滞[12]。其还可通过阻断Akt活性,诱导食管鳞状细胞癌(ESCC)细胞阻滞于G2/M期,抑制ESCC细胞的生长[13]。研究发现,冬凌草甲素依赖于半胱天冬蛋白酶(caspase)的激活来切割人体抑癌基因p53诱导的E3泛素-蛋白连接酶(Mdm2)以产生Mdm2-p60,Mdm2-p60的产生稳定了p53,并导致p53的积累,使p53持续激活,诱导儿童神经母细胞瘤(NB)细胞周期阻滞[14]。
2.1.2 诱导肿瘤细胞凋亡 细胞凋亡途径通常包括线粒体凋亡途径、死亡受体凋亡途径和内质网凋亡途径。研究发现冬凌草甲素可通过多种信号通路及作用机制促进肿瘤细胞凋亡。最常见的是线粒体凋亡途径及内质网途径。
张亚男等[15]发现冬凌草甲素作用于人宫颈癌He1a细胞后,促凋亡蛋白(Bax)以及细胞色素c(Cyt-c)表达增加,抗凋亡蛋白(Bcl-2)表达和Bcl-2/Bax比值降低,从而诱导依赖caspase-3的线粒体凋亡途径。冬凌草甲素还可降低肝癌细胞HepG2线粒体膜电位,提高细胞内活性氧水平,诱导凋亡相关蛋白的表达,促进HepG2凋亡[16]。冬凌草甲素通过诱导聚腺苷二磷酸核糖聚合酶(PARP,一种DNA修复酶)的裂解,促进HepG2细胞线粒体发生氧化还原变化,进而导致HepG2细胞凋亡[17]。
冬凌草甲素可上调内质网应激相关蛋白葡萄糖调节蛋白78(GRP78)、磷酸化蛋白激酶R样内质网激酶(p-PERK)、磷酸化真核翻译起始因子eIF2的α亚基(p-eIF2α)和CCAAT增强子结合蛋白(CHOP)的表达水平,通过内质网凋亡途径发挥促进人喉癌细胞Hep-2和TU212的凋亡作用,4-苯基丁酸(4-PBA,内质网应激抑制剂)或CHOP基因敲除可拮抗其诱导的细胞凋亡[18]。曹世杰等[19]研究发现其与西妥昔单抗联用,可通过ROS介导线粒体凋亡途径及内质网凋亡途径诱导人喉癌细胞Tu212凋亡。
此外,冬凌草甲素还可通过激活磷酸化c-Jun氨基末端激酶/原癌基因c-Jun(p-JNK/c-Jun)通路,诱导人胃癌细胞HGC-27的凋亡[20];可激活腺苷酸激活蛋白激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(AMPK/Akt/mTOR)信号通路,诱导人肺癌细胞A549的凋亡并降低其对顺铂的耐药性[21]。
2.1.3 诱导肿瘤细胞自噬 研究发现冬凌草甲素能通过促进或抑制肿瘤细胞自噬过程发挥抗肿瘤作用。冬凌草甲素通过降低自噬效应蛋白Beclin-1的表达水平,显著抑制卵巢癌细胞(A2780CP和SKOV3/DDP)自噬,并提高卵巢癌细胞对顺铂诱导凋亡的敏感性[22]。体内与体外研究表明,冬凌草甲素可通过增加自噬标志物Beclin-1、LC3-II蛋白表达水平,并降低自噬相关蛋白LC3-I、p62蛋白表达水平,促进自噬过程,调控腺苷酸激活蛋白激酶/哺乳动物雷帕霉素靶蛋白/人自噬相关蛋白1(AMPK/mTOR/ULK1)信号通路,诱导结肠癌细胞DLD-1凋亡。使用自噬抑制剂3-甲基腺嘌呤(3-MA)后,则阻止自噬,降低了冬凌草甲素对DLD-1细胞的增殖抑制作用[23]。冬凌草甲素还可通过激活c-Jun N-末端激酶途径和抑制PI3K信号传导增加Beclin-1、LC3-II蛋白表达水平,诱导胰腺癌自噬介导的细胞死亡[24]。
2.1.4 抑制肿瘤细胞的迁移、侵袭和转移 冬凌草甲素可通过抑制上皮细胞向间充质细胞的转化,抑制肿瘤细胞的迁移、侵袭和转移。上皮-间质转化(EMT)是肿瘤发生转移的重要原因,EMT具有上皮标志物E-钙黏素(E-cad)的丢失和间充质标志物波形纤维蛋白(vimentin)的获得两大特征。史国军等[25]研究发现冬凌草甲素通过增强E-cad蛋白表达,下调vimentin蛋白表达,从而抑制人肝癌细胞SMMC-7721增殖、迁移和侵袭。冬凌草甲素通过抑制磷脂酰肌醇3激酶/蛋白激酶B/糖原合成酶激酶3β(PI3K/Akt/GSK-3β)信号通路,阻断了黑色素瘤A375细胞的迁移和侵袭;抑制细胞外调节蛋白激酶(ERK)信号通路,阻断人非小细胞肺癌细胞H1975的迁移、侵袭和黏附;阻断mTOR信号通路的磷酸化,降低了卵巢癌细胞SKOV3的迁移和侵袭[26-27, 2]。
2.1.5 调控肿瘤细胞能量代谢 肿瘤细胞与正常细胞能量代谢不同,肿瘤细胞即使在氧气充足的情况下也倾向于糖酵解供能,即有氧糖酵解(Warburg效应)[28]。Warburg效应产生与缺氧诱导因子1α(HIF-1α)过度表达、癌基因(cMyc,Ras)激活、肿瘤抑制因子[突变型p53、突变型抑癌基因PTEN、微小RNA(miRNA)和具有抑制功能的去乙酰化酶sirtuin]功能丧失等肿瘤微环境的改变有关,并依赖于激活PI3K/Akt/mTOR或失活抑癌基因/腺苷酸激活蛋白激酶(LKB1/AMPK)信号通路[29]。
HIF-1α可通过上调葡萄糖转运蛋白(如GLUT1和GLUT3),调控糖酵解酶[己糖激酶2(HK2)、磷酸果糖激酶(PFK)等)]及单羧酸转运蛋白4(MCT4)等的表达,抑制氧化磷酸化(OXPHOS),进一步增加糖酵解通量,促进肿瘤细胞的生存和生长[30]。因此,HIF-1α是肿瘤能量代谢的重要靶点。研究表明,冬凌草甲素通过降低HIF-1α的表达,抑制糖酵解通量,同时降低血管内皮因子的表达,发挥抑制乳腺癌细胞MDA-MB-231和4T1的血管生成,从而抑制乳腺癌细胞增殖作用,此机制同样也存在于冬凌草甲素抑制胆囊癌细胞GBC-SD上皮间质转化和细胞迁移中[31-32]。
PI3K/Akt信号通路的异常活化是肿瘤糖代谢改变的主要机制,PI3K/Akt信号通路下游的转录蛋白调控糖代谢的多个进程,PI3K/Akt在细胞因子刺激下,上调GLUT1活性,促进葡萄糖的摄取,此外,PI3K/Akt通过抑制HK2和PFK的表达来调节糖酵解速率,在不激活线粒体OXPHOS的情况下促进糖代谢[33]。PI3K/Akt信号通路活化后也作用于下游分子mTOR,影响HIF-1α的表达,进而影响肿瘤细胞有氧糖酵解过程。研究表明冬凌草甲素通过增强大鼠心肌细胞H9c2中的miR-214,调节PI3K/AKT/mTOR通路,抑制HIF-1α的表达,抑制糖酵解过程,从而诱导缺氧引起的H9c2细胞凋亡和自噬[34]。冬凌草甲素可通过阻断mTOR信号通路的磷酸化,降低糖酵解过程而抑制卵巢癌细胞SKOV3的迁移和侵袭[2]。
此外,冬凌草甲素还能通过在体外和体内显著下调GLUT1和单羧酸转运蛋白1(MCT1)的表达水平,抑制葡萄糖摄取和减少乳酸输出,降低糖酵解产能。然而,研究发现当阻断葡萄糖供应时,冬凌草甲素处理的结直肠癌(CRC)细胞中的ATP水平并未降低,研究认为冬凌草甲素诱导的自噬过程成为癌细胞中ATP主要来源,LC3-II检测和透射电子显微镜分析结果证实了自噬产能现象,冬凌草甲素治疗后p-AMPK迅速失活,导致GLUT1下调,也诱导癌细胞自噬,提示能量代谢与自噬过程等能影响肿瘤细胞的生理过程,冬凌草甲素可从多个机制来发挥抗肿瘤作用[35]。
2.2 抗炎作用
炎症通常发生在细菌、病毒或真菌等感染性微生物侵入人体,寄居于特定组织或在血液中循环。炎症也可能在组织损伤、细胞死亡、癌症、缺血和变性等过程中发生。与人类病理状况相关的炎性介质包括干扰素,白介素(IL),趋化因子,前列腺素,核因子κB(NF-κB)等。常与NF-κB信号通路、Toll 样受体 4(TLR4)相关信号通路的调节有关。
据文献报道,冬凌草甲素发挥抗炎作用主要与抑制NF-κB、TLR4相关信号通路,促进NLRP3炎症小体的激活等有关。冬凌草甲素对糖尿病肾病(DN)的保护作用与其抗炎作用密切相关。TLR4是先天免疫和炎症反应的主要介质,参与DN的发展。实验结果表明冬凌草甲素通过TLR4/p38丝裂原活化蛋白激酶(MAPK)和TLR4/NF-κB信号通路,能显著下调TLR4的过度表达,抑制NF-κB抑制蛋白α(IκBα)、p65和p38磷酸化及NF-κB与DNA结合活性[36]。冬凌草甲素剂量依赖性地降低小鼠子宫内膜上皮细胞(mEEC)中TNF-α、IL-1β和IL-6的表达,抑制脂多糖(LPS)诱导的TLR4/NF-κB信号通路的激活,有效地减轻LPS诱导的子宫内膜炎[37]。此外,冬凌草甲素还可通过阻断TNF-α激活的MAPK信号通路,抑制NF-κB的活化,发挥抑制血管炎症的作用[38]。其还可显著降低d-半乳糖胺(d-GalN)/LPS诱导的小鼠急性肝损伤(ALI)模型中NLRP3、caspase-1、IL-18和IL-1β的表达,降低炎症反应发挥保护作用[39]。
2.3 神经保护作用
神经退行性疾病是一组病因多样的异质性疾病,往往与遗传、环境、年龄、代谢、感染等相关[40]。神经退行性疾病包括阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病、多发性硬化症和朊病毒病等。神经元细胞损伤或死亡是各种神经退行性疾病发生、发展的重要因素。氧化应激、神经炎症、线粒体功能障碍和细胞凋亡是导致神经病变的主要途径[41]。
大脑中普遍存在高表达的脑源性神经营养因子(BDNF)及其受体酪氨酸激酶受体B(TrkB),BDNF/TrkB通路已被证明能介导神经元的存活和分化,在学习和记忆中起调节作用。冬凌草甲素可激活BDNF/TrkB通路,增加AD模型小鼠海马中磷酸化-环磷酸腺苷反应元件结合蛋白(p-CREB)的表达,并增加AD模型小鼠突触小体中突触后致密物95(PSD-95)和突触素的表达,并促进线粒体的活性,发挥神经保护作用[42]。康梅娟等[43]采用1-甲基-4-苯基吡啶离子(MPP+)诱导人神经母细胞瘤细胞SK-N-SH建立PD模型,发现冬凌草甲素可抑制模型细胞凋亡和氧化应激,发挥神经保护作用。采用MPP+诱导神经生长因子(NGF)分化的PC12细胞建立PD模型,采用红藻氨酸(KA)诱导NGF分化的PC12细胞建立癫痫模型,冬凌草甲素预处理可降低活性氧生成,提高谷胱甘肽过氧化物酶、谷胱甘肽还原酶和过氧化氢酶活性,并降低相关炎性因子的表达,增加多巴胺和谷氨酰胺的含量,发挥神经保护作用[44]。NLRP3炎症小体被认为是创伤性脑损伤(TBI)后炎症和神经元死亡的重要因素,冬凌草甲素能降低NLRP3炎症小体的释放,保护血脑屏障(BBB)的完整性,减轻神经功能缺损,有效阻止TBI小鼠的炎症反应和神经元凋亡[45]。随着研究的不断深入,冬凌草甲素有望成为治疗人类神经退行性疾病的药物。
2.4 其他药理作用
冬凌草甲素具有抗真菌作用。白色念珠菌是一种酵母菌,能引起高死亡率真菌感染,是一种典型的耐唑类真菌。将冬凌草甲素与三种唑类药物,即氟康唑(FLC)、伊曲康唑(ITR)和伏立康唑(VOR)联合应用,外排泵抑制试验显示FLC、ITR和VOR的最低抑菌浓度(MIC)显著降低。表明唑类药物与冬凌草甲素的联合应用具有很强的协同作用,能促进耐唑类真菌对唑类药物的敏感性[46]。
冬凌草甲素具有抗菌活性。能通过影响耐甲氧西林金黄色葡萄球菌(MRSA)细胞膜和细胞壁的通透性、蛋白质代谢及细胞代谢和形态,发挥对MRSA的抗菌活性[47]。
冬凌草甲素具有心肌保护作用。冬凌草甲素作为NLRP3抑制剂可降低小鼠心肌梗死后IL-1β和IL-18的表达,改善心肌纤维化,重塑不良心肌细胞结构,达到心肌保护作用,维护心功能[48]。
冬凌草甲素能抑制类风湿关节炎成纤维样滑膜细胞(RA-FLS)增殖,并通过提高Bax和caspase-3蛋白表达水平,抑制Beclin-1蛋白水平,诱导RA-FLS凋亡与自噬[49]。
3 小结
冬凌草甲素由于其广泛的药理活性和相对安全性,近年来受到越来越多的关注。冬凌草甲素具有多种潜在靶点,可通过不同的信号通路,同时发挥多种生物学效应,对于多种疾病的预防和治疗有重要意义,尤其是其具有广谱的抗肿瘤特性,可通过多种机制抑制肿瘤生长、转移、耐药,促进肿瘤凋亡、自噬等,具有较好的开发前景。但冬凌草甲素由于水溶性较差、生物利用度较低,应用开发受到一定限制,基于冬凌草甲素的结构特性,许多冬凌草甲素衍生物不断被设计、合成,使冬凌草甲素成为癌症治疗候选药物之一,而且在治疗癌症以外的疾病也显示出了良好的效果。因此,冬凌草甲素及其衍生物具有较好的临床应用前景及应用开发价值。
