DX保存液与甘油保存液对人角膜基质透镜保存效果的比较
2022-04-13田乐李德卫彭予苏张飞飞陈敏
田乐 李德卫 彭予苏 张飞飞 陈敏
山东第一医科大学附属青岛眼科医院 山东第一医科大学附属眼科研究所 山东省眼科学重点实验室-省部共建国家重点实验室培育基地,青岛 266071
飞秒激光小切口角膜基质透镜取出术(femtosecond small incision lenticule extraction,SMILE)目前已成为主流的角膜近视矫正手术,手术的广泛开展为健康人角膜基质透镜的再利用提供了丰富的标本来源,使屈光手术“由减法变为加法”成为可能。有研究尝试对1例一侧近视眼SMILE术中取出的角膜基质透镜植入另一侧远视眼角膜基质中,随访1个月发现可安全、有效地对屈光参差患者进行个性化矫正,可预测性好[1]。此外,在对圆锥角膜基质制作囊袋后精确植入角膜基质透镜也取得了较好的临床效果[2]。近年来有较多关于健康人角膜基质透镜临床应用的研究报道,如飞秒激光辅助的角膜基质透镜植入术联合角膜交联术对于初期圆锥角膜是可行的治疗选择,但目前仍需要长期随访观察术后效果[3]。可见人角膜基质透镜的再利用不仅可以对远视眼进行矫正,也可用于圆锥角膜的治疗,因此,人角膜基质透镜的保存逐渐成为关注的焦点。有研究将SMILE术中取出的角膜基质透镜在液氮中低温冷冻保存96 d后植入远视眼角膜基质囊袋内,随访发现术后未发生排斥反应且矫治效果好[4]。此外,对于各种角膜感染导致的深层角膜溃疡和角膜穿孔,角膜移植术是可选择的最佳治疗方式;但目前我国仍存在角膜供体严重不足的现状,能否利用SMILE术后取出的角膜基质透镜作为一种替代供体材料值得进一步研究。探讨人角膜基质透镜的合理保存方法无疑为拓展角膜疾病的治疗方法提供了新的思路。本研究拟比较DX保存液和无水甘油保存液对SMILE术中取出人角膜基质透镜的保存效果。
1 材料与方法
1.1 材料
1.1.1材料来源及分组 连续收集2019年2—5月于山东第一医科大学附属青岛眼科医院行SMILE手术的中高度近视患者30例60眼的完整角膜基质透镜60个,其中男18例36眼,女12例24眼;患者年龄18~35岁,平均(26.71±5.06)岁;角膜基质透镜厚度为80~114 μm,平均(99.26±9.20)μm。采用随机数表法将术中获取的新鲜人角膜基质透镜分为正常对照组、DX保存液保存1 d组、DX保存液保存1周组、甘油保存1 d组、甘油保存1周组和甘油保存2周组,每组10个,其中正常对照组不做保存处理,其余各组依照分组的不同分别采用DX保存液和甘油保存1 d、1周或2周。本研究方案遵循《赫尔辛基宣言》,经山东第一医科大学附属青岛眼科医院医学伦理委员会审批[批文号:青眼伦审2019(30)号],所有受试者均了解本研究方法和目的并自愿签署知情同意书。
1.1.2主要试剂及仪器 锥虫蓝染色液(福建迈新公司);苏木精-伊红染色液(无锡江原公司);Epon812环氧树脂(美国EMS公司);质量分数1%锇酸、醋酸双氧铀硝酸铅(青岛大学医学院实验室提供);DX保存液(细胞培养基MEM中加入0.05 mmol/L地塞米松、质量分数2.5%硫酸软骨素、质量分数1%葡聚糖等)(青岛眼科医院眼库提供);无水甘油保存液(灭菌甘油,河北金钟制药有限公司)。Visumax全飞秒激光系统(德国Carl Zeiss公司);光学显微镜(日本Olympus公司);透射电子显微镜(捷克赛默飞公司)。
1.2 方法
1.2.1人角膜基质透镜的取出 保持手术室温度(21~23 ℃)、湿度(45%~55%)恒定,手术由同一位医师完成。术前3 d,采用质量分数0.5%左氧氟沙星滴眼液(日本参天制药有限公司)点术眼,每天5次,术前采用盐酸丙美卡因滴眼液(美国爱尔康公司)点眼行表面麻醉。采用Visumax全飞秒激光系统行SMILE手术,参数设置:脉冲重复频率为500 kHz,脉冲能量为25 nJ;点间距为4.4 μm;光区直径为6.5 mm,角膜帽厚度为110 μm、直径为7.6 mm,于角膜11:00位行2 mm长、120°侧切口。进行常规手术操作,取出完整角膜基质透镜立即置于保存液中,DX保存液组立即放入4 ℃冰箱保存,甘油保存液组立即放入-20 ℃冰箱低温保存。
1.2.2锥虫蓝染色法检测角膜基质透镜细胞死亡数量 每组各取4个标本,将角膜基质透镜组织平铺于载玻片,均匀滴加锥虫蓝染色液,浸泡1 min,立即用吸管吸干染液,置于光学显微镜下检查,200倍视野下随机选取4个视野进行观察并拍照,淡蓝色染色者为死亡细胞,采用ImageJ软件进行死亡细胞计数,分别计数每组4个视野平均死亡细胞数。
1.2.3光学显微镜下观察角膜基质透镜形态结构的完整性 每组各取3个标本,将角膜基质透镜置于二甲苯中共3次,每次15 min,分别置于无水乙醇、体积分数95%乙醇和80%乙醇中各2 min;自来水冲洗,苏木素染色,质量分数1%伊红染色,晾干后中性快干胶封片,光学显微镜下观察角膜基质透镜形态结构的完整性。
1.2.4透射电子显微镜下观察角膜基质透镜的超微结构 每组各取3个标本,将角膜基质透镜置于体积分数2.5%戊二醛溶液中固定过夜,磷酸盐缓冲液(phosphate buffered saline,PBS)浸洗,1%锇酸冷固定,脱水,Epon812环氧树脂包埋样品,半薄切片定位,UltracutE超薄切片机切片,醋酸双氧铀硝酸铅染色,透射电子显微镜下观察角膜基质透镜的细胞器结构和胶原纤维结构。
1.3 统计学方法

2 结果
2.1 各组角膜基质透镜中死亡细胞数量比较
锥虫蓝染色法结果显示,DX保存液保存1 d组和DX保存液保存1周组死亡细胞均较少;与DX保存液保存1 d组和DX保存液保存1周组相比,甘油保存1 d组和甘油保存1周组死亡细胞数增多,甘油保存2周组死亡细胞数明显增多(图1)。5个组死亡细胞数总体比较,差异有统计学意义(F=16.37,P<0.05),其中DX保存液保存1 d组和DX保存液保存1周组死亡细胞数比较,差异无统计学意义(P>0.05);甘油保存1 d组死亡细胞数明显少于甘油保存1周组和甘油保存2周组,差异均有统计学意义(均P<0.05);甘油保存1周组与甘油保存2周组死亡细胞数比较,差异无统计学意义(P>0.05);DX保存液保存1 d组与甘油保存1 d组死亡细胞数比较,差异无统计学意义(P>0.05);甘油保存1周组死亡细胞数明显多于DX保存液保存1周组,差异有统计学意义(P<0.05)(表1)。

图1 各组角膜基质透镜细胞存活情况(锥虫蓝 ×200,标尺=50 μm) A:DX保存液保存1 d组死亡细胞(箭头)较少 B:DX保存液保存1周组死亡细胞(箭头)与DX保存液保存1 d组接近 C:甘油保存1 d组死亡细胞(箭头)较DX保存液保存1 d组和DX保存液保存1周组增多 D:甘油保存1周组死亡细胞(箭头)增多 E:甘油保存2周组死亡细胞(箭头)明显增多Figure 1 Cell survival state of corneal stromal lens in different groups(Trypan blue ×200,bar=50 μm) A:The number of dead cells (arrow) was less in the DX preserved 1-day group B:The number of dead cells (arrow) in the DX preserved 1-week group was similar to that of the DX preserved 1-day group C:The number of dead cells (arrow) was increased in the glycerin preserved 1-day group compared with the DX preserved 1-day group and DX preserved 1-week group D:The number of dead cells (arrow) was increased in the glycerin preserved 1-week group compared with the glycerin preserved 1-day group E:There were more dead cells (arrow) in the glycerin preserved 2-week group compared with the glycerin preserved 1-week group

表1 各组角膜基质透镜中死亡细胞数比较(x±s,个/视野)Table 1 Comparison of the number of dead cells in corneal stromal lens among various groups (x±s,pcs/field)组别样本量死亡细胞数DX保存液保存1 d组453.1±14.2DX保存液保存1周组450.8±9.8甘油保存1 d组470.4±13.6甘油保存1周组4172.8±31.7ab甘油保存2周组4182.8±14.2bF值16.37P值<0.05 注:与DX保存液保存1周组比较,aP<0.05;与甘油保存1 d组比较,bP<0.05(单因素方差分析,LSD-t检验) Note:Compared with the DX preserved 1-week group,aP<0.05;compared with the glycerin preserved 1-day group,aP<0.05(One-way ANOVA,LSD-t test)
2.2 各组角膜基质透镜形态结构变化
光学显微镜下可见正常对照组角膜基质透镜胶原纤维呈平行排列,无水肿;DX保存液保存1 d组角膜基质透镜较致密,胶原纤维排列较规则;DX保存液保存1周组角膜基质透镜胶原纤维排列仍较规则,细胞较完整;甘油保存1 d组可见角膜基质组织水肿,胶原纤维排列疏松,细胞核裸露,随着甘油保存时间的延长,组织内胶原纤维逐渐变疏松,组织结构紊乱(图2)。
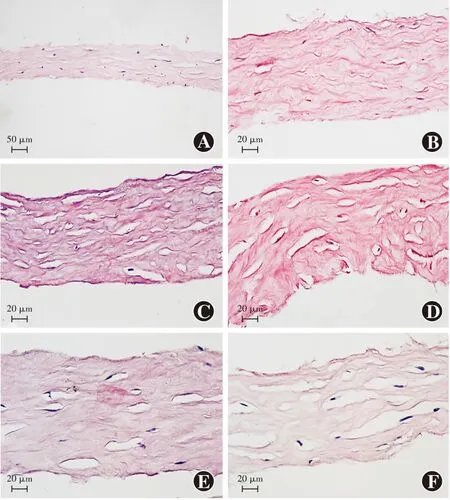
图2 各组角膜基质透镜组织形态观察 A:正常对照组胶原纤维平行排列,无水肿(HE ×200,标尺=50 μm) B:DX保存液保存1 d组角膜基质组织结构致密,胶原纤维排列规则(HE ×400,标尺=20 μm) C:DX保存液保存1周组胶原纤维排列规则,细胞尚完整(HE ×400,标尺=20 μm) D:甘油保存1 d组角膜基质透镜增厚(HE ×400,标尺=20 μm) E:甘油保存1周组角膜基质透镜胶原纤维排列疏松(HE ×400,标尺=20 μm) F:甘油保存2周组角膜基质透镜胶原纤维排列紊乱,细胞核裸露(HE ×400,标尺=20 μm)Figure 2 Morphology findings of the corneal stromal lens in different groups A:Collagen fibers were arranged in parallel without edema in the normal control group (HE ×200,bar=50 μm) B:The arrangement of collagen fibers of the corneal stromal lens was regular in the DX preserved 1-day group (HE ×400,bar=20 μm) C:The arrangement of collagen fibers was regular and the cells were intact in the DX preserved 1-week group (HE ×400,bar=20 μm) D:The corneal stromal lens was thickened in the glycerin preserved 1-day group (HE ×400,bar=20 μm) E:The arrangement of collagen fibers was loose in the glycerin preserved 1-week group (HE ×400,bar=20 μm) F:The arrangement of collagen fibers was disorder and the nuclei were bare in the glycerin preserved 2-week group (HE ×400,bar=20 μm)
2.3 各组角膜基质透镜中基质细胞和胶原纤维结构超微结构变化
正常角膜基质透镜组织胶原纤维排列规则、边界清晰,可见完整细胞器结构;DX保存液保存1 d组和DX保存液保存1周组角膜基质细胞分布均匀,细胞核完整,胶原纤维分布均匀、致密;甘油保存1 d组角膜基质组织胶原纤维较致密,细胞核尚完整,胶原纤维分布均匀、致密;甘油保存1周组角膜基质细胞分布稀疏,细胞结构不完整,胶原纤维分布稀疏;甘油保存2周组角膜基质细胞分布明显稀疏,未见完整细胞结构,胶原纤维分布极不均匀、稀疏(图3~5)。

图3 正常对照组角膜基质透镜超微结构(醋酸双氧铀硝酸铅 ×50 000,标尺=500 nm) 透射电子显微镜下观察可见胶原纤维(蓝色箭头)排列规则,边界清晰,可见结构正常的细胞器(红色箭头) 图4 各DX保存液保存组角膜基质透镜超微结构(醋酸双氧铀硝酸铅) A:DX保存液保存1 d组细胞核完整(×15 000,标尺=2 μm) B:DX保存液保存1 d组角膜基质细胞分布均匀(×100 000,标尺=200 nm) C:DX保存液保存1周组细胞核尚完整(×15 000,标尺=2 μm) D:DX保存液保存1周组角膜基质细胞分布尚均匀(×100 000,标尺=200 nm)Figure 3 Ultrastructure of corneal stromal lens in the normal control group(Uranyl acetate lead nitrate ×50 000,bar=500 nm) The arrangement of collagen fibers (blue arrow) was regular with clear boundaries,and well-identified organelles (red arrow) were seen Figure 4 Ultrastructure of the corneal stromal lens preserved with DX solution(Uranyl acetate lead nitrate) A:The nucleus was intact in the DX preserved 1-day group (×15 000,bar=2 μm) B:The distribution of the cells was even in the DX preserved 1-day group (×100 000,bar=200 nm) C:The nucleus was still intact in the DX preserved 1-week group (×15 000,bar=2 μm) D:The distribution of the cells was still even in the DX preserved 1-week group (×100 000,bar=200 nm)
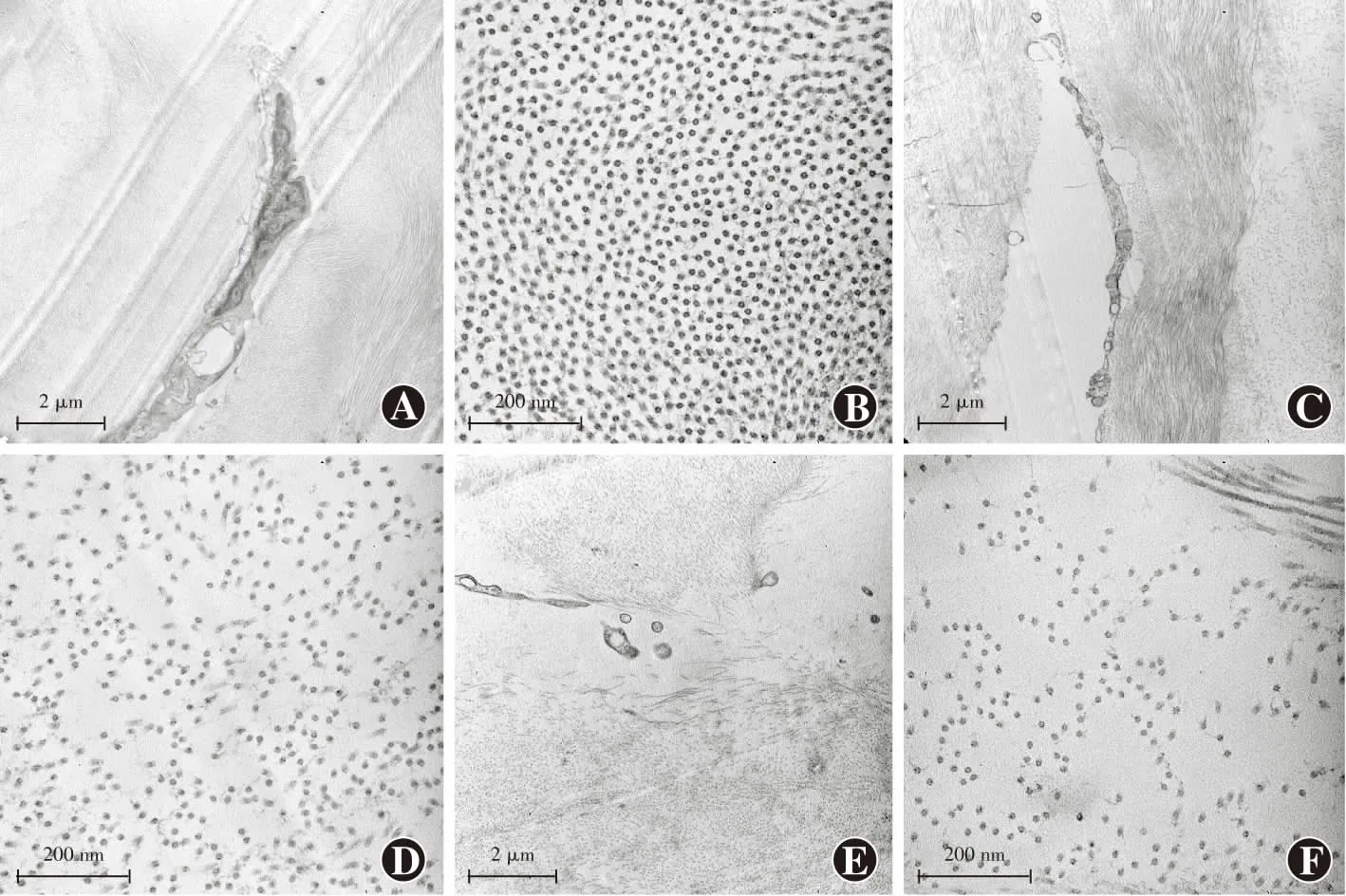
图5 各甘油保存组角膜基质透镜超微结构(醋酸双氧铀硝酸铅) A:甘油保存1 d组胶原纤维较致密,细胞核尚完整(×15 000,标尺=2 μm) B:甘油保存1 d组细胞分布均匀(×100 000,标尺=200 nm) C:甘油保存1周组角膜基质细胞明显变形(×15 000,标尺=2 μm) D:甘油保存1周组细胞数量明显减少(×100 000,标尺=200 nm) E:甘油保存2周组角膜基质细胞形态消失(×15 000,标尺=2 μm) F:甘油保存2周组细胞排列稀疏(×100 000,标尺=200 nm)Figure 5 Ultrastructure of the corneal stromal lens in various glycerin preserved groups(Uranyl acetate lead nitrate) A:The arrangement of collagen fibers was still regular with intact nuclei in the glycerin preserved 1-day group (×15 000,bar=2 μm) B:The distribution of the cells was still even in the glycerin preserved 1-day group (×100 000,bar=200 nm) C:The cell deformation was seen under the transmission electron microscope in the glycerin preserved 1-week group (×15 000,bar=2 μm) D:The number of cells was less in the glycerin preserved 1-week group (×100 000,bar=200 nm) E:The cells were destroyed in the glycerin preserved 2-week group (×15 000,bar=2 μm) F:The cell arrangement was sparse in the glycerin preserved 2-week group (×100 000,bar=200 nm)
3 讨论
目前角膜移植仍是各种角膜感染导致的角膜深层溃疡和角膜穿孔的有效治疗方法,但严重的角膜供体不足给严重角膜疾病的治疗带来了很大困难,寻求良好的角膜供体成为角膜移植手术开展的瓶颈问题,利用SMILE术后取出的健康人角膜基质透镜为角膜供体来源提供了新的途径。近期关于角膜基质透镜再利用的研究较多,主要包括远视、圆锥角膜的治疗及作为板层材料对角膜穿孔的修复等,具有效果良好、免疫排斥反应性低的特点。Riau等[5]报道人角膜基质透镜低温保存后植入灵长类动物角膜中是安全、有效且可行的。Liu等[6]和Sun等[7]利用自体透镜移植矫治远视获得了良好的效果。在治疗角膜疾病方面,Yin等[8]研究发现,利用纤维蛋白胶将2层,甚至多层角膜基质透镜进行粘合后可具有与角膜基质相同的生物活性,动物实验证实角膜基质透镜用于角膜穿孔的修复过程中未发生角膜新生血管、植片降解和排斥反应。许多研究表明,将角膜基质透镜用于角膜疾病的治疗是可行的,Wu等[9]将厚度为100 μm的人角膜基质透镜用于6例角膜穿孔患眼的治疗,术后3~4周部分患眼植入的透镜与角膜基质相融合,随访1年未出现感染、复发或再穿孔。Bhandari等[10]采用纤维蛋白胶将新鲜人角膜基质透镜粘合于角膜穿孔病灶,视力和植片透明性均较好。多个临床研究报道了多层人角膜基质透镜单独应用或联合羊膜移植治疗角膜溃疡的短期疗效,认为是安全、有效的,这些研究所用的透镜均为纯甘油-80 ℃保存的人角膜基质透镜,最长保存30 d。但是,这些研究的局限性均为样本量较小且随访时间较短[11-14]。无论如何,以上研究为严重角膜疾病的治疗研究提供了新的方法选择。
SMILE手术是目前主流的角膜屈光手术方式,但不同近视程度患者可取出角膜基质透镜的厚度也有差别,目前临床上取出的角膜基质透镜厚度大多为65~120 μm,其中较厚的角膜基质透镜对角膜溃疡或角膜穿孔的移植效果更好。本研究选取的角膜基质透镜厚度为90~110 μm,一经取出立即置于保存液中,虽然避免了外在环境对新鲜角膜基质透镜组织的影响,但不同保存液对这些组织的保存效果和安全性是亟待解决的问题。
目前,关于角膜基质透镜保存的研究较少,大多是关于将角膜基质透镜低温保存于细胞培养液及相关成分中的方法学研究。新加坡眼科研究所应用改良的低温保存方法保存1个月,发现角膜基质纤维密度降低但胶原结构保持完好[15]。Liu等[16]研究团队探讨了8种不同保存方式对于角膜基质透镜的影响,保存液包括PBS、DMEM、甘油和无血清培养基等,发现室温下连续4周保存于甘油的角膜基质透镜透明度高,组织完整性好,免疫原性低。Liang等[17]分别采用Optisol角膜中期保存液、干燥剂和无水甘油保存角膜基质透镜,结果显示Optisol角膜中期保存液保存效果较好,保存后14 d仍可见相对清晰的胶原结构。韦琦等[18]研究发现人角膜基质透镜保存于-80 ℃超低温冰箱84个月其透明性和完整性仍较好,超低温技术可用于人角膜基质透镜的长期保存。
DX保存液由山东第一医科大学附属青岛眼科医院自主研制,相对于Optisol角膜中期保存液配制简单,价格低廉,与Optisol保存液的不同之处在于含有地塞米松,并去除了TC-199和多种维生素、上皮细胞生长因子等成分,有效期为配制后1周[19]。我国部分地区医疗机构不具备低温冷冻保存条件,角膜材料也非常匮乏,对于严重角膜溃疡或穿孔者利用SMILE术取材后经DX保存液保存的人角膜基质透镜进行角膜移植术以作为一种替代治疗对于挽救患者的视力具有重要意义。由于目前近视矫治的角膜屈光手术的普及,新鲜的人角膜基质透镜立即应用效果会更好,但行SMILE手术的高度近视者比例尚不高,人角膜基质透镜并不能及时应用于临床,用DX保存液保存1周的人角膜基质透镜与未经保存处理的新鲜角膜基质透镜效果是否相近值得进一步探讨。
本实验通过锥虫蓝染色法探讨不同保存条件下角膜基质透镜中的死亡细胞数量,发现DX保存液保存1 d和1周对组织和细胞均无明显影响,但甘油保存1周后死亡细胞数明显增多。本研究采用组织形态学和超微结构观察,发现DX保存液保存1周的角膜基质透镜结构完好,胶原纤维较致密,证明组织的透明度很好,细胞结构完整,而无水甘油低温冷冻保存1周时,胶原纤维排列疏松,组织也失去了正常结构。甘油保存是一种非活性的保存方法,主要是通过低温防腐保存以维持组织的胶原板层结构,去除生物原性,也能有效地用于各种炎症反应及血管化导致的角膜疾病的治疗。本研究发现,与甘油保存的角膜基质透镜相比,DX保存液在维持透镜组织结构的完整性方面效果更好。
国内对于人角膜基质透镜保存的研究报道较少,本研究对不同保存液保存不同时间后人角膜基质透镜的组织特点进行了研究,但仍需要进一步检测保存后角膜基质透镜生物活性的变化,特别是角膜基质损伤修复相关因子基质金属蛋白酶2等以及免疫排斥相关因子人白细胞DR抗原、白细胞共同抗原等的表达变化,以判断人角膜基质透镜的临床应用价值,有利于某些眼部疾病的治疗方法选择。
综上所述,本研究结果表明人角膜基质透镜保存于DX保存液1周内其胶原纤维排列紧密,细胞结构完整,但关于保存后角膜基质透镜生物活性及免疫相关问题和对临床应用的价值仍需进一步研究。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明田乐:酝酿和设计实验、实施研究、采集数据、分析/解释数据、统计分析、起草文章;李德卫、彭予苏、张飞飞:参与实验,采集数据;陈敏:酝酿和设计实验、实施研究、对文章的知识性内容作批评性审阅
