Slit2对糖尿病模型小鼠角膜上皮和神经的保护作用及其机制
2022-04-13田乐李德卫谢立信周庆军
田乐 李德卫 谢立信 周庆军
1山东第一医科大学附属青岛眼科医院,青岛266071;2山东第一医科大学附属眼科研究所 山东省眼科学重点实验室-省部共建国家重点实验室培育基地,青岛266071
糖尿病是一组由于胰岛素分泌缺陷和/或胰岛素作用障碍所致的以高血糖为特征的代谢性疾病。持续的高血糖和长期代谢紊乱等可导致全身组织器官产生一系列的并发症,包括眼、肾脏、心血管及神经系统的损害及功能障碍。目前临床上已发现多数糖尿病患者会出现角膜功能不良,如反复发作的角膜溃疡、持续角膜上皮缺损不愈合、角膜敏感度下降等。对严重角膜感染糖尿病患者的治疗是临床医师面临的非常棘手的问题。因此,探寻糖尿病角膜病变的具体发病机制,进而指导临床诊断和治疗已成为广大眼科工作者的又一重要研究课题。前期通过基因芯片研究发现,糖尿病模型小鼠角膜上皮分泌的多种神经营养因子相对表达量较正常小鼠明显下降。多项研究表明,Slit引导配体2(slit guidance ligand 2,Slit2)是多功能的单向神经轴突导向分子,作为Roundabout(Robo)的配体发挥促进细胞和神经再生的作用。但Slit2在糖尿病小鼠角膜和三叉神经节(trigeminal ganglions,TGs)中的表达情况有待验证。本研究拟通过在体动物实验和体外细胞实验观察Slit2在糖尿病模型小鼠与正常小鼠角膜和TGs中的表达差异,探讨Slit2对糖尿病小鼠角膜上皮和神经的保护作用及其分子机制。
1 材料与方法
1.1 材料
1.1.1
实验动物 SPF级5~6周龄C57BL/6小鼠60只(北京维通利华实验技术有限公司),雌雄各半。实验小鼠的饲养及使用均符合ARVO制定的科研动物使用规范。本研究方案经青岛眼科医院伦理委员会审核批准(批文号:[2020]57)。1.1.2
小鼠角膜上皮干/祖细胞系来源及处理 角膜上皮干/祖(TKE2)细胞系由厦门大学李炜教授赠送。采用加入终质量浓度为20~30 μg/ml牛垂体提取物(bovine pituitary extract,BPE)和终质量浓度为0.1~0.2 ng/ml重组人表皮生长因子(recombinant human epidermal growth factor,rEGF)的KSFM基础培养基,于37 ℃、体积分数5% CO培养箱中培养TKE2细胞,细胞在培养瓶中生长达70%~80%时,加入适量胰蛋白酶/EDTA,进行1∶ 2细胞传代,选取状态良好的对数生长期细胞进行实验。1.1.3
主要试剂及仪器 注射用盐酸氯胺酮(福建古田药业有限公司);氯丙嗪注射液(上海禾丰制药有限公司);兔抗鼠β-tubulin Ⅲ/FITC抗体(657403)(北京Biolegend公司);兔抗鼠Slit2抗体(ab7665)、兔抗鼠表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体(ab52894)、兔抗鼠p-EGFR抗体(ab40815)、兔抗鼠苏氨酸蛋白激酶(threonine protein kinase,AKT)抗体(ab38449)、兔抗鼠p-AKT抗体(ab179463)、兔抗鼠细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)(ab17942)、兔抗鼠p-ERK抗体(ab65142)、兔抗鼠β-catenin抗体(ab32572)、兔抗鼠Ki67抗体(ab16667)、FITC标记山羊抗兔IgG(ab150081)(英国Abcam公司);乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(北京Solarbio公司);胰蛋白酶、胶原酶(17101)(美国Gibco公司);木瓜酶(3126)(美国Worthington公司);总RNA提取试剂盒(德国Macherey-Nagel公司);逆转录试剂盒(大连宝生物公司)。眼科手术器械(苏州明仁医疗器械有限公司);微量注射器(中国汉密尔顿公司);眼科手术显微镜(德国Zeiss公司);裂隙灯显微镜含照相系统(日本Topcon公司);荧光显微镜(E800,日本Nikon公司);实时荧光定量PCR仪(Prism7500,美国ABI公司);紫外分光光度计(NanoDrop One,美国Thermo公司)。1.2 方法
1.2.1
实验动物糖尿病模型建立 采用随机数字表法将小鼠分为正常对照组、糖尿病模型组和Slit2注射组,每组20只。取糖尿病模型组和Slit2注射组小鼠采用链脲霉素(streptozotocin,STZ)腹腔内注射法建立糖尿病模型:所有小鼠均上午8:00禁食,当天下午2:00按照50 mg/kg腹腔内注射STZ(溶于pH 4.5的柠檬酸缓冲液),注射完毕,加食加水,饮用水置换为糖水;第2天上午8:00禁食,同时置换普通饮水;按照以上方式重复3次,第6天上午饮水置换为普通饮水。分别于注射STZ后2 d、4周和8周检测尾静脉血糖,测定血糖值>300 mg/dl者为1型糖尿病模型建立成功。正常对照组予以等容量的柠檬酸缓冲液进行注射。1.2.2
小鼠角膜上皮损伤模型建立及上皮愈合情况 取正常对照组、糖尿病模型组小鼠于建模后即刻采用盐酸氯丙嗪+盐酸氯胺酮混合液0.4 ml腹膜下注射行全身麻醉,采用盐酸丙美卡因滴眼液点眼行表面麻醉,点眼后5 min用直径3 mm环钻在小鼠双眼角膜留下压痕,手持电动上皮刮刀沿压痕刮除小鼠角膜中央上皮。均选取小鼠左眼为实验眼,右眼为对照眼。小鼠左眼角膜上皮刮除后立即结膜下注射50 μg/μl Slit2溶液4 μl作为Slit2注射组,右眼结膜下注射等容量磷酸盐缓冲液(phosphate buffer saline,PBS)作为糖尿病模型组。每组各取4只眼分别于注射后24 h、48 h和72 h结膜囊点荧光素钠1滴,裂隙灯显微镜下观察并照相,采用ImageJ图像分析软件测量各组角膜上皮缺损面积,角膜上皮缺损率=(荧光素染色面积/原始角膜上皮缺损面积)×100%,各组实验重复3次。1.2.3
实时荧光定量PCR法测定小鼠角膜上皮中Slit2及相关受体Robo1、Robo2、Robo3和Robo4的表达 取糖尿病模型建模成功后正常对照组和糖尿病模型组小鼠各4只,过量麻醉法处死,收集双眼眼球组织作为1个样本,置于20 nmol/L EDTA-PBS中,37 ℃条件下孵育1 h,分离角膜上皮组织置于EP管中。按照总RNA提取试剂盒步骤提取总RNA,并按照逆转录试剂盒步骤逆转录为cDNA,目的基因为Slit2
、Robo1
、Robo2
、Robo3
和Robo4
,以GAPDH
作为内参。Slit2
正向引物为5’-GGCATGACAGGGAAATGTTGTA-3’,反向引物为5’-ACCACTGATGTCACGGAACTGT-3’;Robo
1正向引物为5’-TGCAACAAATCCCATTTGAG-3’,反向引物为5’-GACACCCTGCATTGTTTGTTC-3’;Robo
2正向引物为5’-GCTTAAAGGCAGTGCTCACA-3’,反向引物为5’-TCATTCAAAATGGGTCAAACA-3’;Robo
3正向引物为5’-CTGATCAGACTCTTTTTATTG-3’,反向引物为5’-GAGAATATCATGAGTGCC-3’;Robo
4正向引物为5’-GCGTCCTTTCCTTCAGTCTC-3’,反向引物为5’-GTCACACCATGCAAGGAAAC-3’;GAPDH
正向引物为5’-CTGCCCAGAACATCATCCCT-3’,反向引物为5’-GGTCCTCAGTGTAGCCCAAGA-3’。PCR反应条件为:95 ℃预变性10 s;95 ℃变性10 s,60 ℃退火及延伸1 min,共45个循环。采用2法计算各目的基因相对表达量。每个样本均设置4个复孔,取平均值,独立重复实验3次。1.2.4
角膜铺片荧光染色法观察角膜神经形态和分布 小鼠角膜上皮损伤模型建立后第7天,糖尿病组和Slit2注射组各取2只小鼠双眼眼球,分离角膜组织,置于质量分数2%多聚甲醛中固定,用20 nmol/L EDTA-PBS在37 ℃条件下孵育30 min,含体积分数10%Triton的PBS透膜30 min,质量分数5%牛血清白蛋白封闭1 h;置于β-tubulin Ⅲ/PE抗体(1∶ 200),4 ℃条件下避光孵育过夜;DAPI染核,将角膜剪为4瓣,铺片,荧光显微镜下观察并拍照。1.2.5
免疫荧光染色法测定角膜上皮中Slit2信号通路相关因子的表达 角膜上皮损伤模型建立后72 h,取正常对照组2只小鼠双眼、糖尿病模型组4只小鼠右眼、Slit2注射组4只小鼠左眼眼球组织用冷冻胶包埋,常规8 μm厚连续冰冻切片,置载玻片上晾干30 min,滴加PBS至冷冻胶周围以溶解冷冻胶,吸水纸吸净PBS;4%多聚甲醛固定20 min,0.1%Triton X-100透化5 min;滴加5%牛血清白蛋白室温下封闭1 h,甩干;分别加入p-EGFR(1∶ 200)、p-ERK(1∶ 200)、p-AKT(1∶ 200)、β-catenin(1∶ 200)、Ki67(1∶ 250)和Slit2(1∶ 200)4 ℃湿盒孵育过夜;次日常温下复温1 h,PBS冲洗3次,每次5 min;滴加荧光素标记的二抗,室温条件下湿盒避光孵育1 h,PBS冲洗3次,每次5 min;DAPI染核,PBS冲洗,封片,荧光显微镜下观察并拍照。1.2.6
Western blot法检测TKE2细胞增生相关信号通路相关因子蛋白表达 将TKE2细胞接种于6孔板中,待细胞达70%~80%融合后将细胞分为正常对照组、高糖组和Slit2干预组;正常对照组采用KSFM培养基培养,高糖组和Slit2干预组均于含30 mmol/L葡萄糖培养基中培养3 d,Slit2干预组培养液中加入终质量浓度为0.5 μg/ml的Slit2,于处理后10 min收集各组细胞。取于30 mmol/L葡萄糖培养基中培养3 d的TKE2细胞,加入终质量浓度为0.5 μg/ml的Slit2,分别于处理前和处理后10、20、30、60、120 min收集细胞。另取高糖条件下培养的TKE2细胞分别加入终质量浓度为0.01、0.1和0.5 μg/ml的Slit2,于处理后10 min收集细胞。取收集的细胞,加入细胞裂解液,用细胞刮匙收集细胞于EP管中超声至均匀透明;95 ℃变性5 min,-20 ℃保存,BCA法测定蛋白浓度;取40 μg蛋白样品行聚丙烯酰胺凝胶电泳,4 ℃环境下将蛋白转印至PVDF膜;将PVDF膜置于体积分数5%脱脂牛奶中室温封闭1 h后,分别置于一抗p-EGFR(1∶ 1 000)、EGFR(1∶ 1 000)、p-AKT(1∶ 1 000)、AKT(1∶ 10 000)、p-ERK(1∶ 1 000)、ERK(1∶ 1 000)、β-catenin(1∶ 5 000)、GAPDH(1∶ 1 000),室温下孵育1 h,PBS冲洗3次,每次5 min;加入相应二抗,室温下孵育1 h;加入显色液于暗室显影。将胶片放入凝胶成像系统中。拍照保存,用ImageJ软件定量分析结果;以GAPDH为内参照,计算各目的蛋白的相对表达量。1.2.7
TGs细胞原代培养及突触长度测定 各组角膜上皮损伤模型建模第3天,每组各取2只小鼠,脊椎脱臼法处死小鼠,去除小鼠头骨处皮肤,用虹膜剪剪掉头骨暴露出脑组织并寻找TGs,用剪刀剪断TGs的3个主要分支及其与脑的连接部分。夹住TGs后端,取出TGs;用弹簧剪将神经节剪成10~12份,转入含1.5 ml Hanks平衡盐溶液的离心管中,加入木瓜酶于37 ℃条件下水浴20 min,低速离心(离心力<200×g
)收集沉淀,加入胶原酶于37 ℃条件下水浴20 min,400×g
离心收集沉淀,加入0.5 ml预热的含5%胎牛血清、5%羟乙基哌嗪乙烷磺酸、5%青链霉素的L15完全培养基。制作12.5%+28% Percoll梯度分离液,轻轻将0.5 ml细胞悬液加到Percoll梯度分离液上,1 300×g
离心10 min,弃去上层4.5 ml含界面处碎片的Percoll梯度分离液,加入4 ml L15完全培养基,1 000×g
离心6 min,去除培养液,用600 μl L15完全培养基重悬细胞,取100 μl细胞悬液至含玻片的培养孔板,放入培养箱中培养2 h后,加入1 ml预热的L15完全培养基,每3 d换液1次。待细胞至50%~60%融合时将培养液吸除,PBS冲洗3次,4%多聚甲醛固定15 min,PBS冲洗3次,0.1%Triton X-100透化5 min,牛血清白蛋白封闭液封闭20 min,吸除封闭液加入β-tubulin Ⅲ/FITC抗体(1∶ 200)4 ℃孵育过夜,PBS冲洗3次,DAPI染核3 min,PBS冲洗2次。荧光显微镜下观察并拍照,采用ImageJ图像分析软件测量神经轴突长度。1.3 统计学方法
采用SPSS 18.0统计学软件进行统计分析。计量资料经W检验证实呈正态分布,以表示。采用单因素干预多水平研究设计,正常对照组和糖尿病模型组间评估指标的差异比较采用独立样本t
检验,正常对照组、糖尿病模型组和Slit2注射组间评估指标总体差异比较采用单因素方差分析,组间多重比较采用LSD-t
检验。P
<0.05为差异有统计学意义。2 结果
2.1 各组小鼠角膜上皮损伤后不同时间点上皮愈合情况比较
各组小鼠角膜上皮损伤后角膜中央出现直径3 mm上皮缺损,角膜上皮损伤后48 h,正常对照组、糖尿病模型组和Slit2注射组均可见角膜荧光素染色,糖尿病模型组角膜上皮荧光素染色面积明显大于正常对照组和Slit2注射组;角膜上皮损伤后72 h,正常对照组和Slit2注射组角膜未见明显荧光素染色,糖尿病模型组仍可见角膜中央荧光素染色(图1)。各组间小鼠角膜缺损后48 h和72 h角膜上皮缺损率总体比较差异均有统计学意义(F
=406.684,P
<0.01;F
=25.708,P
=0.007);Slit2注射组小鼠角膜缺损后48 h和72 h角膜上皮缺损率均明显低于相应时间点糖尿病模型组,差异均有统计学意义(均P
<0.05)(表1)。
图1 各组小鼠角膜上皮损伤后不同时间点角膜荧光素染色图 正常对照组和Slit2注射组造模后48 h角膜荧光素染色面积较造模后24 h明显缩小,造模后72 h角膜未见荧光素染色;糖尿病模型组造模后48 h仍可见大面积角膜荧光素染色,造模后72 h可见角膜中央荧光素染色 Slit2:Slit引导配体2Figure 1 Corneal epithelial wound healing of rats in different groups at various time points In normal control group and Slit2 injection group,there was an obviously smaller area of fluorescein staining at 48 hours compared with 24 hours following modeling,and no fluorescein staining was found at 72 hours following modeling.In diabetes group,a large area of fluorescein staining was found at 48 hours following modeling,and fluorescein staining of the central cornea was observed at 72 hours following modeling Slit2:slit guidance ligand 2
2.2 正常对照组与糖尿病模型组小鼠角膜上皮中Slit2及相关受体mRNA表达比较
糖尿病模型组小鼠角膜上皮中Slit2、Robo1、Robo2和Robo4 mRNA相对表达量均高于正常对照组,差异均有统计学意义(均P
<0.05)(表2)。表2 正常对照组与糖尿病模型组角膜上皮 Slit2及其受体mRNA表达量比较(x±s)Table 2 Comparison of the mRNA expression levels of Slit2 and its receptors in corneal epithelium between two groups (x±s)组别样本量Slit2Robo1Robo2Robo3Robo4正常对照组41.04±0.351.03±0.301.00±0.071.05±0.411.02+0.26糖尿病模型组42.80±1.432.68±0.633.29±0.650.87+0.041.48+0.22t值13.94416.76037.2750.55635.456P值0.0200.0200.0300.5400.030 注:(独立样本t检验) Slit2:Slit引导配体2 Note:(Independent samples t-test) Slit2:slit guidance ligand 2
表1 各组小鼠角膜缺损后不同时间点角膜上皮缺损率比较(x±s,%)Table 1 Comparison of corneal epithelial defects at different time points among various groups (x±s,%)组别眼数48 h角膜上皮缺损率72 h角膜上皮缺损率正常对照组1210.52±5.14 a0.81±0.72 a糖尿病模型组1261.31±7.2126.38±6.25Slit2注射组1218.67±6.00a0.38±0.23aF值406.68425.708P值<0.010.007 注:与糖尿病模型组比较,aP<0.05(单因素方差分析,LSD-t检验) Slit2:Slit引导配体2 Note:Compared with diabetes group,aP<0.05 (One-way ANOVA,LSD-t test) Slit2:slit guidance ligand 2
2.3 糖尿病模型组与Slit2注射组小鼠角膜神经形态及分布比较
角膜铺片荧光染色显示,小鼠角膜上皮损伤模型建立后7 d,糖尿病模型组小鼠角膜神经丛分布稀疏,神经纤维数量减少,神经纤维分支消失;Slit2注射组角膜神经丛致密,神经纤维数量多且分布均匀,神经末梢可见较多分支,神经纤维网连接紧密,走行正常(图2)。

图2 糖尿病模型组和Slit2注射组小鼠角膜神经β-tubulin Ⅲ荧光染色图(PE) A:各组角膜神经丛分布比较(×40) 糖尿病模型组小鼠角膜神经纤维丛稀疏,Slit2注射组角膜神经丛致密 B:各组角膜神经纤维形态(×200,标尺=50 μm) 糖尿病模型组小鼠角膜神经纤维稀疏,Slit2注射组角膜神经纤维明显较密集 Slit2:Slit引导配体2Figure 2 Immunofluorescence staining of β-tubulin Ⅲ of mouse nerve plexuses in diabetes group and Slit2 injection group (PE) A:Comparison of distribution of mouse nerve plexuses between two groups (×40) The mouse nerve plexuses were sparse in diabetes group and compact in Slit2 injection group B:Morphology of corneal nerve fibers of two groups (×200,bar=50 μm) There were few corneal nerve fibers scarcely distributed in diabetes group,and there were more densely distributed in Slit2 injection group Slit2:slit guidance ligand 2
2.4 正常对照组与糖尿病模型组角膜组织中Slit2表达分布比较
免疫荧光染色结果显示,Slit2在正常角膜上皮中呈阳性表达,正常对照组与糖尿病模型组正常角膜上皮中Slit2荧光强度无明显差别(图3A);糖尿病模型组修复的角膜上皮中Slit2荧光强度较正常对照组明显减弱(图3B)。

图3 正常对照组与糖尿病模型组小鼠正常和损伤修复的角膜上皮中Slit2免疫荧光染色图(×400,标尺=100 μm) A:各组正常角膜上皮中均可见Slit2阳性表达,呈红色荧光(PE),细胞核呈蓝色荧光(DAPI) B:正常对照组损伤修复的角膜上皮中可见Slit2阳性表达,呈绿色荧光(FITC),细胞核呈蓝色荧光(DAPI),糖尿病模型组损伤修复的角膜上皮中Slit2荧光强度较正常对照组减弱 Slit2:Slit引导配体2Figure 3 Immunofluorescence staining of Slit2 in mouse retinas of different groups (×400,bar=100 μm) A:The red fluorescence of Slit2 (PE) and the blue fluorescence of nuclei (DAPI) were found in mouse corneal epithelia of both normal control group and diabetes group B:The green fluorescence of Slit2 (FITC) and the blue fluorescence of nuclei (DAPI) were observed in the regenerated corneal epithelia of normal control group.The fluorescence intensity of Slit2 observed in the regenerated corneal epithelia of diabetes group was weaker than normal control group Slit2:slit guidance ligand 2
2.5 各组小鼠损伤修复角膜上皮中Slit2信号通路相关因子表达及分布比较
角膜上皮损伤模型建立后72 h,正常对照组和Slit2注射组角膜上皮中p-EGFR、p-ERK和β-catenin表达均呈强荧光,糖尿病模型组角膜上皮中p-EGFR、p-ERK、p-AKT和β-catenin表达荧光强度明显减弱(图4)。
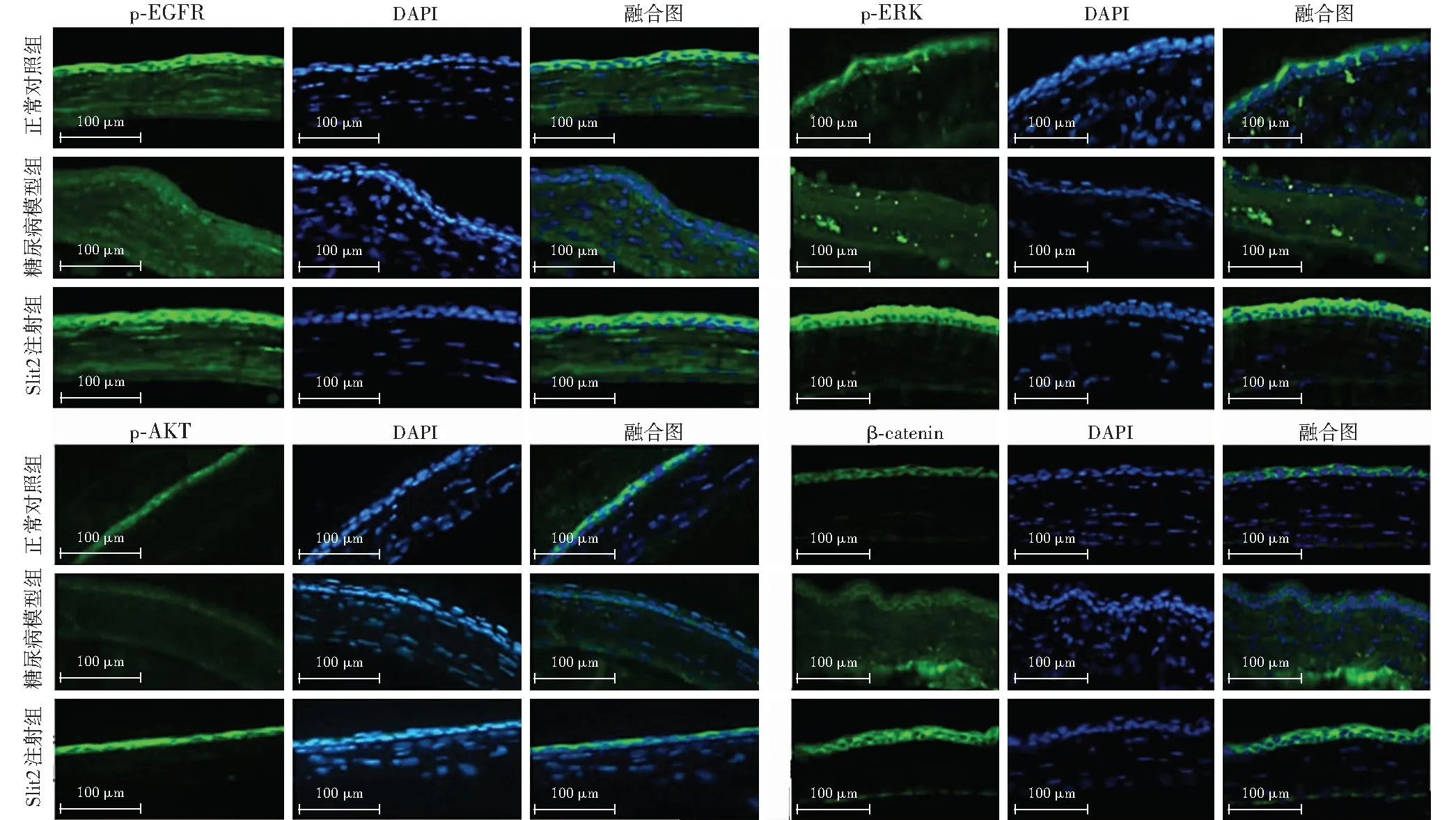
图4 各组小鼠损伤修复后角膜上皮p-EGFR、p-ERK、p-AKT和β-catenin免疫荧光染色图(×400,标尺=100 μm) 角膜上皮损伤模型建立后72 h,正常对照组和Slit2注射组角膜上皮中p-EGFR、p-ERK、p-AKT和β-catenin表达呈中等荧光强度,其中Slit2注射组中p-ERK、p-EGFR和β-catenin荧光表达强度较正常对照组高,糖尿病模型组中p-EGFR、p-ERK、p-AKT和β-catenin荧光强度减弱 Slit2:Slit引导配体2;EGFR:表皮生长因子受体;ERK:细胞外信号调节激酶;AKT:苏氨酸蛋白激酶;β-catenin:β连环蛋白Figure 4 Immunofluorescence staining of p-EGFR,p-ERK,p-AKT and β-catenin in regenerated mouse corneal epithelia of various groups (×400,bar=100 μm,) Seventy-two hours after corneal epithelial damage,moderate fluorescence of p-EGFR,p-ERK,p-AKT and β-catenin expression was found in normal control group and the Slit2 injection group,which was attenuated in diabetes group,and there was stronger fluorescence of p-EGFR,p-ERK and β-catenin in Slit2 injection group than normal control group Slit2:slit guidance ligand 2;EGFR:epidermal growth factor receptor;ERK:extracellular signal-regulated kinase;AKT:threonine protein kinase
2.6 各组小鼠损伤修复角膜上皮中Ki67的表达比较
角膜上皮损伤模型建立后72 h,正常对照组角膜上皮中Ki67呈强荧光,Ki67阳性细胞数量较多,排列整齐;糖尿病模型组角膜上皮中Ki67荧光明显减弱;与糖尿病模型组比较,Slit2注射组角膜上皮中Ki67荧光明显增强,Ki67阳性细胞数明显增多(图5)。
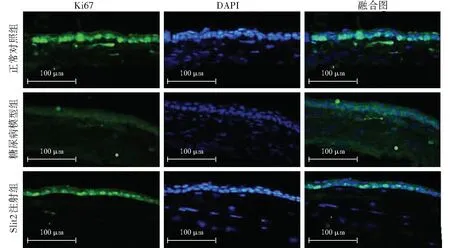
图5 各组小鼠损伤修复72 h角膜上皮Ki67荧光染色图(×400,标尺=100 μm) Ki67阳性细胞呈绿色荧光(FITC),细胞核呈蓝色荧光(DAPI);与糖尿病模型组相比,正常对照组和Slit2注射组Ki67阳性角膜上皮细胞数量较多,Ki67荧光明显增强 Slit2:Slit引导配体2Figure 5 Immunofluorescence staining of Ki67 in regenerated mouse corneal epithelia of various groups at 72 hours after corneal epithelial damage (×400,bar=100 μm) Ki67-positive cells showed green fluorescence (FITC),and nuclei presented blue fluorescence (DAPI).There were more Ki67-positive cells and stronger fluorescence of Ki67 in normal control group and Slit2 injection group than diabetes group Slit2:slit guidance ligand 2
2.7 各组TKE2细胞各信号通路相关蛋白表达计较
正常对照组、高糖组和Slit2干预组TKE2细胞中p-EGFR/EGFR、p-AKT/AKT和β-catenin相对表达量总体比较,差异均有统计学意义(F
=39.239、28.912、29.325,均P
<0.05),高糖组TKE2细胞内p-EGFR/EGFR、p-AKT/AKT和β-catenin相对表达量均明显低于正常对照组和Slit2干预组,差异均有统计学意义(均P
<0.05)(图6)。
图6 各组TKE2细胞p-EGFR/EGFR、p-AKT/AKT、p-ERK/ERK和β-catenin表达量比较 A:各组p-EGFR/EGFR相对表达量比较 F=39.239,P<0.05 B:各组p-AKT/AKT相对表达量比较 F=28.912,P<0.05 C:各组p-ERK/ERK相对表达量比较 F=0.048,P>0.05 D:各组β-catenin相对表达量比较 F=29.325,P<0.05 与高糖组比较,a P<0.05(单因素方差分析,LSD-t检验,n=3) ERGR:表皮生长因子受体;Slit2:Slit引导配体2;AKT:苏氨酸蛋白激酶;ERK:细胞外调节蛋白激酶;β-catenin:β-连环蛋白;GAPDH:磷酸甘油醛脱氢酶Figure 6 Comparison of the expression levels of p-EGFR/EGFR,p-AKT/AKT,p-ERK/ERK and β-catenin in TKE2 cells among groups A:Comparison of p-EGFR/EGFR relative expression level F=39.239, P<0.05 B:Comparison of p-AKT/AKT relative expression level F=28.912,P<0.05 C:Comparison of p-ERK/ERK relative expression level F=0.048,P>0.05 D:Comparison of β-catenin relative expression level F=29.325,P<0.05 Compared with high glucose group,a P<0.05 (One-way ANOVA,LSD-t test,n=3) ERGR:epidermal growth factor receptor;Slit2:slit guidance ligand 2;AKT:threonine protein kinase;ERK:extracellular regulated protein kinases;GAPDH:glyceraldehyde-phosphate dehydrogenase
高糖培养条件下TKE2细胞Slit2处理不同时间点p-EGFR/EGFR和p-AKT/AKT的相对表达量总体比较差异均有统计学意义(F
=43.652、53.241,均P
<0.05);其中高糖培养条件下Slit2处理10 min时,p-EGFR/EGFR和p-AKT/AKT的相对表达量较未处理时均明显升高,差异均有统计学意义(均P
<0.05);Slit2处理30 min时p-EGFR/EGFR的相对表达量明显高于其他时间点,Slit2处理60 min时p-AKT/AKT的相对表达量明显高于其他时间点,差异均有统计学意义(均P
<0.05)(图7)。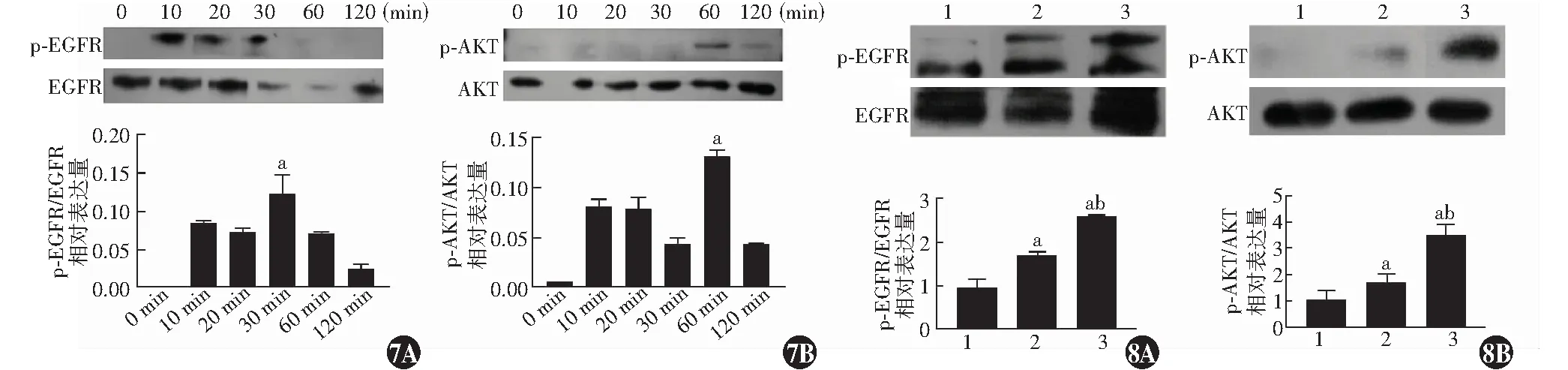
图7 高糖培养条件下Slit2不同处理时间TKE2细胞p-EGFR/EGFR、p-AKT/AKT表达量比较 A:Slit2不同处理时间点p-EGFR/EGFR表达比较 F=43.562,P<0.05.与处理后30 min比较,a P<0.05(单因素方差分析,LSD-t检验,n=3) B:Slit2不同处理时间点p-AKT/AKT表达比较 F=53.241,P<0.05.与处理后60 min比较,a P<0.05(单因素方差分析,LSD-t检验,n=3) Slit2:Slit引导配体2;TKE2:小鼠角膜上皮干/祖细胞系;ERGR:表皮生长因子受体;AKT:苏氨酸蛋白激酶 图8 高糖培养条件下不同质量浓度Slit2处理TKE2细胞p-EGFR/EGFR、p-AKT/AKT表达量比较 A:不同质量浓度Slit2处理TKE2细胞p-EGFR/EGFR表达比较 F=65.371,P<0.05.与0.01 μg/ml Slit2比较,a P<0.05;与0.1 μg/ml Slit2比较,b P<0.05(单因素方差分析,LSD-t检验,n=3) B:不同质量浓度Slit2处理TKE2细胞p-AKT/AKT表达比较 F=122.231,P<0.05.与0.01 μg/ml Slit2比较,a P<0.05;与0.1 μg/ml Slit2比较,b P<0.05(单因素方差分析,LSD-t检验,n=3) 1:0.01 μg/ml Slit2;2:0.1μg/ml Slit2;3:0.5μg/ml Slit2 Slit2:Slit引导配体2;EGFR:表皮生长因子受体;AKT:苏氨酸蛋白激酶Figure 7 Comparison of the expression levels of p-EGFR/EGFR and p-AKT/AKT in high glucose-cultured TKE2 cells after different treatment time of Slit2 A:Comparison of the relative expression levels of p-EGFR/EGFR F=43.562,P<0.05.Compared with the value after 30-minute treatment,a P<0.05 (One-way ANOVA,LSD-t test,n=3) B:Comparison of the relative expression levels of p-AKT/AKT F=53.241,P<0.05.Compared with the value after 60-minute treatment,a P<0.05 (One-way ANOVA,LSD-t test,n=3) Slit2:slit guidance ligand 2;TKE2:mouse corneal epithelial stem/progenitor cell line;EGFR:epidermal growth factor receptor;AKT:threonine protein kinase Figure 8 Comparison of the expression levels of p-EGFR/EGFR and p-AKT/AKT in high glucose-cultured TKE2 cells treated with different concentrations of Slit2 A:Comparison of the relative expression levels of p-EGFR/EGFR F=65.371,P<0.05.Compared with 0.01 μg/ml Slit2,a P<0.05;compared with 0.1 μg/ml Slit2,b P<0.05 (One-way ANOVA,LSD-t test,n=3) B:Comparison of the relative expression levels of p-AKT/AKT F=122.231,P<0.05.Compared with 0.01 μg/ml Slit2,a P<0.05;compared with 0.1 μg/ml Slit2,b P<0.05 (One-way ANOVA,LSD-t test,n=3) 1;0.01 μg/ml Slit2;2;0.1μg/ml Slit2;3;0.5μg/ml Slit2 Slit2:slit guidance ligand 2;EGFR:epidermal growth factor receptor;AKT:threonine protein kinase
高糖培养条件下,随着Slit2质量浓度的增加,p-EGFR/EGFR和p-AKT/AKT相对表达量逐渐升高,不同质量浓度Slit2处理细胞的p-EGFR/EGFR和p-AKT/AKT相对表达量比较,差异均有统计学意义(F
=65.371、122.231,均P
<0.05)(图8)。2.8 各组原代培养的TGs突触长度比较
正常对照组、糖尿病模型组和Slit2注射组原代培养的TGs突触长度分别为(72.14±9.48)、(40.52±5.44)和(73.04±4.66)μm,总体比较差异有统计学意义(F
=83.674,P
<0.01),其中糖尿病模型组TGs突触长度明显短于正常对照组和Slit2注射组,差异均有统计学意义(均P
<0.05)(图9)。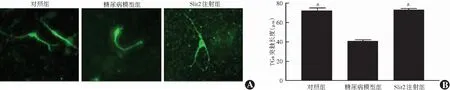
图9 各组原代培养TGs突触长度比较 A:各组原代培养TGs的β-tubulin Ⅲ免疫荧光图(FITC ×400,标尺=100 μm) B:各组原代培养TGs突触长度量化比较 F=83.674,P<0.01.与糖尿病模型组比较,a P<0.05(单因素方差分析,LSD-t检验,n=10) TGs:三叉神经节细胞;Slit2:Slit引导配体2Figure 9 Comparison of synapse length of primary cultured TGs among different groups A:Immunofluorescence image of β-tubulin Ⅲ of primary cultured TGs in normal control group,high glucose group and high glucose+Slit2 treatment group (FITC ×400,bar=100 μm) B:Quantitative comparison of synaptic length of primary cultured TGs among three groups F=83.674,P<0.01.Compared with diabetes model group,a P<0.05 (One-way ANOVA,LSD-t test,n=10) Slit2:slit guidance ligand 2;TGs:trigeminal ganglion cells
3 讨论
糖尿病角膜病变由Schultz等提出并命名,主要表现为角膜上皮再生延迟、角膜敏感性下降、神经营养性角膜溃疡等;如果没有得到及时有效的干预治疗,其有致盲的危险。高血糖对角膜各层结构均会产生影响,其中对泪膜、角膜上皮和神经的影响较为明显。目前,大量研究结果表明晚期糖基化终末产物(advanced glycation end products,AGEs)是引起糖尿病慢性并发症的重要因素之一,表现为AGEs的异常蓄积导致角膜上皮和基质细胞功能受损,进而影响角膜的损伤修复。有研究已证明AGEs是引起糖尿病周围神经病变的因素之一,但其对糖尿病角膜神经病变的影响尚缺少相关报道。
Slit
基因于1984年在果蝇中首次被发现,其在人体多处组织中均有表达,包括眼、心脏、脑、血管等。Slit的主要功能包括影响神经轴突生长方向、引导神经细胞迁移、影响神经细胞形态分化、血管形成、心脏形态发生改变和肿瘤细胞迁移等。迄今在哺乳动物中发现3种Slit
(1、2、3)和4种Robo
配体(1、2、3、4)基因。关于Slit2在眼组织中的研究报道不多,多集中于探讨Slit2在视网膜组织中的神经轴突导向作用以及参与视网膜新生血管的形成。Liu等研究发现,Slit-Robo参与增生性糖尿病视网膜病变中视网膜纤维血管膜的形成。Han等的研究发现Slit2具有抗角膜新生血管作用。本研究中,免疫荧光染色结果显示Slit2在正常对照组和糖尿病模型组角膜上皮中均有表达,实时荧光定量PCR结果显示Slit2及其受体Robo1、Robo2、Robo3、Robo4在糖尿病小鼠中的相对表达量显著高于正常对照组,差异均有统计学意义。在角膜上皮损伤修复后第3天,免疫荧光显示糖尿病模型小鼠角膜上皮中Slit2荧光强度较正常对照组明显降低,Slit2注射组p-EGFR、p-ERK、β-catenin和Ki67荧光强度较正常对照组明显升高。猜测Slit2及其受体在糖尿病模型小鼠角膜上皮中可能处于一种代偿状态,在角膜上皮损伤修复的早期维持角膜上皮的稳定性。
糖尿病对于角膜上皮修复的影响表现为角膜上皮屏障功能受损,角膜上皮损伤愈合延迟,引发反复的上皮糜烂,严重者会导致角膜感染的发生,同时还可引起角膜炎性细胞增加、内皮细胞形态及密度改变、干眼等。已有研究证实糖尿病导致角膜上皮中生长因子的表达量下降。为进一步证实Slit2对于角膜上皮的保护作用,本研究建立小鼠角膜上皮损伤修复模型,造模72 h后角膜荧光素染色发现Slit2结膜下注射可以促进糖尿病小鼠角膜上皮的损伤修复。本研究结果表明,Slit2广泛表达于角膜上皮,并在STZ诱导的糖尿病模型小鼠上皮损伤修复的早期表达显著降低,结膜下注射外源性Slit2可促进角膜上皮修复,发挥上皮保护作用。
研究已证实Slit2发挥作用的细胞通路包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、β-catenin、ERK、Akt、Toll样受体(Toll-like receptor,TLR)4、核转录因子(nuclear transcription factor,NF)-κB、Notch等,大多是在研究Slit2的促癌和抑癌作用中发现的。Slit2通过VEGF促进血管生成,如增强视网膜的新生血管化、增加人肾小球内皮细胞的血管生成,在增生性糖尿病视网膜病变视网膜血管内皮细胞中Slit2和VEGF的表达均升高。本实验结果显示,Slit2可激活糖尿病模型小鼠角膜上皮损伤修复过程中ERK、EGFR和β-catenin信号通路,体外细胞实验也表明其可激活EGFR、AKT和β-catenin信号通路,而Slit2对EGFR的激活作用最为明显。Slit2的最适作用质量浓度为0.5 μg/ml,高糖培养条件下0.5 μg/ml Slit2处理TKE2细胞10 min即对EGFR通路产生激活作用,处理30 min时作用达顶峰,故猜测Slit2在糖尿病模型小鼠中主要通过激活EGFR信号通路发挥保护角膜上皮的作用。
糖尿病对于角膜神经的影响表现为角膜敏感性下降,神经密度降低、分支减少,即使血糖控制良好,也不能完全扭转角膜神经病变,糖尿病患者角膜神经的病变程度与外周神经损伤程度相关。本研究中角膜神经染色结果显示,角膜上皮损伤修复后7 d Slit2结膜下注射可以促进糖尿病模型鼠角膜上皮下神经损伤的修复,体外细胞实验也证实Slit2可以促进高糖环境下TGs突触生长,表明Slit2可在高糖环境下发挥角膜上皮下神经保护的作用。
综上所述,本研究通过体外动物实验和在体细胞实验发现Slit2可促进糖尿病模型小鼠角膜上皮和神经损伤修复,其可能主要通过激活EGFR信号通路来发挥作用。本实验仍存在一定局限性,如未对在体角膜进行定量分析,仅肉眼分辨荧光强度,下一步应结合相关受体进行探讨。本实验是对角膜上皮损伤修复早期的研究,对于角膜上皮损伤修复后何时Slit2的表达可以达到未损伤水平还将继续探讨。另外需对Slit2在糖尿病角膜神经病变中发挥作用的具体机制进一步探索。
利益冲突
所有作者均声明不存在利益冲突作者贡献声明
田乐:参与设计实验、研究实施、数据采集和分析/解释,论文撰写和统计分析;李德卫:参与数据采集、数据分析/解释及统计分析;谢立信、周庆军:参与选题、研究设计、论文智力性内容的修改和审核、最终定稿