番茄斑萎病毒2个非结构蛋白VIGS体系的初步构建
2022-04-11杨婷婷赵立华邱润霜李博文张仲凯马长乐
杨婷婷 赵立华 邱润霜,3 陈 思,3 张 洁 李博文,3 张仲凯 马长乐
(1. 西南林业大学园林园艺学院,云南省高校园林植物与观赏园艺重点实验室,云南 昆明 650233;2. 云南省农业科学院生物技术与种质资源研究所,云南省农业生物技术重点实验室,农业部西南作物基因资源与种质创制重点实验室,云南 昆明 650223;3. 西南林业大学生命科学学院,云南 昆明 650233)
本氏烟(Nicotiana benthamiana)与辣椒(Capsicum annuum)、番茄(Solanum lycopersicum)均属于茄科(Solanaceae)植物,其最早流行于澳大利亚,目前在世界各地的实验室被广泛栽培[1]。本氏烟作为模式植物用于植物-微生物互作、代谢路径、疫苗生产、合成生物学等方面研究,同时因其易受多种植物病毒侵染而广泛应用于病毒的检测和鉴定、病毒诱导的基因沉默的基因功能验证等方面[2-3]。TSWV(tomato spotted wilt orthotospovirus)是布尼亚病毒目(Bunyavirales)、番茄斑萎病毒科(Tospoviridae)、正番茄斑萎病毒属(Orthotospovirus)的代表种,在经济学和科学研究性上位于世界十大植物病毒的第2位[4]。TSWV在我国西南地区大量发生,致使烟草、辣椒以及番茄等经济作物减产减量,造成巨大经济损失[5-7]。本研究通过构建NSm、NSs基因沉默载体,为TSWV基因功能及致病机理的研究提供基础材料,并为TSWV田间绿色防控奠定基础和提供技术手段。
病毒诱导基因沉默技术(VIGS)是指一种将目标基因片段插入病毒载体并使其感染植物,从而抑制内源基因表达并引起相应的生理和表型变化的简单、快速、高效的评估植物基因功能的方法[8-9]。目前,已发现几十种病毒可用作VIGS载体,如马铃薯病毒X(PVX)、甘蓝卷叶病毒(CaLCuV)、烟草脆裂病毒(TRV)、烟草花叶病毒(TMV)、豌豆早褐变病毒(PEBV)、水稻东格鲁杆状病毒(RTBV)[10]等,其中一些已经成功地应用于代谢途径、植物发育、非生物胁迫和生物胁迫的基因功能研究中。研究发现用TRV载体沉默番茄MYB80基因、本氏烟中的高铁还原酶基因FRO1以及南非醉茄(Withania somnifera)中MVA、MEP途径的相关基因能显著增强植物对胁迫的抗性和生长能力[11-13]。VIGS技术已应用于植物病毒的防控方面,如沉默甜椒脂氧合酶基因CaLOX2,发现该基因介导了依赖于茉莉酸(JA)的信号传导,从而导致植株对蓟马产生抗性[14];将番茄中乙烯信号通路负调控基因LeCTR1沉默,可明显减弱活性氧(ROS)的积累和叶片卷曲症状,增强植株对印度东部的番茄曲叶病毒(ToLCJoV)的耐受性[15];沉默本氏烟分子伴侣NbSGT1基因,可强烈抑制TSWV的NSm细胞间的移动,进而抑制TSWV对本氏烟的侵染[16]。与其他VIGS载体相比,TRV能较温和地侵染植株,并且它可以迅速蔓延到整个植物的多种组织和器官,包括叶片、花、根和果实以及分生组织[17-19],且TRV是一种宿主范围广泛的RNA病毒,包括本氏烟、拟南芥(Arabidopsis thaliana)、番茄、辣椒、小麦(Triticum aestivum)、玫瑰(Rosa rugosa)、棉花(Gossypiumspp.)等[18,20-24]。
NSm和NSs是TSWV的非结构蛋白,NSm为病毒的移动蛋白,辅助病毒粒子在细胞内和细胞间运动;NSs为病毒沉默抑制子,通过应对植物RNA沉默防御辅助病毒的侵染[25-26]。但目前TSWV非结构蛋白NSm和NSs对病毒系统侵染及诱导囊泡的机制方面尚不清楚。本研究将TSWV的NSm、NSs基因构建到载体pTRV-PTV00上,通过实时荧光定量PCR定量分析抗TSWV的沉默效率,构建TSWV的NSm、NSs基因沉默载体,这为研究NSm、NSs基因在病毒致病机制方面提供了前期材料和有力依据,为研究与TSWV复制、装配密切相关的囊泡的产生机制提供材料,为实现田间正番茄斑萎病毒属病毒病的绿色防控提供新的方法。
1 材料及方法
1.1 实验材料
本氏烟种子、TSWV毒源由云南省农业科学院生物技术与种质资源研究所植物病毒课题组保存提供;含有PDS基因菌株、PTV00空载体菌株、PBINTRA载体的菌株、GV3101菌株均有昆明植物研究所吴建强课题组提供。NSm和NSs基因PCR引物根据GenBank中TSWV己知基因序列(JF960236.1、JF960235.1)设计,引物序列见(表1),由广州华大基因科技股份有限公司合成。

表 1 实验中采用的引物及序列Table 1 Sequence of the primers used in this study
1.2 TSWV NSm和NSs的VIGS载体构建
按照说明书(Trans)从接种TSWV并具有TSWV症状的烟草叶片中提取总RNA,应用cDNA第1链合成试剂盒(Trans)合成cDNA,利用Q5超保真DNA聚合酶(NEB)进行NSm和NSs序列扩增,反应条件:98 ℃预变性 40 s;98 ℃变性10 s,60 ℃退火 20 s,72 ℃延伸30 s,35个循环,72 ℃终延伸 2 min。将目的基因片段连接到Blunt-Zero(Trans)载体上,应用质粒提取试剂盒(Axygen)提取质粒,采用限制性内切酶BamHI、HindIII同时对该质粒和pTRV-PTV00质粒进行双酶切,用T4 DNA连接酶将目的基因与pTRV-PTV00载体在16 ℃下过夜连接,并于42 ℃热击30 s转化入大肠杆菌(Escherichia. coli)DH5α感受态细胞中。通过菌落PCR鉴定获得阳性克隆后,送至广州华大基因科技股份有限公司进行测序。经序列比对分析,测序正确者则为pTRVPTV00-NSm、pTRV-PTV00-NSs重组载体。
1.3 农杆菌注射
将重组质粒pTRV-PTV00-NSm、pTRVPTV00-NSs通过电击法转入根癌农杆菌GV3101感受态细胞中,在卡那霉素(50 mg/L)和利福平(25 mg/L)的抗性条件下筛选转化子,PCR 鉴定呈阳性的克隆菌液即为 pTRV-PTV00-NSm、pTRVPTV00-NSm 根癌农杆菌菌液。
本实验采用先注射菌液后接种TSWV的处理方式。用渗透缓冲液10 mmol/LMES和MgCl2重悬菌液,取pTRV-PTV00-NSm、pTRV-PTV00-NSs菌重悬液分别与pTRV-PBINTRA(转化pBINTRA质粒的GV3101农杆菌菌株)菌重悬液按1:1体积充分混匀,使用1 mL注射器注射侵染于生长适合的本氏烟叶片。以注射pTRV-PDS(转化 PDS 质粒的 GV3101 农杆菌菌株)菌液为阳性对照,以注射pTRV-PTV00(转化 PTV00 质粒的 GV3101 农杆菌菌株)菌液为空白对照,每组10株,3次重复。待注射pTRV-PTV00-PDS植株10~15 d后心叶开始褪绿、发白,则开始接种TSWV。接种7~10 d后,未注射任何菌液、只接种TSWV的植株出现TSWV发病症状,采样进行沉默效率检测。
1.4 实时荧光定量PCR检测NSm、NSs基因的沉默效率
将TSMVQ、TSNSsQ扩增片段构建到pMD 18-T载体上,并将其阳性质粒连续稀释为具有10倍浓度梯度(10-1~10-6)的质粒为实时荧光定量PCR标准品,建立标准曲线。提取所采样品总RNA,反转录合成 cDNA,再根据KAPA SYBR®FAST qPCR Kit Master Mix(2×)试 剂 盒 进行qRT-PCR,反应条件:95 ℃ 预变性3分钟,95 ℃变性5秒,57 ℃ 退火30 秒,72 ℃ 延伸30 秒,40个循环。
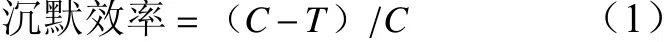
式中:C为只接种TSWV的植株叶片目的基因基因拷贝数的平均值;T为注射沉默载体的植株叶片TSWV 目的基因拷贝数的平均值。
2 结果与分析
2.1 TSWV NSm和NSs的VIGS载体构建结果分析
采集接种TSWV 病毒7~10 d后有明显症状的本氏烟系统叶(接种叶上一叶),提取叶片总RNA,并反转录为模板cDNA,用TSVMF1/TSVMR1、TSVNSsF1/ TSVNSsR1特异性引物扩增含HindIII和BamHI酶切位点的NSm、NSs基因片段。用1%琼脂糖凝胶电泳结果显示,在100~200 bp处出现条带清晰且单一的特异性条带(图1),符合预期结果。将目的条带纯化回收后并连接至Blunt-Zero载体,菌落PCR验证同样获得相同大小片段,送至公司测序,经过软件SnapGene序列比对结果显示成功获得158 bpNSm、150 bpNSs片段。将质粒双酶切验证(图2)后与pTRV-PTV00载体连接,序列分析正确,获得重组载体。通过电击法将重组质粒pTRV-PTV00-NSm、pTRV-PTV00-NSs转化入GV3101中,经菌落PCR验证条带大小正确,成功构建TSWV重组病毒VIGS载体pTRV-PTV00-NSm、pTRVPTV00-NSs,可继续开展沉默效率的检测。
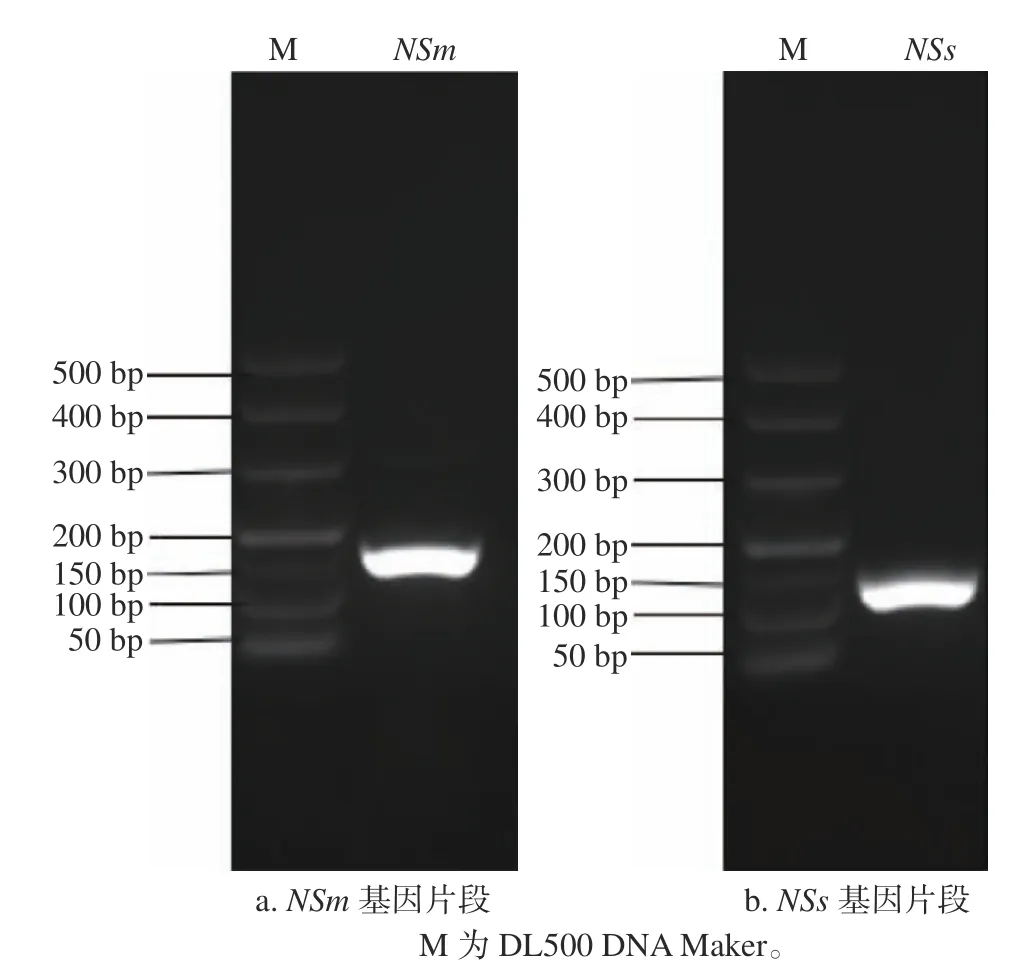
图 1 NSm、NSs基因片段扩增Fig. 1 Magnification of NSm, NSs gene
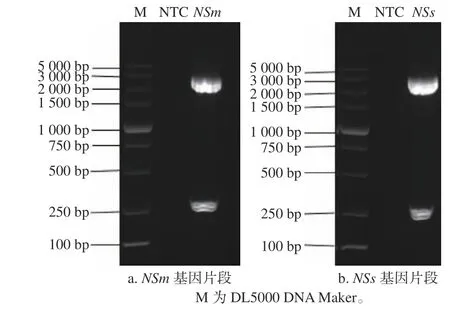
图 2 NSm、NSs基因片段酶切结果Fig. 2 Digestion of NSm, NSs gene
2.2 NSm、NSs基因实时荧光定量PCR标准曲线的建立
通过 特异 引 物TSMVQF1/ TSMVQR1、TSVNSsQF1/ TSVNSsQR1扩增得到73 bpNSm、77 bpNSs基因片段,片段大小符合预期,纯化回收后将目的基因片段连接到pMD18-T上,经Nano Drop 2000浓度测量仪测得NSm质粒浓度为122.286 μg/mL、NSs质粒浓度为141.655 μg/mL,分别以10-2~10-6的5个浓度梯度标准质粒DNA为模板,进行实时荧光定量PCR,得到标椎曲线。NSm与NSs基因标准曲线中Ct值和标准质粒浓度之间呈良好的线性关系,可用于定量分析(图3)。NSm基因标准曲线方程为:Y=-3.705X+35.261,扩增效率为96.162%,相关系数为0.999;NSs标准曲线方程为:Y=-3.70X+34.165,扩增效率为96.309%,相关系数为0.999。

图 3 NSm、NSs基因qRT-PCR标椎曲线Fig. 3 Standard curve of NSm, NSs gene by qRT-PCR
2.3 TSWV基因沉默效果
TRV-PDS作为阳性对照,起指示作用,当植株PDS基因沉默后,植株叶片会受到光漂白而褪绿呈现白色(图4a),而pTRV-PTV00作为阴性对照植株表型则没有变化(图4b),表示空载体对植株表型没有影响。

图 4 本氏烟中沉默PDS基因Fig. 4 Silencing PDS gene in N. benthamiana
通过先注射载体,待阳性对照PDS沉默植株褪绿呈现白色后接种TSWV,显症后采集样品运用实时荧光定量PCR检测TSWV的NSm、NSs基因绝对表达量,结果显示NSm基因沉默效率为86.70%,NSs基因沉默效率为92.00%(图5)。

图 5 NSm、NSs基因沉默效率Fig. 5 Silencing efficiency of NSm, NSs gene
3 结论与讨论
VIGS技术已经广泛用于多种植物的目标基因功能分析,如病毒防御、植物信号转导等,但多是沉默宿主植物内源基因,对于外源病原菌或病毒则鲜见报道。TRV是包含2条正链的RNA病毒,RNA1编码复制酶RdRp、移动蛋白的pTRV1,RNA2编码外壳蛋白、2个非结构蛋白的pTRV2,并改造为其2个独立质粒结构(pBINTRA和pTRVPTV00),pTRV1可以不依赖pTRV2,在植物体内复制并系统移动[27]。将pTRV2上的非结构蛋白替换为多克隆位点可用于克隆约2 000~3 000 bp的目标基因,但有研究报道VIGS插入目标基因最适长度约为200~1 300 bp[28-29]。本研究将TSWVNSm的157 bp和NSs的150 bp插入pTRV-PTV00载体,经浸润本氏烟,成功将TSWV非结构蛋白沉默。这个插入片段小于之前报道的,可能是由于插入的是外源基因,这将更有利于片段的扩增及减少碱基突变。
植物病毒必须克服重重细胞屏障,到达维管组织,才能系统入侵宿主植物[30]。目前研究发现TSWV的NSm、NSs基因与病毒的系统侵染密切相关,但机制有待进一步研究。本研究采用先注射后接毒的方式处理本氏烟,通过实时荧光定量PCR检测发现沉默NSm基因效率为86.7%,沉默NSs基因效率为92%,沉默载体的成功构建为TSWV致病机制的解析提供了技术手段,本研究选择TRV作为VIGS载体,可以侵染植物分生组织,且其引起的症状较温和,这将有利于基因沉默表型观察及提高沉默效率。
TRV-VIGS技术由于其宿主广泛、沉默效率高、周期短等优点,近年来广泛应用于植物发育、代谢物的生物合成、生物和非生物胁迫耐受以及植物进化的各个方面,本研究也成功沉默TSWV的非结构蛋白。选用本氏烟作为浸润载体可保证高的转化效率。但仍可能存在沉默脱靶基因、沉默不完全、沉默不一致等缺点,且TRV可能改变植物的代谢或基因表达,还可能引起相关表型改变。为解决这些问题,可以增加重复试验,设置对照组,改良载体等。本研究通过TSWV非结构蛋白的VIGS载体构建,为TSWV非结构蛋白在病毒致病机制等方面的解析提供基本材料,为TSWV的绿色防控提供有力新的路径。
TSWV在我国多省市发生,严重影响烟草、辣椒以及番茄等经济作物,甚至造成巨大经济损失。本研究通过pTRV-PTV00载体构建NSm、NSs基因沉默载体,沉默效率接近90%,为TSWV基因功能及致病机理的研究提供基础材料,并为TSWV田间绿色防控提供了技术手段。
