橙子皮提取物对HCl溶液中铝的缓蚀作用研究
2022-04-11李向红
张 富 徐 昕 雷 然 李向红
(1. 西南林业大学化学工程学院,西南地区林业生物质资源高效利用国家林业和草原局重点实验室,云南 昆明 650233)
金属材料使用范围颇为广泛,但金属腐蚀的问题不仅严重影响生产工艺效率,而且造成巨大的经济损失,同时造成环境污染问题,金属防腐蚀问题的研究显得尤为紧迫。铝是地壳中含量最多的金属元素、应用最广的有色金属材料,金属铝及其合金被广泛应用于运输、食品、电子电器、建筑、航空航天、化工生产等行业领域[1]。由于铝为活泼金属,铝的表面在使用过程中易形成一层致密的氧化膜,可以有效保护铝基体免遭腐蚀,但表面氧化膜会溶于酸性或碱性溶液中,进而使铝基体进一步发生腐蚀。此外,由金属铝的电位-pH图可知,在pH<4.0或pH>8.5的环境介质中金属铝处于腐蚀区,均会发生析氢腐蚀。盐酸溶液常用于铝及其合金的酸洗、去污和蚀刻等化工操作,在实际应用中需要添加缓蚀剂来防止HCl溶液对铝基体的腐蚀[2]。目前,已经研制出多种盐酸酸洗过程中对铝具有良好缓蚀性能的商品缓蚀剂,如SH-904、Lan-826和Lan-5[3]。唐俊杰[4]通过正交试验研发制备出3%盐酸介质中对铝有良好的缓蚀效果的苯扎溴铵与肉桂醛等的JT-1和JT-2型复配缓蚀剂。焦庆祝等[5]将杂环化合物与季铵盐复配得JA-1型缓蚀剂,不仅有较好的缓蚀性能,且在耐酸度抗高温方面都表现出较好的优势。然而,绝大多数商品缓蚀存在成本高、毒性大、污染环境的局限性[6]。近年来,从植物中提取制备的高效、环保、可降解的环境友好型植物缓蚀剂将成为当今乃至将来缓蚀剂研发的重点和热点之一[7]。目前,通过研究发现巴戟天属(Morinda)菘蓝叶(Morinda tinctoria)提取物[8]、可乐树(Kola nitida)[9]、酒椰橡胶(Raphia hookeri)分泌物[10]及迷迭香(Rosmarinus officinalis)萃取物[11]等对酸性介质中铝腐蚀有很好的抑制效果。本课题组也一直致力于绿色环保型缓蚀剂的研究,曾研究报道过HCl介质中对铝有良好缓蚀效果的有竹叶提取物[12]、迎春花叶提取物[13]等。
我国是农业大国,农产品水果产量逐年上涨。据报道,2018年我国橙子(Citrus Sinensis)产量达4 799.6万t,而70%的橙子用于加工[14]。橙子皮即为橙子加工利用后的废料,橙子皮中主要含有橙皮苷、果胶、维生素、色素、萜类化合物、香精油等化学成分[15],活性成分最多的是黄酮类化合物。橙子皮提取物对铁在酸性介质中缓蚀研究已开始涉及,但缓蚀剂浓度为4.5 g/L时,橙子皮酸提取物对铁在硫酸溶液中的缓蚀率为85%以上[16]。本研究则进一步采用乙醇水溶液作为提取溶剂从橙子皮中得到橙子皮缓蚀剂,采用失重法、电化学法、扫描电子显微镜(SEM)和原子力显微镜(AFM)研究了橙子皮提取物(OPE)对铝在盐酸介质中的缓蚀性能及作用机理,以便进一步为橙子皮废弃物作为金属缓蚀剂的研发提供一定理论依据。
1 材料与方法
1.1 材料与试剂
铝片(各元素含量为Si:0.15%、Cu:0.024%、Fe:0.30%、Mg:0.002 5%、Ti:0.001%,其余为Al);市售橙子取橙子皮晒干;粉碎机。所用无水乙醇、HCl(37%)、丙酮、石油醚均为分析纯。
1.2 实验方法
1.2.1OPE制备及光谱表征
将橙子皮晾晒干后用DFY-500粉碎机(温岭市林大机械有限公司,中国)粉碎,粉碎后过40目(350 μm)筛,取粉碎后橙子皮粉末10 g于圆底烧瓶,用40%无水乙醇溶液浸泡2 h,70 ℃水浴锅中回流3 h,抽滤后将滤液旋蒸至100 mL左右,再用等量石油醚萃取,至上层液澄清,取下层浓缩至30 mL左右,置于烘箱烘干称量(产率为17%)。
红外光谱(FTIR)通过对橙子皮提取物成分的官能团分析,可初步确定其是否有作为金属缓蚀剂的潜力。红外光谱(FTIR)测试仪器为AVATAR-FTIR-360红外光谱仪(Thermo Nicolet,美国),将少量OPE粉末置于玛瑙研钵中,然后加入KBr(光谱纯)混匀压片,测试波数为400~4 000 cm-1范围。
1.2.2失重法测试
将2.0 cm × 2.5 cm × 0.6 mm的铝片试样分别用600#、1200#、1500#的砂纸进行由粗到细逐级打磨,丙酮擦拭脱脂后隔绝空气密封保存,备用。将打磨好的铝片用电子天平(精确到0.1 mg)称量初始质量后,用玻璃钩全浸静置于不含或含一定质量浓度OPE(c)的1.0 mol/L HCl溶液中浸泡2 h,取出后用脱脂棉擦洗铝表面的腐蚀产物,然后用蒸馏水反复冲洗,吹风机冷风吹干后,再次称取质量,得到铝片试样浸泡前后的质量差,根据公式(1)~(2)计算铝片的腐蚀速率(ν)及OPE的失重法缓蚀率(ηw):
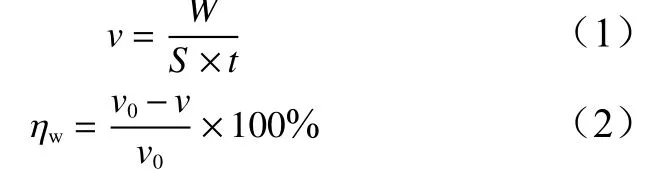
式中:W为铝样品腐蚀前后质量损失量,S为铝样品表面积,t为的浸泡时间;v0、v为不含和含有一定浓度缓蚀剂的冷轧钢片的腐蚀速率。
1.2.3电化学法
将铝片试样裁剪为1.0 cm × 1.0 cm大小,用焊锡丝将铜线与铝片焊接,用环氧树脂(固化剂为聚酰胺树脂)灌封制得工作电极。电化学测试仪器为PARSTAT2273电化学工作站(Princeton Applied Research,美国),测试前工作电极的裸露面用细砂水磨后在测试溶液(添加不同浓度OPE的1.0 mol/L HCl)中浸泡30 min,待电极电势稳定,先后测试阻抗图谱和动电位极化曲线,测试时铂电极为辅助电极,饱和甘汞电极作为参比电极。扫描区间设定为-250~250 mV,扫描速率为0.5 mV/s,阻抗图谱测试频率范围在0.01~105Hz,交流激励信号幅值为10 mV。
1.2.4SEM、AFM测试
通过Sigma 300扫描电子显微镜SEM(蔡司,德国)和Dimension edge原子力显微镜AFM(布鲁克,德国)分别测定浸泡前的铝片及在含和不含OPE的1.0 mol/L HCl溶液中浸泡2 h后的铝片表面微观形貌。
2 结果与分析
2.1 OPE的FTIR分析
图1为乙醇提取法所得OPE缓蚀剂的FTIR谱图,乙醇水溶剂提取物OPE主要化学成分为橙皮苷(二氢黄酮甙)[17],由于受甙和甙元羟基影响,羰基(C=O)波数降低至1 625.90 cm-1处;橙皮苷以及维生素C中都含大量的—OH,3 408.02 cm-1处出现强吸收峰;2 931.63 cm处的弱吸收峰可能是C—H伸缩振动引起的;1 062.71 cm-1有中强吸收峰,判断为脂族和苯环的C—O—C;1 260~1 411 cm-1范围内的弱而宽的吸收峰,为O—H变形振动吸收峰;603.68 cm-1处的弱峰可能是橙皮素与醇反应后的葡萄糖和鼠李糖中的环呼吸峰引起的。FTIR结果表明橙子皮提取物中含有大量羟基,羰基等不饱和有机化合物的极性基团,通过文献推测[18],含这些官能团的有机化合物可用作金属酸洗缓蚀剂。

图 1 OPE的FTIR图Fig. 1 FTIR of OPE
2.2 失重法测试OPE的缓蚀性能
在20、30、40、50 ℃条件不同浓度OPE铝在1.0 mol/L HCl溶液中浸泡2 h的缓蚀率效果如图2所示。随着OPE浓度的增加,缓蚀效果不断增强,在20 ℃条件下,OPE浓度达300 mg/L后,ηw随浓度变化趋于稳定,最高ηw达98%以上,说明OPE作为缓蚀剂,低温更有利于抑制盐酸对铝的腐蚀。相反,温度越高,ηw越低。初步表明高温不利于OPE在铝表面发生吸附作用,从而ηw降低,可能是因为高温条件下铝表面的腐蚀程度加剧,表面析出的氢气气泡增加,导致OPE难以稳定吸附作用于铝表面,或者使已吸附的缓蚀剂分子发生脱附。

图 2 不同温度下1.0 mol/L HCl中的ηw与c关系Fig. 2 Relationship between ηw and OPE concentration(c) in 1.0 mol/L HCl solution at different temperatures
2.3 吸附热力学及腐蚀动力学分析
对失重法实验数据进行吸附等温式拟合,发现Langmuir吸附等温式(公式(3))拟合线性相关最好:

式中:θ为表面覆盖度,K为吸附平衡常数。
由图3和表1均可看出,根据Langmiur吸附等温式所作的c/θ与OPE浓度拟合直线相关性较好,各温度的线性相关系数(r)十分接近1,说明在HCl介质中,OPE在Al表面的吸附符合Langmiur吸附方程式。温度为20 ℃和30 ℃时,拟合直线斜率近似等于1,故在此温度下,缓蚀剂分子在铝表面的吸附膜层间的相互作用力基本可以忽略;而当温度升至40 ℃和50 ℃时,斜率逐渐偏离1,说明OPE吸附分子间存在作用力,或表面吸附不均匀[19]。

图 3 不同温度下1.0 mol/L HCl中的c/θ - c直线Fig. 3 Straight lines of c/θ - c in 1.0 mol/L HCl solution at different temperatures
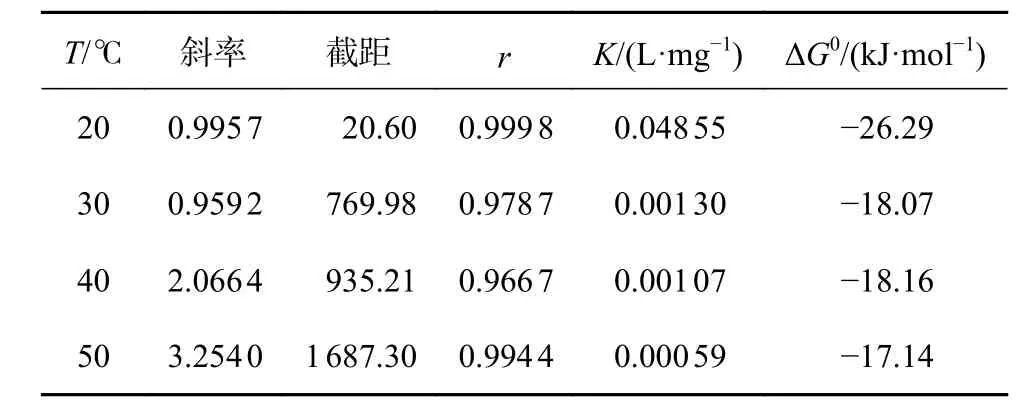
表 1 c/θ - c直线回归参数及标准吸附Gibbs自由能Table 1 Linear regression parameters of c/θ - c and standard adsorption Gibbs free energy ΔG0
K与标准吉布斯自由能(ΔG0)有关(如公式(4))各温度下ΔG0计算值均列在表1中,各温度下ΔG0均为负值表明OPE在金属铝表层的吸附为自发过程,且在低温时-20 kJ/mol≤ΔG0≤-40 kJ/mol,即OPE缓蚀剂在铝片表面吸附作用既有共价键化学吸附,又有静电力物理吸附;而在30、40、50 ℃时ΔG0都小于-20 kJ/mol,即表明OPE在铝样品表面的吸附是以物理吸附为主的混合型吸附。根据阿伦尼乌斯公式如公式(5)。
若对lnν和T-1作图,线性拟合得到的斜率和截距可以通过式(5)计算Ea和lnA,见图4,随着缓蚀剂OPE浓度增加,Ea和lnA均增大,说明铝在含OPE的缓蚀体系中活化能增大,腐蚀反应较难发生,即OPE能有效抑制铝在盐酸的反应,从而达到缓蚀效果。

图 4 1.0 mol/L HCl溶液中Ea随c变化关系图Fig. 4 Relationship between Ea and c in 1.0 mol/L HCl solution
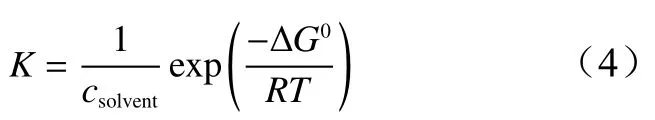
式中:R为理想气体常数,T为热力学温度,csolvent为缓蚀体系中水的浓度,此处近似取1.0 ×106mg/L。

式中:v为腐蚀速率常数,R为气体常数,T为热力学温度,Ea为反应表观活化能,A为指前因子。
2.4 电化学试验结果分析
2.4.1极化曲线
由图5可知,在同一腐蚀电位下,阴极极化曲线随着OPE质量浓度增加腐蚀电流密度对数减小,阳极极化曲线则未随OPE质量浓度浓度增加而发生抑制作用,说明在1.0 mol/L HCl介质中提取物OPE主要通过抑制阴极析氢反应从而对铝起缓蚀作用,阴极极化曲线呈现出明显的Tafel直线区,说明铝电极的析氢反应过程由活化极化控制[20],即橙子皮提取物通过吸附在阴极活性腐蚀位点上从而阻碍了析氢腐蚀反应。
对图5进行Tafel线性外推法拟合的电化学参数见表2,与空白组对照,加入橙子皮提取物后铝电极的腐蚀电位(Ecorr)以及阴极Tafel斜率(bc)变化微小,说明OPE的加入并未改变铝电极在HCl中的腐蚀反应机理,但腐蚀电流密度(icorr)明显降低,即OPE在铝表面发生吸附从而有效降低腐蚀速率。

图 5 20 ℃时铝在不含和含OPE的1.0 mol/L HCl溶液的动电位极化曲线Fig. 5 Potentiodynamic polarization curves of aluminium in 1.0 mol/LHCl solutions without and with OPE at 20 ℃

表 2 20 ℃时铝在1.0 mol/L HCl中的动电位极化参数Table 2 Potentiodynamic polarization parameters for aluminium in 1.0 mol/L HCl at 20 ℃
极化曲线法的缓蚀率(ηp)按公式(6)计算。
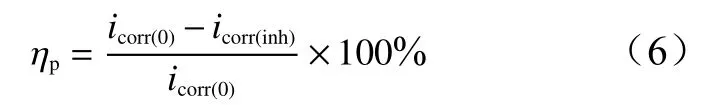
式中:icorr(0)和icorr(inh)分别为铝电极在不含和含OPE的1.0 mol/L HCl溶液中的腐蚀电流密度(μA/cm2)。由表2可知,当缓蚀剂浓度为1.0 g/L时,ηp高达86.83%,表明OPE对铝在HCl溶液中具有良好的缓蚀性能。
2.4.2电化学阻抗谱(EIS)
由图6可知,图谱表现为高频区的容抗弧,和低频区同样大小的感抗弧组成的椭圆形状,有研究显示铝电极在盐酸中会出现类似特殊阻抗谱[20-21]。低频区感抗弧可能与电极表面Cl-[22]、H+[23]、缓蚀剂分子的吸附或脱附有关。容抗弧为圆心在实轴之下的半圆弧,说明电极反应过程中存在因电极表面粗糙而引起弥散效应[23]。高频区容抗弧随OPE浓度增大明显在增大,但形状并未发生改变,表明铝电极在加了OPE的HCl溶液中腐蚀反应电阻变大,阻碍腐蚀反应进行,且加入OPE缓蚀剂后没有改变腐蚀反应机理。
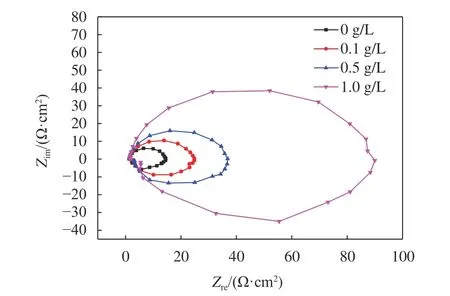
图 6 铝电极在含不同OPE浓度的1.0 mol/L HCl中的Nyquist图谱Fig. 6 Nyquist diagrams of aluminium in 1.0 mol/L HCl solutions without and with OPE at 20 ℃
阻抗图谱通过图7所示的有效电路图对实验数据进行拟合,表3是由阻抗谱数据拟合电路图得到的相关参数:CPE为常相位角原件,Rs为溶液电阻,Rt为电荷转移电阻,RL为电感电阻,L是电感。由表3可知,拟合卡方方差(χ2)很小说明电路图与阻抗数据拟合相关性较好;且弥散系数(n)接近1,说明电极/溶液界面的频率弥散效应较小;随着橙子皮提取物浓度增加,Rt增大,说明OPE能够有效控制了腐蚀过程中的电荷转移。RL和L均随缓蚀剂浓度的增加而增大,这可能是由于缓蚀剂分子在电极表面的吸脱附引起的不稳定状态有关。
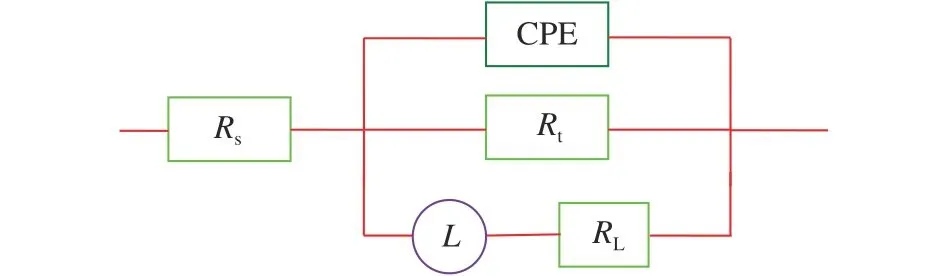
图 7 EIS数据拟合电路图Fig. 7 Equivalent circuit used to fit the EIS data
EIS法的缓蚀率(ηR)按公式(7)计算。
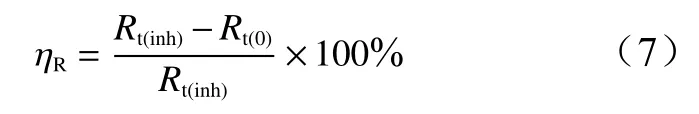
式中:Rt(inh)、Rt(0)分别为铝电极在不含和含OPE的HCl溶液的电荷转移电阻。
从表3可知,ηR随OPE浓度用量的增加而增大,在1.0 g/L时最大缓蚀率为84.96%,表明OPE对铝在HCl溶液中具有优良的缓蚀性能,此规律与失重法和极化曲线得出的结果一致。
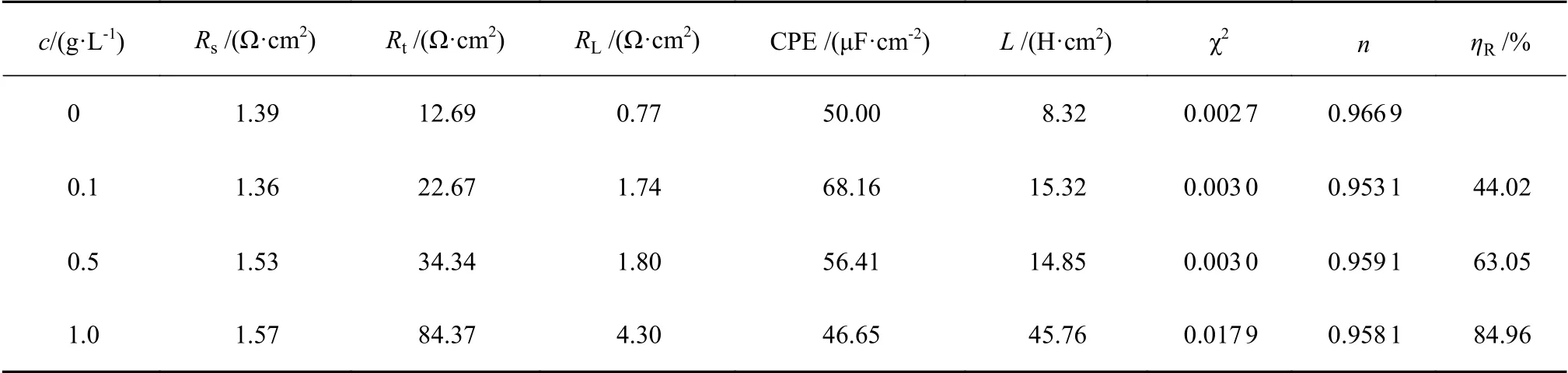
表 3 20 ℃时铝在不含和含OPE的1.0 mol/L HCl中的EIS拟合参数Table 3 EIS fitting parameters for aluminium in 1.0 mol/L HCl without and with OPE at 20 ℃
2.5 表面腐蚀形貌分析
2.5.1SEM微观形貌
为更进一步探索橙子皮提取物对铝样品的缓蚀性能以及机理,对加入OPE前后的铝表面进行微观形貌观察。图8a为浸泡前的铝样品,表面有砂纸打磨过留下的痕迹;图8b为酸腐蚀后的铝样品,表面腐蚀情况严重,呈现台阶式腐蚀,这些腐蚀产物膜层较为疏松,不能阻挡腐蚀粒子对铝基体的进一步持续腐蚀;图8c为铝样品在添加OPE缓蚀剂后的酸介质中反应2 h后的铝表面形貌,表面覆盖着一层物质,腐蚀程度明显减轻,能有效阻隔腐蚀介质对铝表面的腐蚀;值得注意的是,覆盖膜层出现龟裂,可能是干燥时间过长而引起的水分挥发所致。

图 8 铝表面SEM微观形貌Fig. 8 SEM micrographs of aluminium surfaces
2.5.2AFM微观形貌
原子力显微镜可以提供高分辨的三维微观形貌和表面粗糙度的定量化参数,已成为材料表征的重要分析测试方法[24]。为了对比研究缓蚀前后铝表面的微观形貌及粗糙度,在此用AFM进行表征。图9为400 nm倍镜下,不同条件铝片表面的3D-AFM微观形貌。图9a为经砂纸打磨未浸泡的铝片,表面较为平整,均方根粗糙度(Rq)为0.022 7 μm;图9b为在HCl介质中浸泡2 h后表面腐蚀形貌,Rq为0.128 μm;图9c为在添加了1.0 g/L OPE的HCl溶液中浸泡6 h后的铝片,Rq为0.042 4 μm,粗糙程度明显降低。说明OPE在铝片表面吸附有效抑制了腐蚀介质的侵蚀。

图 9 铝表面AFM微观形貌Fig. 9 AFM micrographs of aluminium surfaces
3 结论
OPE含丰富的端羟基以及大量长碳链,黄酮类有效成分对铝在1.0 mol/L HCl介质中有显著的缓蚀作用,缓蚀效果随温度升高反而降低,当20 ℃时,OPE缓蚀率可达98%以上。
OPE缓蚀剂以静电物理吸附为主的混合吸附形式吸附在铝表面,符合Langmuir吸附等温式,吸附平衡常数随温度的升高而减少;铝在HCl中的腐蚀符合Arrehnius公式,随着OPE浓度增大,表观活化能增大。
电化学测试表明OPE主要通过抑制阴极析氢反应来起到缓蚀作用,可归属于抑制阴极型缓蚀剂;OPE吸附在HCl/铝电极界面,有效阻碍电荷转移,屏蔽电流传递,进而使得铝在HCl介质中的腐蚀速率降低。
