新型杀螨剂β-酮腈及其衍生物的研究进展
2022-04-11张耀海赵其阳崔永亮陈爱华王成秋焦必宁
左 巍,李 晶,董 超,张耀海,赵其阳,崔永亮,陈爱华,何 悦,王成秋,焦必宁
(西南大学柑桔研究所,重庆 400712)
植食性害螨具有繁殖能力强、生命周期短、易产生抗药性等特点,是造成世界各地农作物减产的主要害虫。近年来,该类害螨危害趋势加重,并且现今使用的杀螨剂导致螨类抗药性问题频发,因而迫切需要研制出新型杀螨剂来取代常规杀螨剂。其中,β-酮腈及其衍生物类杀螨剂以高效低毒、作用方式新颖等优点在一众杀螨剂中脱颖而出,受到广泛关注。同时,因该类杀螨剂具有速效性好、药效持久、对环境友好和对非靶标生物安全等优点,极大地促进了其在有害生物综合治理上的应用[1-3]。
本文将以已经研发上市的丁氟螨酯(Cyflumetofen)、腈吡螨酯(Cyenopyrafen)和乙唑螨腈(Cyetpyrafen)作为此类农药的典型代表,从研发历程、化学结构、作用机理、生物活性、环境影响、残留检测和抗性等几个方面进行综述,并对其发展前景进行展望,旨在为β-酮腈及其衍生物类杀螨剂的后续深入研究提供参考。
1 研发历程
日本大冢化学公司在1999年发现苯酰乙腈类化合物有杀螨活性,之后通过优化试验研制出了新型酰基乙腈类非内吸性杀螨剂丁氟螨酯[4],其化学名称为(RS)-2-(4-特丁基苯基)2-氰基-3-氧代-3-(α,α,α-三氟-邻甲苯基)丙酸-2-甲氧乙基酯,是以叔丁基苯乙腈、碳酸二甲酯、邻三氟甲基苯甲酰氯作为原料,经过酯交换和缩合反应而成,并于2007年首次在日本获准登记并销售。丁氟螨酯主要用于果树和蔬菜等作物上的植食性害螨防治[1],尤其对幼螨的杀虫活性最高。值得关注的是,有学者在2020年采用生物电子等排策略制成了丁氟螨酯类似物(Sila-Cyflumetofen)(图1),该活性物质保留了较高水平的杀螨活性和良好的药理特性[5]。日本日产化学工业株式会社于2009年推出腈吡螨酯,其化学名称为(E)-2-(4-叔丁基苯基)-2-氰基-1-(1,3,4-三甲基吡唑-5-基)烯基-2,2-二甲基丙酸酯,同年以商品名Starmite(Nissan)和Valuestar在日本和韩国注册登记,并于2017年在中国首次获得临时登记(95%腈吡螨酯和30%腈吡螨酯悬浮剂)[6]。目前针对腈吡螨酯的合成工艺已有较多报道[7-9]。在此之后,沈阳化工研究院在腈吡螨酯的结构基础上进行结构修饰,成功研发出新型杀螨剂乙唑螨腈,其化学名为(Z)-2-(4-叔丁基苯基)-2-氰基-1-(1-乙基-3-甲基吡唑-5-基)乙烯基-2,2-二甲基丙酸酯,并于2015年在我国获得临时登记,2017年正式投入市场[10]。除此之外的同类杀螨剂尚处于研发中,例如SYP-10898和NC-510。其中,SYP-10898是以丁氟螨酯为基础,使用苯基替换甲氧基进行合成[11],而NC-510是以硫代苯甲酰胺为起始原料,经环化、取代、酰化等一系列反应合成[12]。
2 化学结构
此类杀螨剂按化学结构可分为β-酮腈类杀螨剂和β-酮腈衍生物类杀螨剂(图1)。其中,β-酮腈类杀螨剂包括丁氟螨酯、丁氟螨酯类似物和SYP-10898。这些化合物均为含有1个手性碳原子的手性农药,以外消旋体的形式存在。β-酮腈衍生物类杀螨剂包括NC-510、腈吡螨酯和乙唑螨腈。此类化合物中含有双键,存在顺反异构体,腈吡螨酯和乙唑螨腈分别为E-构型和Z-构型,而NC-510目前尚处在进一步研发中。
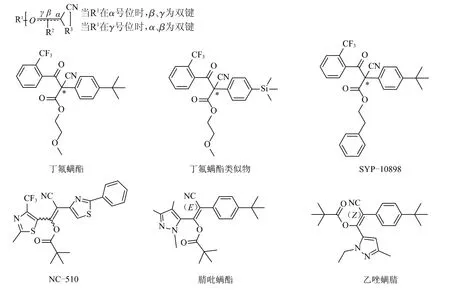
图1 β-酮腈及其衍生物类杀螨剂结构式
3 作用机理
β-酮腈及其衍生物类杀螨剂的主要作用方式为触杀和胃毒,内吸性较弱。此类杀螨剂均为前体杀螨剂,进入靶标后会在其匀浆组织内迅速代谢活化,去酰水解而产生活性物质,但丁氟螨酯可能先被酯酶催化水解后再自发脱羧活化,而腈吡螨酯则可能是直接自发水解活化[13](图2)。有文献表明,丁氟螨酯的去酯化形式(丁氟螨酯在螨虫中的代谢产物)在相当低的剂量下就会强烈抑制螨虫线粒体蛋白复合物Ⅱ的电子传递运输功能,使电子(氢)传递受到干扰,破坏磷酸化反应,从而达到防治卵、若螨和成螨的效果[14-15]。一方面,代谢产物显著促进了目标部位的杀螨活性;另一方面,丁氟螨酯和去酯化代谢物对非靶标生物的复合物Ⅱ表现出非常差的电子转移抑制活性。因此,丁氟螨酯对非靶标生物的安全性归因于其对靶点的高选择性[1,3]。β-酮腈及其衍生物类杀螨剂在触杀螨虫的同时,还能通过影响害螨的生长发育而延长药效[16-17],对螨虫暴发和成灾有着积极的防治意义。这不仅能降低使用杀螨剂的频率,节约成本,达到农药“减量增效”的效果,还能减少残留危害,有益于环境安全。
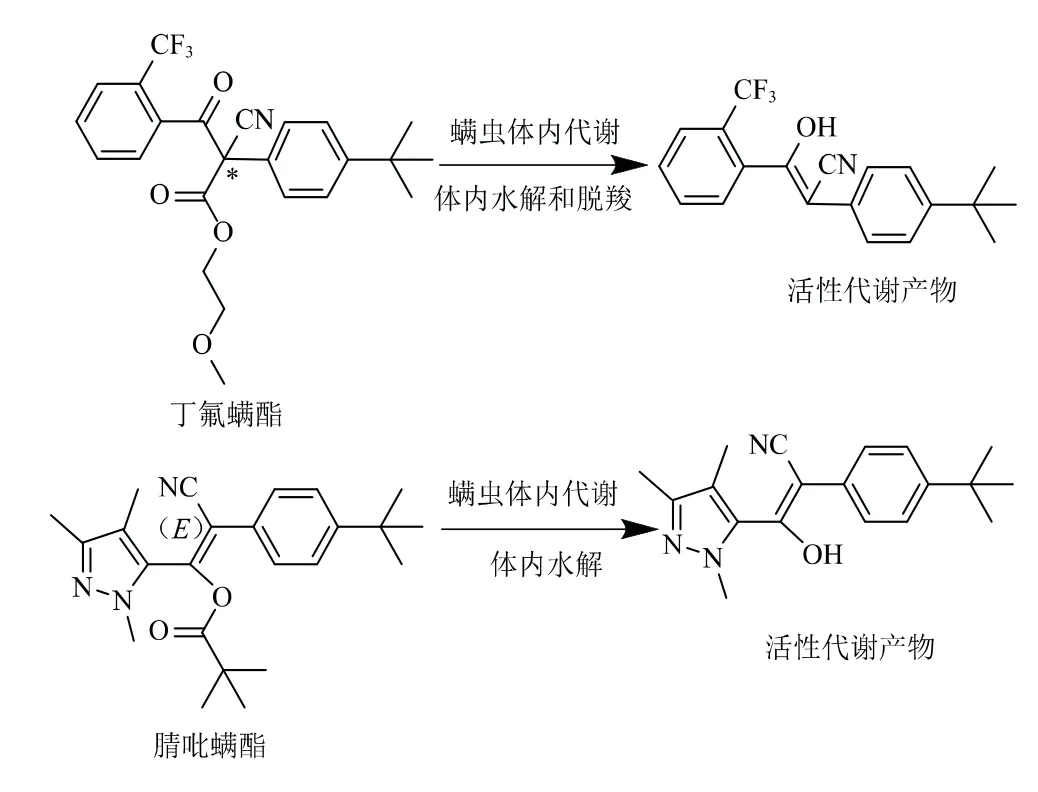
图2 丁氟螨酯和腈吡螨酯在植食性害螨体内的代谢过程
4 生物活性
β-酮腈及其衍生物类杀螨剂对各个生长阶段的植食性害螨均能表现出良好的生物活性,其速效性好,持效性长的优点可以降低使用成本。例如,经丁氟螨酯处理过的成螨在24 h内瘫痪。同时,丁氟螨酯还具有杀卵活性[18]。通过生物电子等排方式[19]获得的丁氟螨酯类似物在50和200μg/mL浓度下表现出与丁氟螨酯一样好的杀螨活性。在酶抑制试验中,其代谢物相较于丁氟螨酯代谢物表现出更强的酶抑制作用,半抑制浓度(IC50)为(0.001 6μg/mL),低于丁氟螨酯代谢产物的IC50值(0.002 5μg/mL)[5]。值得关注的是,部分β-酮腈及其衍生物类杀螨剂含有同分异构体,其生物活性在低浓度下有较大差异:在2.0 mg/L以上时,腈吡螨酯及其异构体的活性均达90%以上;在低至1.0 mg/L时,腈吡螨酯(E体)对红爪螨的作用效果高于其异构体(Z体)30%左右[8,29];在2.5 mg/L时,乙唑螨腈(Z体)对朱砂叶螨的活性优于其异构体(E体)[2],推测原因是不同构型与作用位点结合的难易程度不同。
目前,关于β-酮腈及其衍生物类杀螨剂进行的药效试验主要集中在蔬菜上。潘林芳等[20]在大棚进行了3种药剂(20%丁氟螨酯悬浮剂、110 g/L乙螨唑悬浮剂、5.7%甲氨基阿维菌素苯甲酸盐水分散粒剂)对黄瓜红蜘蛛的药效试验,发现在施用丁氟螨酯1 d后的防效就已高达67.84%,其防效高于乙螨唑,且效果稳定。在针对山楂叶螨的药效试验中也发现了相似的结论[21]。王莹等[22]在试验点施用包含腈吡螨酯在内的5种杀螨剂以研究其防治茄子二斑叶螨的效果。结果显示,30%腈吡螨酯悬浮剂3 000倍液的速效性和持效性最高,施药后1 d的防效即达到93.20%,其防效远高于螺螨酯、克螨特等;药后3~14 d,其防效在98%以上。杨国璋[9]研究发现,当使用50 mg/L的腈吡螨酯进行田间试验时,药后1 d的防效在98.74%,其防效显著优于螺螨酯,且和嘧螨酯的防效相当。
关于β-酮腈及其衍生物类杀螨剂对水果上害螨的药效研究也有较多报道。冯聪等[23]在对柑橘全爪螨施用乙唑螨腈1~3 d后,发现其防效超过85%,持效期可达30d左右。王彦博等[24]进行了7种药剂对柑橘全爪螨的室内毒力及田间防效研究,发现最终室内毒力(LC50)从大到小分别为乙唑螨腈(0.818 mg/L)、丁氟螨酯(4.645 mg/L)、印楝素(4.878 mg/L)、氟啶胺(16.844 mg/L)、哒螨灵(21.167 mg/L)、乙螨唑(69.834 mg/L)、螺虫乙酯(417.089 mg/L);在进行的田间药效试验中发现,20%丁氟螨酯悬浮剂和30%乙唑螨腈悬浮剂的速效性和持效性均较好,施药后1 d的防效均在87%以上,30 d后,2种农药的防效仍在90%以上,药效显著优于其余药剂。周晓肖、张颂函、陈金翠等[15,25-26]研究结果均表明,30%乙唑螨腈悬浮剂对草莓二斑叶螨的防效优异,速效性好,在使用剂量为56.25~75 g/hm2的条件下,3~14 d的防效一直稳定在90%以上。翟浩等[27]在进行腈吡螨酯及其混剂对苹果红蜘蛛的田间防控试验中发现,单独使用100.0 mg/L的30%腈吡螨酯悬浮剂时,药后20 d内的防效均高于96%,持效期可长达20 d。此外,由腈吡螨酯与螺虫乙酯或乙螨唑组成的混剂对害螨的防效也十分显著。
在其他方面,钱斌彬等[14]研究发现,在红蜘蛛的初发期对铁皮石斛施用丁氟螨酯进行防治即可达到较好效果,推荐使用浓度为1 500~2 000倍液(有效含量为60.0~80.0 g/hm2)。宋长贵等[28]将20%丁氟螨酯悬浮剂设置成高、中、低3个浓度梯度对桑树上的朱砂叶螨进行防治,发现施药后14 d内,3种浓度对害螨的防效均不断升高,并在第14 d达到最高防效,表明该药剂对朱砂叶螨的防治作用较强,且持效时间长。
综上研究发现,β-酮腈及其衍生物类杀螨剂对叶螨科类害螨有良好的防效,可广泛应用于蔬菜、水果或其他农作物。一般来说,此类药剂对螨卵和成螨的活性低于幼螨和若螨;此类药剂之间相比较而言,乙唑螨腈对若螨和成螨的毒性高于丁氟螨酯和腈吡螨酯,原因之一在于前者最佳防治温度正是害螨发生的适温范围(15~35℃)[13,30],而SYP-10898对成螨的活性优于同类化合物丁氟螨酯,但是对于若螨和螨卵的活性要低于丁氟螨酯[11]。
5 环境影响
5.1 环境毒理研究
赵桂玲等[31]以不同浓度梯度的丁氟螨酯对蚯蚓进行了急性染毒试验,将蚯蚓染毒48 h后,测定了蚯蚓体内2种抗氧化酶活性的变化,发现不同浓度梯度的丁氟螨酯对蚯蚓没有产生胁迫作用,并且对其体内抗氧化酶活性基本无影响。Feng等[32]报道了乙唑螨腈对大草蛉的存活率、生长和繁殖的影响。接触毒性生物测定结果显示,乙唑螨腈对大草蛉的卵孵化率、幼虫存活率和化蛹率的影响不显著,表明乙唑螨腈对大草蛉的接触毒性较低,这为后续将乙唑螨腈运用在有害生物综合治理计划上提供了有利的支撑。蜜蜂在自然界中占有重要地位,是授粉的主力军。Ahn等[33]研究结果表明,丁氟螨酯和腈吡螨酯对蜜蜂毒副作用均较低,可见β-酮腈及其衍生物类杀螨剂在推荐使用剂量下对非靶标生物安全性较高。高腾飞等[34]在手性对映体水平开展了丁氟螨酯对斑马鱼从胚胎发育成幼鱼的影响试验,发现丁氟螨酯外消旋体及其对映体均会对斑马鱼产生毒害作用,使其发育受损,主要毒性现象包括自主运动次数减少、卵黄囊和心包囊肿大等,并且S-CYF(丁氟螨酯)的毒性作用远大于其对映体R-CYF。此外,有学者进行了关于丁氟螨酯对高等动物毒性的研究,如Sun等[35]研究了丁氟螨酯对人肝癌细胞的毒副作用,发现毒力强度由大到小依次为(-)-CYF、rac-CYF、(+)-CYF,说明丁氟螨酯及其对映体的毒性应受到重视,并且该研究结果为(+)-CYF作为rac-CYF的潜在替代品应用于农业生产提供了可能性。
5.2 环境行为研究
β-酮腈及其衍生物类杀螨剂是一类易降解农药,不具有生物放大作用。目前,此类杀螨剂的环境行为研究主要集中在水、土壤介质和水-沉积物系统中。
李敏敏[36]研究发现,丁氟螨酯外消旋体在不同条件下水解速度不同。在酸性条件下和较低温度下水解较慢,且水解速度随着水解温度的升高而加快,两者呈正相关。通过观察双因素方差分析结果发现,pH比温度更能影响丁氟螨酯在水中的降解速率,并且不同水质对于丁氟螨酯的降解也有影响。该研究还发现,在推荐剂量下施药后5 d,丁氟螨酯代谢物邻三氟甲基苯甲酰胺(B-3)达到最大值0.004 7 mg/kg;在5倍推荐剂量下施药后3 d,B-3达到最大值0.008 1 mg/kg;在21 d时依然能检测到B-3残留,而土壤基质中丁氟螨酯的另一种代谢物邻三氟甲基苯甲酸(B-1)在100 d时仍然大量存在。以上结果说明,丁氟螨酯代谢物性质较稳定,在不同生态环境条件下残留差异不明显,因此在农产品中进行丁氟螨酯残留检测分析时,对其代谢物的残留分析也不容忽视。兰腾芳[37]研究发现,丁氟螨酯在不同的水-沉积物系统中的降解速率由大到小依次为北京上庄水库、东北湖泊、湖南水田,其降解速率受有机质含量的影响;在好氧条件下,B-1和B-3的生成速度快于在厌氧条件下;丁氟螨酯对映体在水体中的降解速度快于在土壤中。
6 残留检测
有关β-酮腈及其衍生物类杀螨剂的研究主要集中在合成及活性方面,而关于其残留检测的分析方法方面较少。目前主要检测方法包括液相色谱法、液质联用法、超高效液质联用法等,检测的基质以蔬菜、水果为主。Chen等[38]在2013年建立了一种简单的手性分析方法,通过正相液相色谱法测定黄瓜、番茄和苹果中的丁氟螨酯对映体,优化了流动相、手性色谱柱、柱温和净化方式。此方法线性范围良好,适用于实际样品的检测。李敏敏[36]建立了水果、土壤及水中丁氟螨酯的气相色谱串联质谱残留分析方法,样品经乙腈提取,以50 mg PSA和20 mg GCB作为净化剂。与此同时,该团队也建立了丁氟螨酯及其2种代谢物B-1和B-3的超高效液相色谱串联质谱残留分析方法,使用多壁碳纳米管净化样品。定量限在上述2种方法中分别为0.015和0.7μg/kg。赵来成[39]利用QuEChERS结合UPLC-MS/MS建立了在草莓中丁氟螨酯的检测分析方法,该方法的回收率在72%~92%,相对标准偏差在10%以内。崔淑华等[40]使用乙腈作为提取剂,以25 mg PSA和50 mg C18作为净化剂,利用超高效液相色谱串联质谱法建立了蔬菜和水果中腈吡螨酯残留量的检测方法,并成功应用于实际样品的检测。Tan等[41]建立了腈吡螨酯在柑桔果皮、果肉、全果上的检测方法,以乙腈为提取剂,比较了10 mg GCB+150 mg MgSO4、50 mg PSA+150 mg MgSO4、50 mg C18+50 mg PSA+150 mg MgSO4等不同净化剂组合的净化效果。此方法简便、高效,可在5 min之内完成对柑桔不同样品中腈吡螨酯残留量的检测。除以上报道的有关丁氟螨酯和腈吡螨酯的残留检测方法外,也有大量文献报道了蜜柚、棉花、土壤基质中乙唑螨腈原药和复配剂的检测方法[42-46]。
β-酮腈及其衍生物类杀螨剂在不同作物上的残留半衰期差别较大,如在黄瓜中的半衰期为6.90~9.62 d[47],在草莓中的半衰期为9.36 d[48],在柑橘中的半衰期为19.77 d[35],而在苹果中的半衰期为20 d以上[49]。不同环境或者处理方式均会对丁氟螨酯对映体的降解产生影响。Sun等[35]研究了丁氟螨酯在柑橘种植过程中的选择性降解行为。结果表明,(-)-CYF在柑橘中优先降解,半衰期为16.5 d,对映体分数(EF)为0.42[35]。同样从手性农药角度出发,Guo等[49]发现在苹果园中分别以5倍剂量和1.5倍剂量进行施药,最终结果显示(-)-CYF的降解与(+)-CYF的降解差异不显著,这可能与田间试验环境中缺少手性农药的降解条件有关。同时该研究还发现,丁氟螨酯在苹果中分布不均,主要集中在果皮,若使用丁氟螨酯时严格遵循规范,则食用含有丁氟螨酯残留的苹果将不会对人群造成健康风险。在此之后,Quan等[50]仔细研究了在苹果产品加工过程中丁氟螨酯对映体的立体选择性行为。结果表明,典型的几种加工处理过程(清洗、去皮、护色、热烫、膨化干燥、酶解、发酵)可能会对其降解速率产生不同程度的影响,所有加工环节的加工因子(PF)均小于1,说明加工过程能够降低农药残留,在番茄的加工过程中也有与之类似的结论[51]。该研究还发现,在发酵过程中(+)-CYF在一定程度上优先降解,这有助于苹果酒和苹果醋中(-)-CYF的相对富集,为后期改进食品加工后的饮食风险评估提供了数据参考。
不同环境或者处理方式同样会对乙唑螨腈和腈吡螨酯的降解产生影响。赖添财[43]进行了乙唑螨腈在蜜柚上的残留行为研究,发现套袋时,乙唑螨腈在蜜柚上的残留半衰期为3.56~4.80 d,未采用套袋时的半衰期为3.05~3.50 d。由此可见,在相同剂量下,未采用套袋处理的半衰期小于套袋的半衰期。Kabir等[52]研究了在使用推荐剂量下,腈吡螨酯在不同种植地的亚洲梨上的消解动态规律,结果证明韩国罗川和高敞的最终残留水平低于规定的最大残留限量(MRL),其半衰期分别为9.8和5.2 d。施药后0 d的风险评估显示,两地的估计每日摄入量(EDI)分别为可接受日摄入量(ADI)的27.25%和24.52%,说明这些水果的食用安全风险较低。Li等[53]田间试验结果表明,腈吡螨酯在草莓和柑橘中的半衰期分别为6.8和11.8 d,最终残留量均低于规定的MRL;腈吡螨酯在草莓酱和柑橘中的加工因子(PF)分别为1.51和1.31,说明其残留量有所增加,而在果肉中的PF值分别为0.58和0.17,说明在清洗草莓和对柑橘去皮后其残留量有所减少。
7 抗性
二斑叶螨的抗性试验研究表明,丁氟螨酯、腈吡螨酯和乙唑螨腈与现有药剂丙溴磷和联苯肼酯等之间存在较低或不存在交互抗性[54-55],但腈吡螨酯、丁氟螨酯与呼吸链复合物Ⅰ抑制剂(哒螨灵和唑螨酯)以及β-酮腈杀螨剂之间存在明显的交互抗性[56-59]。Chen等[58]研究发现,乙唑螨腈与腈吡螨酯在田间种群和实验室选择的菌株中均表现出显著的交互抗性。在田间种群抗性研究中发现,浙江萧山的二斑叶螨种群对腈吡螨酯的抗性最高,抗性倍数高达39.46,而在北京采集的所有种群都表现出相当低的抗性水平,没有显著差异。徐丹丹[60]进行了7种二斑叶螨田间种群雌成螨对包含丁氟螨酯、乙唑螨腈、腈吡螨酯在内的12种药剂的抗性研究。结果表明,所有田间种群对乙唑螨腈均表现为敏感度下降或敏感水平,对腈吡螨酯表现为中等抗性水平,抗性倍数为10.15~26.07;除了北京顺义和海南吉阳两地的二斑叶螨种群外,其余五地的二斑叶螨田间种群对丁氟螨酯表现为中或高抗性水平,抗性倍数为11.91~72.62。
害螨体内对该类杀螨剂产生抗性的关键是不同解毒酶系的参与程度,其中最主要的3种解毒酶分别是谷胱甘肽S-转移酶(GSTs)、多功能氧化酶(MFO,又称细胞色素P450单氧酶)和羧酸酯酶(CarEs)[61-62]。有研究发现,miR-1可通过靶向编码GSTs的TCGSTM4来调控朱砂叶螨对丁氟螨酯的抗性[63],也有文献指出CarEs可催化丁氟螨酯的分解,并促进丁氟螨酯和谷胱甘肽的结合[62-64],从而增加朱砂叶螨的抗性。由此可见,抑制害螨体内的解毒酶活性可以减少该类杀螨剂在害螨体内的代谢分解,从而避免引起抗性问题。腈吡螨酯与丁氟螨酯被证实在实验室条件下存在负交互抗性,推测因其在螨虫体内受到解毒酶和激活酶之间的相互作用的方式不同而产生差异[61]。为避免此类现象的产生,此类杀螨剂可以和现有杀螨剂配合使用。有研究表明,当30%腈吡螨酯悬浮剂与110 g/L乙螨唑悬浮剂、22.4%螺虫乙酯悬浮剂进行合理混用时,既可以防治苹果红蜘蛛又能节省农药使用量[27],但不建议β-酮腈及其衍生物类杀螨剂和碱性农药混用[65]。
8 结论与展望
本文综述了β-酮腈及其衍生物类杀螨剂的研发历程、化学结构、作用机理、生物活性、环境影响、残留检测及抗性。作为新型杀螨剂,β-酮腈及其衍生物对螨虫各个生长阶段均有优异的防效。不同于以往众多的杀螨剂品种,该类杀螨剂作用方式新颖,不易产生抗性,适用于螨虫的综合防治。
目前尚未发现此类杀螨剂对作物产生危害的报道。由于其具有高效、杀虫谱广,对非靶标生物安全,易降解,对环境友好等特点,因而市场前景广阔,现已有多种产品获得批准上市,可以作为抗药性强、高毒农药的良好替代品。然而,因使用同类杀螨剂会存在潜在的交互抗性[58,66],所以在实际使用中应基于当地的用药史,避免在同一区域使用同类药物。推荐混合使用多种类杀螨剂,如将此类杀螨剂和作用机制不同的现有杀螨剂混合进行交替使用,以达到延缓抗性,延长药效和保护环境的目的。此外,还可以和其他防治手段结合使用,这对于节约成本、减少抗性、保护环境具有重要意义。
此类杀螨剂的农药残留情况、毒性和环境行为应从多角度研究分析。例如,丁氟螨酯代谢物B-1和B-3对于某些非靶标生物的毒性大于其母体,因而此类杀螨剂在环境中的代谢物毒性和环境行为应受到重视,建议未来在进行农药残留检测时将代谢物同母体残留情况综合考虑。同时,关于β-酮腈衍生物类杀螨剂顺反异构体的生物活性、毒性和其他性质是否存在差异仍需要进一步研究。
