浅谈MAH制度下生物制药CMO企业委托生产管理
2022-04-11刘传敏陈海棠
刘传敏 陈海棠
摘要:作为我国医药改革的重点内容之一,上市许可持有人(MAH)制度的实施给药品企业带来了巨大的影响。新冠疫情的爆发也让生物制药行业备受关注,MAH将持证人与制造商解绑,研发型、生产型、服务外包型等不同企业均能一定程度上享受到政策红利,但在实施层面,地区间对于政策的解读以及跨区域合作等方面仍存在尚未解决的问题。如何MAH制度下合规的进行委托生产管理是委托生产双方共同关注的关键点。文章基于法规和委托双方需求,阐述了作为生物制药CMO企业进行委托生产管理的要求。
关键词:MAH;委托生产;风险管理;GMP;CMO
【中图分类号】 F325.2 【文献标识码】 A 【文章编号】2107-2306(2022)05--01
0引言
受全球新冠疫情的影响,生物制药行业备受关注,在MAH制度下越来越多的企业进入生物制药CMO行业,但在委托生产过程如何保证药品质量是推进MAH制度的关键问题,也是CMO企业极力想要解决的问题。根据调研显示“研发企业产品专利保护或关键物料掌控能力”、“现有CMO企业知识产权(商业秘密)保护力度”和“现有CMO企业生产质量体系)”是研发企业考虑是否选择委托生产的重要因素[3]。基于上述的法规和委托双方诉求,本文将提出作为生物制药CMO企业进行委托生产管理要求,为MAH制度推行和CMO企业委托生产管理提供参考。
1上市许可持有人制度(MAH)概述
上市许可持有人制度(简称“MAH”)是指将上市许可与生产许可分离的管理模式。在这种机制下,上市许可持有人可以将产品委托给不同的生产商,药品上市许可持有人依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性和质量可控性负责。2019年8月26日修订的《中华人民共和国药品管理法》规定,MAH于12月1日起正式在全国推广实施。在MAH制度下CMO企业作为提供药品生产外包服务活动的单位依法应承担相应责任。
2 MAH制度下委托生产法规要求
根据《中华人民共和国药品管理法》规定,药品上市许可持有人的法定代表人、主要负责人对药品质量全面负责。药品上市许可持有人应当对受托药品生产企业、药品经营企业的质量管理体系进行定期审核,监督其持续具备质量保证和控制能力。药品上市许可持有人委托药品生产企业生产的,应当委托符合条件的药品生产企业。药品上市许可持有人和受托生产企业应当签订委托协议和质量协议,并严格履行协议约定的义务[1]。2020年9月27日国家药监局发布了药品委托生产质量协议指南(2020年版)和药品委托生产质量协议模板(2020年版)用于指导、监督药品上市许可持有人和受托生产企业履行药品质量保证义务,自发布之日起施行。
3受托企业需具备的条件
具备保障药品安全性、有效性和质量可控性的质量管理、风险防控和责任赔偿等能力,履行相关义务承担相应责任,取得相应生产范围的药品生产许可证并在效期内,厂房设施设备、人员、体系等符合药品生产管理规范。在进行体系建立时在合规的基础下还需要考虑上市许可持有人对产品 “把控力”的灵活要求。除此外还应在内部考虑建立保密相关措施,加强知识产权(商业秘密)保护力度。
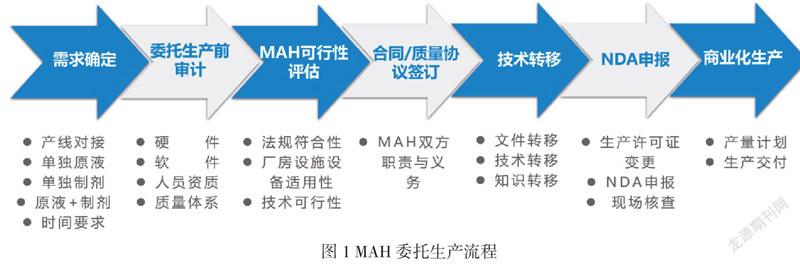
4委托生产流程
我国相关的药品监管法律与其他国家不同,医药产业基础也不同,不同的公司对于MAH制度下的委托生产也有不同的管理要求和流程,以下是以江苏某药企MAH委托生产管理为例制定的流程图。
需求确定后,药品上市许可持有人应对受托药品生产企业进行质量审计,对受托方的质量保证能力和风险管理能力进行评估,包括法规符合性评估、厂房设施设备及生产条件、检验条件及能力、仓储条件、公用系统、生产技术水平、质量保证体系情况、综合评价等。评价受托方是否有能力接受委托生产并保证药品的质量,并出具书面审计方案和报告,审计材料作为相关证明文件进行保存。
质量审计结束后委托双方可进行技术交流确定工艺技术方面的可执行性,最终药品上市许可持有人基于前期的沟通交流与审计情况综合对受托药企进行MAH委托生产可行性评估,确定后续人员、硬件、体系、软件等方面的需求,便于后续委托生产协议与质量协议的签订,规定药品委托生产范围确定双方责任和义务。
协议签订后双方可根据协议制定技术转移方案,明确沟通机制、技术转移具体内容、方法和可接受标准。技术转移方案批准后,按照方案要求进行技术转移相关工作。涉及到菌种转移的还需要关注菌种转移全程监控相关工作,确保菌种转移过程中转运符合要求数据真实可靠,并提供菌种库COA与无噬菌体污染的检测报告。
技术转移完成并评价技术转移合格后可进行NDA申报等工作,现场核查评审通过后可进行后续的商业化生产,在上所述工作执行过程中上市许可持有人应对受托企业进行监管。商业化生产前委托双方还应对后续沟通范围与机制、运输方式、生产计划下达方式进行讨论,受托方进行药品出厂放行,上市许可持有人进行上市放行。上市许可持有人应在商業化阶段生产中对受托药品生产企业的质量管理体系进行定期审核,监督其持续具备质量保证和控制能力。
5总结
我国药品生产企业普遍存在着“多、小、散、乱”的现象,当前我国药品安全事故呈现多发趋势,且大多数都是人为因素。如编造生产和检验记录、擅自更改生产工艺、蒙骗和贿赂检查人员等行为屡见不鲜,不仅破坏了正常市场秩序,也损害了社会公众的健康利益;CMO与CDMO行业虽然目前发展迅速,除去具备国际经验的著名CMO公司外,多数国内CMO公司的技术、人员和管理经验都有待发展。通过委托生产,研发企业可以将资金集中投入于研发领域,释放研发企业的创造力,同时减少生产领域的重复建设,进一步促进社会分工与资源的合理配置。
随着新冠疫情的影响,基于MAH制度优化国内制药资源配置、降低研发资金门槛等多种优势,众多研发企业跃跃欲试。MAH制度正式实施后,由研发型MAH主导的委托生产刚刚起步,委托方与受托方的权责利益划分目前仅凭双方经验确定。建议生物制药CMO企业在进行项目与质量体系搭建时,合规的基础上还应考虑药品上市许可持有人对产品“把控力”的灵活要求和知识产权保护需求,让想委托生产的研发企业真正放心地去委托生产,推动MAH制度落地,提升生产效率,节约生产成本,同时保证生产质量,实现委托生产双赢。
参考文献:
[1]中华人民和国药品管理法2019
[2]张雯雯.MAH与带量采购新经济形势下生物医药产业发展探索[J].法制与经济2020(03):94-98
[3]汤涵,王敏娇,王文,柳鹏程.药品研发企业开展MAH委托生产的影响因素研究[J].中国医药工业杂志2020,51(10):1329-1333
