PPP3CA?PLCB1和STK3 基因在小尾寒羊性腺轴组织中的表达量研究
2022-04-11周祖阳刘玉芳储明星
周祖阳 刘玉芳 储明星

摘要 為揭示候选基因 PPP3CA、PLCB1和STK3在 绵羊多羔中的作用,以不同产羔数小尾寒羊为研究对象,采用实时荧光定量PCR技术检测 PPP3CA、PLCB1、STK3基因在小尾寒羊大脑、小脑、下丘脑、垂体、卵巢、子宫和输卵管中的表达情况。结果表明:PPP3CA基 因在小尾寒羊卵巢内的相对表达量高于其他组织,其在 FecB BB型小尾寒羊下丘脑中的相对表达量显著高于++型( P< 0.05),其在 FecB BB型小尾寒羊输卵管中的相对表达量极显著高于++型( P< 0.01); PLCB1基因在FecB BB型小尾寒羊小脑中的相对表达量最高, FecB BB型小尾寒羊垂体和卵巢组织中的相对表达量显著高于++型( P< 0.05); STK3 基因在++型小尾寒羊大脑中的相对表达量高于其他组织,其在 FecB BB型小尾寒羊卵巢中的相对表达量极显著高于++型( P< 0.01)。该研究结果表明 PPP3CA、PLCB1、STK3基因可 作为潜在候选基因,参与小尾寒羊多羔性状的调控,且具有一定的正向调节作用。
关键词 绵羊;多羔;组织表达; PPP3CA;PLCB1;STK3
中图分类号 S 813 文献标识码 A
文章编号 0517-6611(2022)06-0074-04
doi:10.3969/j.issn.0517-6611.2022.06.016
开放科学(资源服务)标识码(OSID):
Study on the Expression Quantity of PPP3CA,PLCB1 and STK3 Genes in Gonadal Axis Tissues of Small Tail Han Sheep
ZHOU Zu-yang1,2,LIU Yu-fang1,2,CHU Ming-xing1 (1.Key Laboratory of Animal Genetics,Breeding and Reproduction of Ministry of Agriculture and Rural Affairs,Institute of Animal Sciences,Chinese Academy of Agricultural Sciences,Beijing 100193;2.College of Life Science and Food Engineering,Hebei University of Engineering,Handan,Hebei 056001)
Abstract In order to reveal the role of candidate genes PPP3CA,PLCB1,STK3 in multi-lamb sheep,Small Tail Han Sheep with different litter size were used as the research objects in this experiment.Real-time quantitative PCR was used to detect the expression of PPP3CA,PLCB1 and STK3 genes in brain,cerebellum,hypothalamus,pituitary gland,ovaries,uterus and oviduct of Small Tail Han Sheep.The results showed that the relative expression quantity of PPP3CA gene in the ovaries of Small Tail Han Sheep was higher than that in other tissues,,while its relative expression quantity in the hypothalamus of FecB BB type Small Tail Han Sheep was significantly higher than that in ++ type ( P< 0.05).The relative expression quantity in the oviduct in BB type was extremely significantly higher than that in ++ type ( P< 0.01).The relative expression quantity of PLCB1 gene in the cerebellum of FecB BB type Small Tail Han Sheep was the highest,its relative expression quantity in the pituitary and ovarian tissues of BB type Small Tail Han Sheep was significantly higher than that in ++ type Small Tail Han Sheep ( P< 0.05).The relative expression quantity of STK3 gene in the brain of ++ type Small Tail Han Sheep was higher than that in other tissues,and its relative expression quantity in the ovary of BB type Small Tail Han Sheep was extremely significantly higher than that in ++ type Small Tail Han Sheep ( P< 0.01).The research results showed that PPP3CA,PLCB1 and STK3 genes could be used as potential candidate genes and involved in the regulation of prolificacy traits in Small Tail Han Sheep,and they had positive regulatory effects.
Key words Sheep;Multi-lamb;Tissue expression; PPP3CA;PLCB1;STK3
基金项目 国家自然科学基金项目(31772580);国家肉羊产业技术体系专项(CARS-38);中国农业科学院科技创新工程项目(CAAS-ZDRW202106,ASTIP-IAS13);河北省自然科学基金青年项目(C2019402261)。
作者简介 周祖阳(1994—),男,湖北鄂州人,硕士研究生,研究方向:动物遗传育种研究。*通信作者,研究员,博士,从事肉羊遗传育种研究。
收稿日期 2021-05-24;修回日期 2021-06-03
绵羊肉质细嫩,蛋白质含量高,胆固醇含量低,富含人体必需的各种氨基酸、维生素、 矿物质元素等,深受消费者的喜爱[1]。绵羊繁殖力受多种因素的调控,包括遗传背景、饲养条件、 营养水平等,其中排卵数能直接影响母羊的产羔数[2],而排卵数和产羔数是衡量繁殖力的2个重要指标[3]。因此,研究影响绵羊排卵和产羔性状的相关候选基因有助于透析绵羊多羔性状的分子机理,为提高绵羊繁殖力提供一定的理论参考。
钙调磷酸酶是一种钙依赖的丝氨酸/苏氨酸磷酸酶,它广泛参与了调节机体的多种生理功能[4]。PPP3CA是钙调磷酸酶催化亚基A(calcineurin A,CNA)的一种亚型,在动物发育过程中至关重要[5]。目前针对 PPP3CA 基因的相关研究大多集中在肌肉组织和骨骼肌上,研究发现 PPP3CA 基因在调控骨骼肌纤维中起关键作用,其在不同肌肉组织中均有表达[6],且能抑制成纤维细胞生长因子23 (FGF23) 的表达,与胰岛素样生长因子1( IGF1) 共同参与骨骼肌生长发育的调节[7-8]。 PPP3CA 基因与繁殖相关的研究报道较少。Dias等[9]研究发现 PPP3CA 基因对性早熟有显著影响。另有研究發现, PPP3CA对雌 激素信号转导和卵母细胞减数分裂也具有重要作用[10]。此外,在精原干细胞减数分裂和精子发生过程中, PPP3CA具 有去磷酸化作用[11]。同时, PPP3CA也 参与了动物胎盘内皮细胞功能的调节[12]。下丘脑-垂体-性腺轴(HPGA)的激活主要依赖于神经细胞内促性腺激素释放激素(GnRH)的分泌[13]。KISS1/GPR54信号通路是目前已知的GnRH分泌最重要的通路。以往的研究大多集中于 KISS1、GPR54这两个基因多态性的变化,但有研究发现KISS1、GPR54的信号 需要通过下游关键基因磷脂酶CB1(PLCB1)介导才能传递至神经细胞内,进而发挥作用[14]。PLCB1是目前研究最广泛的磷脂酶C(PLC)亚型,在调节核肌醇酯信号转导中起着关键作用[15]。汪稳[16]研究发现, PLCB1基 因在23、36、50周龄番鸭卵巢组织中的表达量存在显著差异( P< 0.05),与产蛋期相比就巢期和青年期番鸭卵巢组织中 PLCB1 基因的表达量较低,即 PLCB1在产 蛋期卵巢中的表达量高于青年期和就巢期,提示该基因可能在番鸭产蛋过程中起到较强的调节作用。另有研究发现,猪颗粒细胞和卵母细胞中PLC抑制剂和激活剂对4种PLC亚基的基因和蛋白表达有所不同,激活剂处理促进了4种PLC亚基的基因表达,但只有PLCB1蛋白有变化,这表明PLC蛋白中不同亚基发挥的作用有所不同,并且 PLCB1 可能在猪卵泡发育过程中发挥主要作用[17]。丝氨酸/苏氨酸蛋白激酶3(STK3)是丝氨酸/苏氨酸蛋白激酶家族STE20的成员之一,SKT3在细胞质和细胞核中均有表达,其主要功能是促使核小体间DNA碎片化,可抑制细胞增殖,促进细胞凋亡[18]。Moon等[19]研究了STK3在发情周期小鼠子宫内膜中的调控和表达,结果发现STK3在发情周期子宫中的表达是动态变化的,STK3蛋白表达从发情间期开始逐渐增加,发情期达到最高,表明STK3/4-Hippo信号通路在子宫上皮中起着新的信号通路作用,STK3/4-Hippo信号通路是连接雌激素下游信号通路和Hippo信号通路的关键因子之一,从而调节发情周期中子宫上皮的动态平衡。此外,有研究者利用全基因组测序技术从大足黑山羊中筛选出与产羔数相关的候选基因 STK3, GO分析发现其富集在生殖过程相关的途径中,表明 STK3可 能是调控大足黑山羊产羔数的一个重要候选基因[10]。
小尾寒羊具有生长发育快、繁殖力高、性能遗传稳定、适应性强等优点,目前关于 PPP3CA、PLCB1、STK3 基因在小尾寒羊性腺轴相关组织的表达研究尚未见文献报道。笔者选择 FecB BB型(多羔纯合突变型)和 FecB ++型(单羔纯合野生型)卵泡期小尾寒羊作为研究对象,采用实时荧光定量PCR技术检 测PPP3CA、PLCB1、STK3基 因在小尾寒羊性腺轴各组织中的表达情况,以期为小尾寒羊多羔候选基因的研究提供一定参考。
1 材料与方法
1.1 试验动物和样品采集
选取2~3周岁健康状况良好、经产的6只小尾寒羊母羊用于试验,其中卵泡期 FecB BB型(突变型)和 FecB ++型(野生型)各3只。所有试验羊只由天津市畜牧兽医研究所试验羊场提供,于2017年10月饲养,所有试验羊只的饲粮水平和饲养环境均保持一致。2017年11月将试验羊只屠宰,屠宰后迅速采集其大脑、小脑、下丘脑、垂体、卵巢、子宫、输卵管等组织,然后装入1.8 mL无菌、无酶冻存管中(采集样品量不超过冻存管容积的2/3)[20],迅速放入液氮罐中冷冻保存,并带回实验室放入-80 ℃冰箱中冷冻备用。
1.2 RNA提取及质量检测
将采集的组织样品在液氮中研磨,并用Trizol试剂(Invitrogen,美国)进行裂解,然后根据动物组织总RNA提取试剂盒(天根,北京)说明书进行总RNA提取。总RNA提取完成后利用1%琼脂糖凝胶电泳鉴定RNA的质量,并使用NanoDrop 2000分光光度计检测提取RNA的质量和浓度。将无明显降解、OD260/OD280为1.8~2.2的RNA置于-80 ℃下保存备用。
1.3 cDNA合成
以1.0 μg总RNA作为模板,使用TaKaRa PrimeScriptTM RT Reagent Kit试剂盒进行反转录合成第一链cDNA。反转录
体系(20 μL)如下:5×PrimeScript Buffer 4.0 μL,PrimeScript RT Enzyme Mix Ⅰ 1.0 μL,Oligo dT Primer 1.0 μL,Random 6 mers 1.0 μL,RNA 1.0 μg,RNase-Free ddH2O将反应总体积补至20 μL。反应程序如下:37 ℃ 15 min;85 ℃ 5 s。反转录全程快速在冰上进行。将反转录所得cDNA进行5倍稀释,用持家基因 RPL-19进 行PCR产物检测,经检测合格后于-20 ℃下保存,作为后续实时荧光定量检测的模板[20]。
1.4 荧光定量PCR引物设计
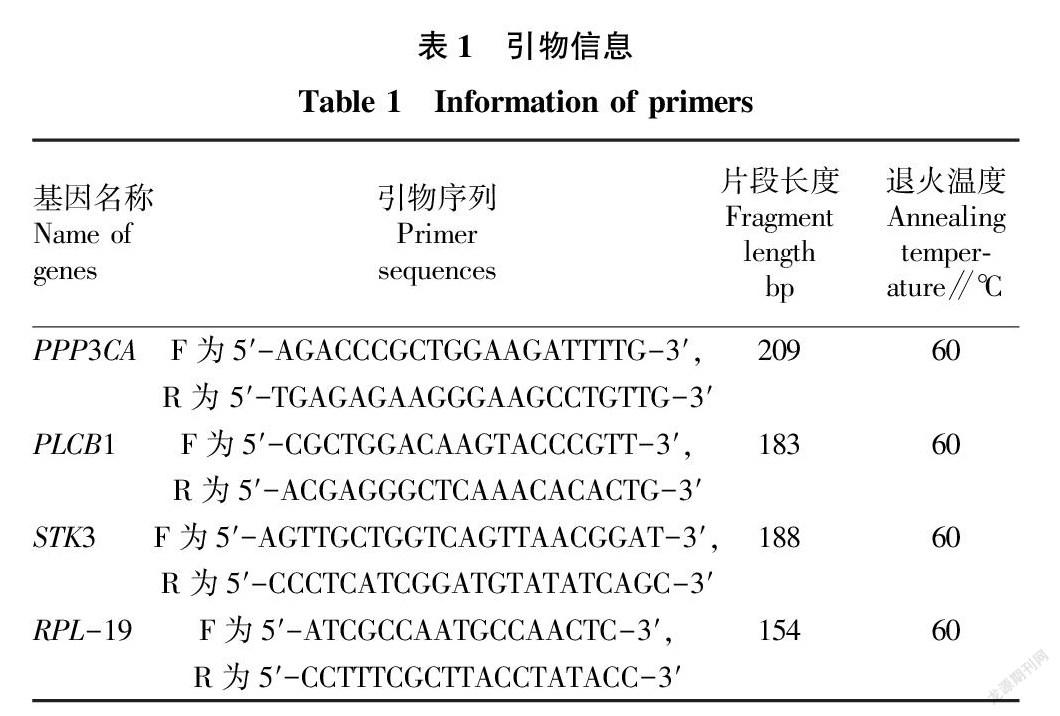
根据GenBank数据库提供的绵羊 PPP3CA、PLCB1、STK3和RPL-19基 因序列(登录号分别为XM_027970857.1、XM_012188093.3、XM_027973184.1和XM_004012836.3)信息,荧光定量引物使用Primer Premier 5.0软件设计,以 RPL- 19作为持家基因。引物合成由北京天一辉远生物科技有限公司完成。所有引物均加水稀释至浓度10 μmol/L。引物详细信息见表1。
1.5 实时荧光定量PCR
以 RPL- 19基因作为持家基因,使用Roche Light Cycler480 Ⅱ 型荧光定量PCR仪进行荧光定量PCR。反应体系(20 μL)如下:TB Green Premix Ex Taq Ⅱ 10 μL,PCR Primer(Forward Primer &Reverse Primer)0.8 μL,cDNA 模板2.0 μL,RNase-Free ddH2O 6.4 μL。荧光定量PCR反应程序如下:95 ℃ 预变性5 s;95 ℃变性10 s,60 ℃ 30 s,40个循环;反应结束后,对熔解曲线进行分析。
1.6 标准曲线的绘制
取适量cDNA样本,2倍等比稀释,制备5个浓度梯度[1、1/2、(1/2)2、(1/2)3、(1/2)4]的cDNA样本。将这些cDNA作为模板,对目的基因和内参基因进行荧光定量PCR。以 Ct 值为纵坐标,以浓度梯度的对数值(以10为底数)为横坐标,绘制目的基因和内参基因 RPL-19 的标准曲线[20]。
1.7 数据统计与分析
目的基因的相对表达量采用2-ΔΔ Ct 法计算。使用SPSS 19.0统计软件进行统计分析,采用 t 检验进行差异显著性分析。 P< 0.05表示差异显著, P< 0.01表示差异极显著。
2 结果与分析
2.1 总RNA的提取 利用1%瓊脂糖凝胶电泳进行总RNA的质量检测,电泳结果显示28S条带明显亮于18S条带,表明RNA完整性较好,提取的RNA质量合格,可用于后续反转录及荧光定量PCR试验。
2.2 PPP3CA、PLCB1和STK3 基因在不同基因型小尾寒羊各性腺轴组织中的表达量分析
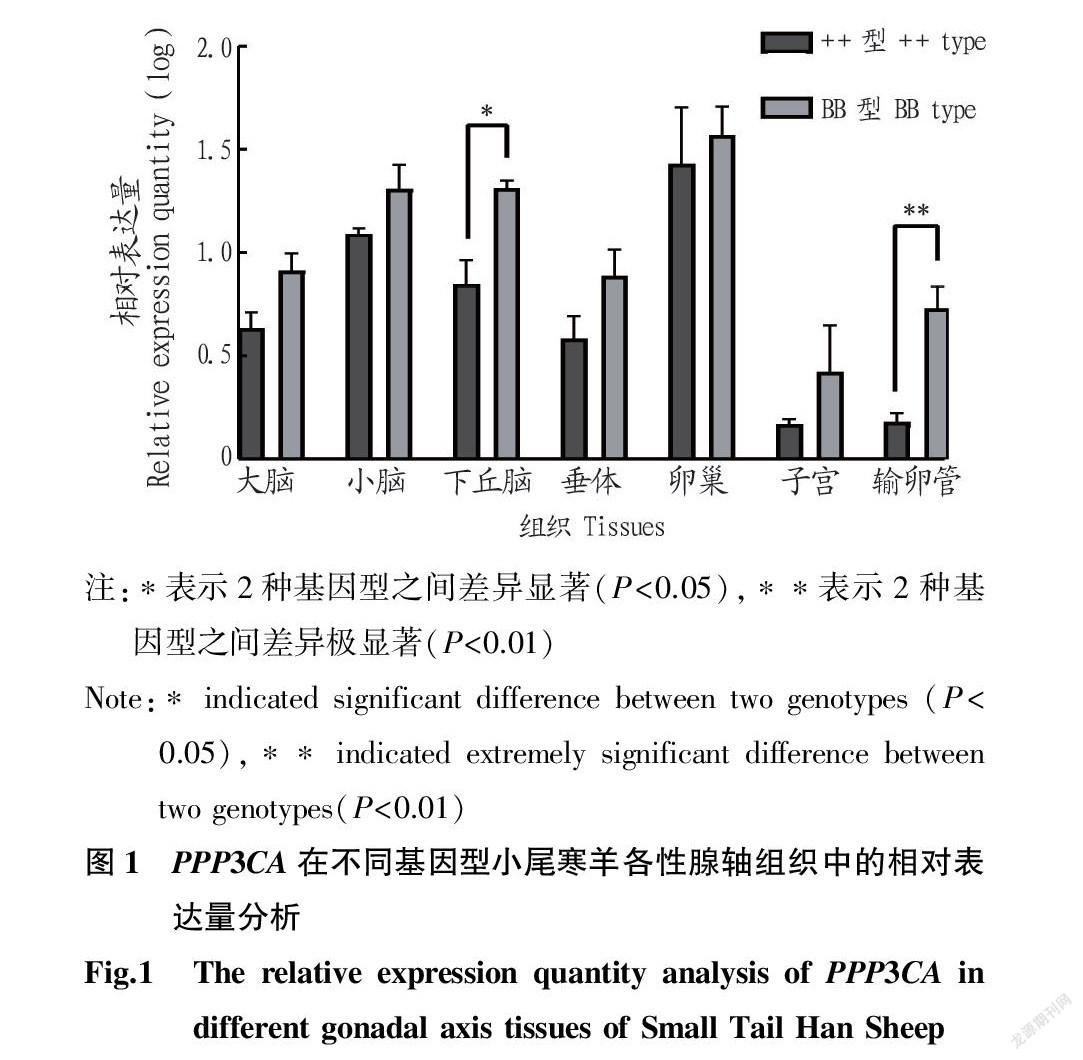
2.2.1 PPP3CA 在不同基因型小尾寒羊各性腺轴组织中的表达量分析。实时荧光定量PCR结果表明, PPP3CA 基因在BB型小尾寒羊卵巢中的相对表达量最高,在++型小尾寒羊子宫中的相对表达量最低。 PPP3CA 基因在 FecB BB型小尾寒羊下丘脑中的相对表达量显著高于++型( P< 0.05),在 FecB BB型小尾寒羊输卵管中的相对表达量极显著高于++型( P< 0.01)(图1)。
2.2.2 PLCB1 基因在不同基因型小尾寒羊各性腺轴组织中的表达量分析。实时荧光定量PCR结果显示, PLCB1基 因在 FecB BB型小尾寒羊小脑中的相对表达量最高,其在 FecB BB型小尾寒羊垂体和卵巢组织中的相对表达量显著高于++型( P< 0.05)(图2)。
2.2.3 STK3 基因在不同基因型小尾寒羊各性腺轴组织中的表达量分析。 STK3 基因在 FecB ++型小尾寒羊大脑中的相对表达量最高,其在++型和BB型小尾寒羊大脑、小脑、下丘脑、垂体、卵巢、子宫、输卵管中均有表达。 STK3 基因在 FecB BB型小尾寒羊卵巢中的相对表达量极显著高于++型( P< 0.01)(图3)。
3 讨论
下丘脑-垂体-性腺轴(HPGA)的调节是控制哺乳动物繁殖力的关键,是调控哺乳动物性激素分泌最重要的系统[21]。PPP3CA是蛋白磷酸酶3(protein phosphatase 3,PPP3)的催化亚基A。在蛋白磷酸酶3催化(PPP3C)的3种亚基中,PPP3CA和PPP3CB广泛存在于真核生物的多种细胞中[22],其中 PPP3CA基 因已被证实参与牛肌肉前脂肪细胞的分化[23]。 PPP3CA 在动物生殖生理中扮演着重要的角色,包括其在调节血管内皮生长因子 (VEGF) 和成纤维细胞生长因子2 (FGF2) 刺激胎盘动脉内皮细胞增殖和信号转导中的作用[24]。在精子发生过程中 PPP3CA通 过去磷酸化来调节精子的减数分裂,另外有研究发现 PPP3CA 的SNP变异与猪的产仔数有关[10]。该研究中 PPP3CA 基因在BB型小尾寒羊下丘脑中的相对表达量显著高于++型( P< 0.05),其在BB型小尾寒羊输卵管中的相对表达量极显著高于++型( P< 0.01),且该基因在 FecB BB型小尾寒羊卵巢中的相对表达量较++型小尾寒羊有所增加,提示该基因可能通过小尾寒羊性腺轴相关组织上的表达来正向调节小尾寒羊的繁殖性状。敖叶等[25]研究发现, PPP3CA 基因在单羔组黔北麻羊卵巢、输卵管、下丘脑中的相对表达量显著高于多羔组( P< 0.05),与该研究结果有一定差异,推测这种差异可能是由于物种不同所致。
PLCB1基 因在Wnt/Ca2+通路中起重要作用,PLC酶负责内膜组分磷脂酰肌醇-4,5-二磷酸(PIP 2)通过水解产生第二信使IP3和DAG,这2种酶都导致细胞内Ca2+的释放,而Ca2+稳态可能在卵母细胞和胚胎发育中发挥重要作用[26-27]。有研究者利用RNA-seq和全基因组甲基化测序方法对不同光周期条件下绵羊下丘脑表观遗传变化进行研究,筛选出参与光周期调控绵羊下丘脑功能的主要mRNAs(如 PLCB1、RASD1和KCNJ5 等),光周期改变时 PLCB1 参与了胰岛素分泌,该结果表明在昼夜节律通路中一些关键基因的表达变化会促进胰岛素的分泌,从而激活下丘脑功能区的受体,进一步调节绵羊因光周期诱导而进行的一系列生殖活动[28]。另有研究发现 PLCB1 在癌变过程中上调[29];Molinari等[30]指出 PLCB1在 乳腺癌中拷贝数的变化,其表达水平与组织学分级和增殖指数有关。汪稳[16]研究发现 PLCB1 基因可能在番鸭产蛋过程中起到较强的调节作用。陈华丽[17]研究表明 PLCB1基因可 能在猪卵泡发育过程中发挥主要作用。该研究中 PLCB1 基因在 FecB BB型小尾寒羊小脑中的相对表达量高于其他性腺轴组织,其在 FecB BB型小尾寒羊垂体和卵巢组织中的相对表达量显著高于++型( P< 0.05),推测该基因对小尾寒羊的高繁殖力性状具有一定的促进作用。
STK3是Hippo信号通路的一个关键分子,它控制细胞的发育、增殖、凋亡以及各种应激反应[31]。目前,关于STK3的研究主要集中在癌症方面。Wang等[32]研究发现,STK3抑制卵巢癌细胞增殖和转移,卵巢癌细胞过表达 STK3 后,细胞周期阻滞于G2/M期,细胞凋亡率增加。然而,关于 STK3 基因在动物繁殖方面的报道较少。研究表明,含WW结构域的人同源重组蛋白1(SAV1)在体外显著促进了STK4或STK3激酶诱导的大肿瘤抑制激酶1(LATS1)的磷酸化,LATS1的磷酸化和活性抑制卵巢卵泡的发育,从而阻止卵巢发育过程中的卵泡选择[33-34]。E等[10]基于全基因组测序结果筛选出大足黑山羊的多羔候选基因 STK3 ,与该研究结果相一致。实时荧光定量PCR结果显示,小尾寒羊性腺轴各组织中 STK3 基因均有一定表达,其在 FecB BB型小尾寒羊卵巢中的相对表达量极显著高于++型 ( P< 0.01),提示该基因可能是调控小尾寒羊多羔性状的一个重要候选基因。
4 结论
PPP3CA、PLCB1、STK3基 因在小尾寒羊性腺轴各组织中均有表达。
PPP3CA 基因在小尾寒羊下丘脑、输卵管中的相对表达量在单羔和多羔群体间存在显著差异, PLCB1 基因在单羔和多羔群体垂体组织中的相对表达量存在显著差异, PLCB1和STK3 基因在單羔和多羔群体卵巢组织中的相对表达量存在显著差异。该研究结果表明 PPP3CA、PLCB1、STK3 基因可作为调控小尾寒羊多羔性状的重要候选基因,为阐明绵羊高繁殖力的分子机理提供了一定参考。
参考文献
[1]刘旭莹,乔利英,刘建华,等.绵羊 TPT1 基因CDS区遗传结构及组织表达研究[J].中国畜牧杂志,2021,57(4):101-105.
[2] HASHEM N M,EL-AZRAK K M,NOUR EL-DIN A N M,et al.Effect of GnRH treatment on ovarian activity and reproductive performance of low-prolific Rahmani ewes[J].Theriogenology,2015,83(2):192-198.
[3] JUENGEL J L,FRENCH M C,QUIRKE L D,et al.Differential expression of CART in ewes with differing ovulation rates[J].Reproduction,2017,153(4):471-479.
[4] KLEE C B,CROUCH T H,KRINKS M H.Calcineurin:A calcium-and calmodulin-binding protein of the nervous system[J].PNAS,1979,76(12):6270-6273.
[5] 辜玉萍,陈蕾,李千音.沉默PPP3CA对后肾间充质细胞MET转化、凋亡、增殖及迁移的影响[J].生物工程学报,2020,36(10):2151-2161.
[6] WAN L,MA J S,XU G Y,et al.Molecular cloning,structural analysis and tissue expression of protein phosphatase 3 catalytic subunit alpha isoform (PPP3CA) gene in Tianfu goat muscle[J].Int J Mol Sci,2014,15(2):2346-2358.
[7] BR L,GROβMANN C,GEKLE M,et al.Calcineurin inhibitors regulate fibroblast growth factor 23 (FGF23) synthesis[J].Naunyn Schmiedebergs Arch Pharmacol,2017,390(11):1117-1123.
[8] 单艳菊,宋迟,束婧婷,等.钙调磷酸酶催化亚基A基因 (PPP3CA) 在不同品种鸭发育早期肌肉中的表达及其与肌纤维特性的相关性[J].农业生物技术学报,2015,23(2):236-243.
[9] DIAS M M,SOUZA F R P,TAKADA L,et al.Study of lipid metabolism-related genes as candidate genes of sexual precocity in Nellore cattle[J].Genet Mol Res,2015,14(1):234-243.
[10] E G X,ZHAO Y J,HUANG Y F.Selection signatures of litter size in Dazu black goats based on a whole genome sequencing mixed pools strategy[J].Mol Biol Rep,2019,46(5):5517-5523.
[11] REDGROVE K A,BERNSTEIN I R,PYE V J,et al.Dynamin 2 is essential for mammalian spermatogenesis[J].Sci Rep,2016,6(1):1-14.
[12] 王凱.神经钙调蛋白磷酸酶PPP3CA特异性siRNA对VEGF和 FGF2诱导的羊胎盘动脉血管内皮细胞殖的影响[D].大连:大连医科大学,2008:1-35.
[13] AGUIRRE R S,EUGSTER E A.Central precocious puberty:From genetics to treatment[J].Best Pract Res Clin Endocrinol Metab,2018,32(4):343-354.
[14] TREVISAN C M,MONTAGNA E,DE OLIVEIRA R,et al.Kisspeptin/GPR54 system:What do we know about its role in human reproduction?[J].Cell Physiol Biochem,2018,49(4):1259-1276.
[15] COCCO L,FOLLO M Y,FAENZA I,et al.Physiology and pathology of nuclear phospholipase C β1[J].Adv Enzyme Regul,2011,51(1):2-12.
[16] 汪稳.ERK信号通路相关基因在番鸭不同时期卵巢中的作用研究[D].福州:福建农林大学,2017:42-54.
[17] 陈华丽.Wnt/PLC/Ca2+通路对猪卵泡颗粒细胞和卵母细胞凋亡及颗粒细胞激素分泌的影响机制[D].杨凌:西北农林科技大学,2020:45-71.
[18] WANG Y,LI J,GAO Y,et al.Hippo kinases regulate cell junctions to inhibit tumor metastasis in response to oxidative stress[J/OL].Redox Biol,2019,26[2021-01-07].https://doi.org/10.1016/j.redox.2019.101233.
[19] MOON S,LEE O H,LEE S,et al.STK3/4 expression is regulated in uterine endometrial cells during the estrous cycle[J].Cells,2019,8(12):1-16.
[20] 寸静宇,刘秋月,王翔宇,等.小尾寒羊 FSHβ和LHβ基因在 生殖轴的表达研究[J].中国畜牧杂志,2019,55(1):37-41.
[21] 曹素梅,万雪萍,严美姣,等.miRNAs介导下丘脑-垂体-性腺轴调控动物生殖的研究进展[J].中国畜牧杂志,2017,53(1):1-6.
[22] 刘卫军,沈瑛,丁健.蛋白磷酸酶2A的结构、功能和活性调节[J].生物化学与生物物理学报,2003,35(2):105-112.
[23] TANIGUCHI M,GUAN L L,ZHANG B,et al.Gene expression patterns of bovine perimuscular preadipocytes during adipogenesis[J].Biochem Biophys Res Commun,2008,366(2):346-351.
[24] SONG Y,WANG K,CHEN D B,et al.Suppression of protein phosphatase 2 differentially modulates VEGF-and FGF2-induced signaling in ovine fetoplacental artery endothelial cells[J].Placenta,2009,30 (10):907-913.
[25] 敖叶,陈祥,周志楠,等. TGFβ2和PPP3CA 基因在黔北麻羊性腺轴组织表达及对卵巢颗粒细胞的调控研究[J].畜牧兽医学报,2020,51(11):2699-2709.
[26] LYON A M,TESMER J J G.Structural insights into phospholipase C-β function[J].Mol Pharmacol,2013,84(4):488-500.
[27] ZHANG D X,LI X P,SUN S C,et al.Involvement of ER-calreticulin-Ca2+ signaling in the regulation of porcine oocyte meiotic maturation and maternal gene expression[J].Mol Reprod Dev,2010,77(5):462-471.
[28] 賀小云.基于OVX+E2模型研究光周期对绵羊下丘脑表观遗传调控的影响[D].北京:中国农业科学院,2020:10-73.
[29] FAN Y,WANG L,HAN X C,et al.LncRNA MIF-AS1 aggravates the progression of ovarian cancer by sponging miRNA-31-5p[J].Eur Rev Med Pharmacol Sci,2020,24(5):2248-2255.
[30] MOLINARI C,MEDRI L,FOLLO M Y,et al.PI-PLCβ1 gene copy number alterations in breast cancer[J].Oncol Rep,2012,27(2):403-408.
[31] THOMPSON B J,SAHAI E.MST kinases in development and disease[J].J Cell Biol,2015,210(6):871-882.
[32]WANG X Y,WANG F M,ZHANG Z G,et al.STK3 suppresses ovarian cancer progression by activating NF-κB signaling to recruit CD8+ T-cells[J].J Immunol Res,2020,2020:1-17.
[33] LYU Z C,QIN N,TYASI T L,et al.The Hippo/MST pathway member SAV1 plays a suppressive role in development of the prehierarchical follicles in hen ovary[J].PLoS One,2016,11(8):1-18.
[34] XIANG C,LI J,HU L L,et al.Hippo signaling pathway reveals a spatio-temporal correlation with the size of primordial follicle pool in mice[J].Cell Physiol Biochem,2015,35(3):957-968.
