紫云英苷对氧化损伤小鼠肌肉组织中LncRNA-MEG3表达的影响
2022-04-07罗海静吴秋雪李铁邵淑丽张伟伟
罗海静,吴秋雪,李铁,2,邵淑丽,2,张伟伟,2
紫云英苷对氧化损伤小鼠肌肉组织中LncRNA-MEG3表达的影响
罗海静1,吴秋雪1,李铁1,2,邵淑丽1,2,张伟伟1,2
(齐齐哈尔大学 1. 生命科学与农林学院,2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
为探讨紫云英苷(,AG)对氧化损伤小鼠肌肉组织中抗氧化相关LncRNA-MEG3表达的影响,将48只8周龄c57BL/6J雄性小鼠随机分成4组:DMSO组、运动组、运动+50 mg/kg AG组、运动+100 mg/kg AG组.除DMSO组外,其余3组小鼠进行一次性力竭运动4 h,运动+50 mg/kg AG组和运动+100 mg/kg AG组在小鼠力竭运动后分别灌胃50,100 mg/kg的AG,灌胃1 h后处死动物,取肌肉组织,测定肌肉组织中谷丙转氨酶(ALT)活力、还原型谷胱甘肽(GSH)含量以及氧化相关基因LncRNAs的表达.结果表明,与DMSO组相比,运动组小鼠肌肉组织中ALT活力升高(<0.01),GSH含量减少(<0.01);灌胃不同浓度的AG后,与运动组相比灌胃不同浓度AG小鼠肌肉组织中ALT活力降低,GSH含量增多.运动损伤后小鼠肌肉组织中LncRNA-MEG3表达升高,高于DMSO组14.48倍(<0.01);灌胃不同浓度的AG后,抗氧化相关基因LncRNA-MEG3表达降低,其中100 mg/kg AG组LncRNA-MEG3表达降低了89%(<0.05).综上说明,紫云英苷对氧化损伤小鼠肌肉组织起到修复作用,并且对肌肉组织中抗氧化相关基因LncRNA-MEG3的表达产生了影响,研究结果为紫云英苷的开发应用提供了实验依据.
紫云英苷;LncRNA-MEG3;氧化损伤
紫云英苷(,AG)又名黄芪素,是存在于多种植物中的一种天然类黄酮化合物,具有抗炎、抗氧化、抗肿瘤的作用,并且能够增强机体免疫力,调节机体异常激素,从而降低氧化应激反应.有研究表明,紫云英苷能够抑制促炎细胞因子(TNF-,IL-1,IL-6,IL-8)的产生,显著减轻关节炎小鼠的炎症[1],在紫云英苷处理的动物中脂质氢过氧化物(氧化应激的标志物)水平降低[2],并且研究发现注射角叉菜胶的小鼠连续服用紫云英苷5 d后,丙二醛的形成降低,超氧化物歧化酶和过氧化氢酶活性增强,说明紫云英苷对氧化应激、急性炎症可能起到一定的保护作用[3].然而关于紫云英苷对小鼠运动损伤后产生的氧化应激反应的相关研究尚不清楚.
LncRNA作为长度大约200 nt的长链非编码RNA[4],在控制基因表达和影响多种生物学的过程中发挥重要作用.越来越多的研究表明,LncRNA不仅作为DNA和蛋白质之间的中介[5],而且在不同程度上参与体内氧化应激反应[6].有研究报道,LncRNA-MEG3可能在脂肪干细胞的自发凋亡和氧化应激诱导的凋亡中起重要作用[7].LncRNA-MEG3的上调可减轻氧化应激、炎症反应、细胞凋亡以及溃疡性结肠炎[8].LncRNA-MEG3过表达可以改善肝缺血再灌注(HIR)小鼠的肝功能,并显著降低血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)的表达[9].然而,关于紫云英苷能否对氧化损伤小鼠肌肉组织产生修复作用,并且抗氧化相关LncRNA-MEG3的表达情况是否有变化尚未见报道.因此,本实验以小鼠肌肉组织为实验材料,采用力竭运动方式制备氧化损伤模型,探究紫云英苷对氧化损伤小鼠肌肉组织中ALT活性、还原型谷胱甘肽(GSH)含量以及LncRNA-MEG3的表达情况.实验结果可为后续深入研究紫云英苷的抗氧化作用奠定理论依据.
1 材料与方法
1.1 实验材料
48只8周龄SPF级c57BL/6J雄性小鼠及基础饲粮(长春亿斯实验动物技术有限责任公司).
Spark10M多功能酶标仪(瑞士帝肯(Tecan)贸易公司);Z32HK高速台式冷冻离心机(德国赫默(HERMLE Labortechnik GmbH)公司);MastercyclerRealplex 4荧光定量PCR仪(德国艾本德(eppendorf)股份公司);电子天平(北京赛多利斯仪器系统有限公司);HT-86-340-LA(-80 ℃)超低温冰箱(北京天地精仪科技有限公司);NanoDropND-2000C微量紫外分光光度计(美国赛默飞世尔科技有限公司);衡新ACS系列电子秤(中山市衡新电子有限公司).
微量还原型谷胱甘肽(GSH)试剂盒,谷丙转氨酶(ALT)试剂盒(南京建成科技有限公司);荧光定量PCR(qRT-PCR)试剂(大连宝生物工程有限公司);Trizol试剂(南京诺唯赞生物科技股份有限公司);反转录试剂盒(上海东洋纺生物科技有限公司);纯度98%紫云英苷(上海源叶生物科技有限公司).
1.2 实验方法
将48只SPF级c57BL/6J(8周大)雄性小鼠基础饲粮喂养1周后开始进行实验,实验前小鼠正常饮水,室温环境生存,且都做了游泳测试.一次性力竭运动时将小鼠随机分成4组,即DMSO组、运动组、运动+50 mg/kg AG组、运动+100 mg/kg AG组,每组4只,重复3次.除DMSO组外,其余3组小鼠进行1次性力竭运动4 h,运动+50 mg/kg AG组和运动+100 mg/kg AG组在小鼠力竭运动后分别用针头灌胃50,100 mg/kg的AG,DMSO组给予等体积生理盐水配制的0.1% DMSO,运动组给予等体积的生理盐水.灌胃1 h后断颈处死动物,解剖后腿肌肉用生理盐水清洗后于-80 ℃保存,收集过程均在冰上进行.
1.3 氧化指标测定
按试剂盒说明对收集的肌肉组织进行处理,测定ALT活性和GSH含量.
1.4 荧光定量PCR检测LncRNAs表达
1.4.1设计引物并合成在NCBI上使用Pick Primers软件设计实时荧光定量PCR上下游引物,以小鼠的-actin基因作为内参,送上海生工生物有限公司进行合成,引物序列见表1.

表1 荧光定量PCR引物序列
1.4.2RNA提取,cDNA合成和荧光定量PCR取小鼠肌肉组织,使用液氮在DEPC水处理过的研钵中将组织研磨成粉末,用Trizol法提取组织中的总RNA,用反转录试剂盒ReverTra Ace qPCR RT Master Mix with gDNA Remover(TOYOBO,JAPAN)和LncRNAs下游引物将RNA反转录成cDNA,使用TB Green Premix Ex Taq(TaKaRa,Beijing,China)对组织中LncRNA进行荧光定量PCR,每组实验重复3次.反应体系10 μL:TB Green Premix Ex TaqⅡ5 μL,cDNA样品2 μL,上、下游引物各0.5 μL,DEPC-treated H2O 2 μL.反应条件为:95 ℃预变性30 s,95 ℃5 min,60 ℃ 30 s,40个循环,得到每组样品的Ct值,运用2-△△Ct法计算LncRNA的相对表达量.
1.5 数据分析
使用GraphPad Prism 5.0软件对数据进行分析并且作图,实验数据以均数±标准差(`±)表示.<0.05为差异显著,<0.01为差异极显著.
2 实验结果
2.1 紫云英苷对氧化损伤小鼠肌肉组织的修复作用
为了验证紫云英苷对氧化损伤小鼠肌肉组织的修复作用,检测小鼠肌肉组织中ALT活力和GSH含量,(见表2).由表2可见,与DMSO组相比,运动组小鼠肌肉组织中ALT活力升高,GSH含量降低;与运动组相比,灌胃不同浓度紫云英苷小鼠的肌肉组织中ALT活力降低,GSH含量增多,说明紫云英苷对氧化损伤小鼠肌肉组织起到了修复作用.

表2 AG对氧化损伤小鼠肌肉中ALT活性和GSH含量的影响
注:同列**为与DMSO组相比差异极显著(<0.01);##为与运动组相比差异极显著(<0.01).
2.2 氧化损伤后肌肉中各LncRNAs表达变化
为了研究小鼠氧化损伤后肌肉中各LncRNA表达情况,收集各组小鼠肌肉组织提RNA,反转录后荧光定量PCR检测各LncRNA表达情况(见图1).由图1可见,与DMSO组相比,运动组中LncRNA-GAS5表达降低;LncRNA-HOTAIR,LncRNA-MALAT1,LncRNA-MEG3,LncRNA-SNHG1表达升高,其中LncRNA-MEG3表达量高于DMSO组14.48倍(<0.01).
2.3 紫云英苷对氧化损伤小鼠肌肉组织中LncRNA-MEG3表达的影响
为了研究紫云英苷对氧化损伤小鼠可能的修复机制,在灌胃紫云英苷后检测了损伤后显著升高的LncRNA-MEG3的表达(见图2).由图2可见,与运动组相比,灌胃紫云英苷后小鼠肌肉组织中LncRNA-MEG3的表达显著降低,100 mg/kg AG组表达降低了89%,差异显著(<0.05).
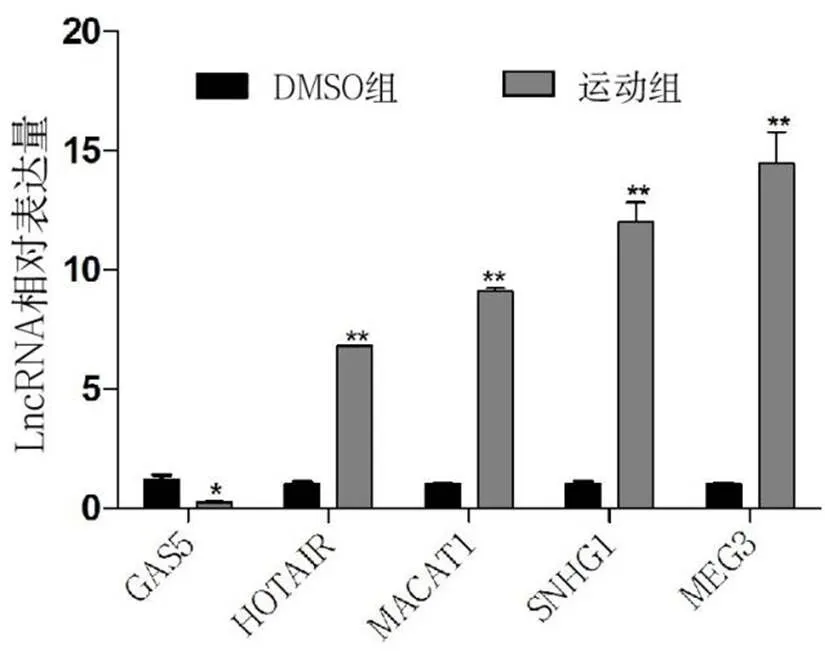
图1 荧光定量检测氧化损伤小鼠肌肉中各LncRNA表达情况
注:**为与DMSO组相比差异极显著(<0.01).

图2 紫云英苷对氧化损伤小鼠肌肉中LncRNA-MEG3表达影响
注:**为与DMSO组相比差异极显著(<0.01);*为与运动组相比差异显著(<0.05).
3 讨论
肌肉损伤是指由于肌腱单元过度劳损或强力打击肌肉(挫伤)而引起的常见创伤[10],使肌肉产生炎症和氧化应激反应.在体育锻炼过程中,肌肉系统的能量需求使氧气消耗量增加到其余系统所需氧气消耗量的10~20倍[11],这会导致活性氧在肌肉纤维中的积累量大量增加[12].当活性氧的量超出了机体自身抗氧化系统的能力,就会导致机体内氧化与抗氧化作用失衡.因此,长期高强度的急性运动会对身体产生氧化应激以及肌肉和其它器官损伤.本实验的氧化损伤模型就是让小鼠通过游泳运动4 h,使肌肉产生氧化应激反应,随后将运动+50 mg/kg AG组和运动+100 mg/kg AG组小鼠针头灌胃50,100 mg/kg的紫云英苷,其它组服用等体积的生理盐水,灌胃1 h后断颈处死动物,收集血液和肌肉组织,进行氧化指标ALT和GSH的测定,ALT存在于肝细胞的胞浆中,与肝脏整个过程有关,当肝脏受损时ALT活性升高[13].GSH是细胞内广泛存在的具有抗脂质过氧化作用的低分子肽,是生物抗氧化防御系统中的重要成员,能够有效清除外源性自由基[14].当肌肉产生氧化损伤时,细胞内的GSH含量降低,清除自由基能力降低,从而产生氧化应激.本实验结果发现,ALT活性升高,GSH含量减少,预测力竭运动使小鼠肌肉产生氧化应激反应,氧化损伤模型制备成功.但预测结果还仍然存在局限性.
紫云英苷作为药用植物中的主要生物活性,在抗炎、抗氧化、抗肿瘤、促凝血等方面发挥作用,并且对人体健康起着至关重要的作用.有研究报道,紫云英苷通过凋亡性细胞死亡对A498肾癌细胞产生抗增殖作用,从而抑制肾癌细胞系的生长[15].紫云英苷还可以增加全血粘度(WBV)、血浆粘度(PV)、红细胞沉降率(ESR)、细胞充盈量(PCV),以促进内在和外在的凝血系统来达到促凝血作用[16].紫云英苷对于氧化应激修复也具有一定的作用,如紫云英苷对离体大鼠心脏的心肌缺血/再灌注(I/R)损伤的心脏通过其抗氧化、抗凋亡和抗炎活性表现出心脏保护作用[17].本实验前期对紫云英苷是否对小鼠自身产生损伤进行了验证,分别用0,50,100 mg/kg的紫云英苷灌胃小鼠,发现血清ALT活力均低于对照组,证明紫云英苷对小鼠未产生损伤.随后向力竭运动小鼠中灌胃不同浓度的紫云英苷,小鼠肌肉组织中ALT活力降低,GSH含量升高,说明紫云英苷对氧化损伤小鼠肌肉组织有修复作用.
还有研究发现,LncRNA在氧化应激反应中起到一定的作用,LncRNA-HOTAIR的过度表达阻止了心肌缺血/再灌注(I/R)诱导的氧化应激、心肌细胞凋亡和心脏功能障碍[18].LncRNA-GAS5的上调可以介导氧化应激反应从而减轻高半胱氨酸诱导的心脏微血管内皮细胞的损伤[19].LncRNA-MALAT1的低表达可以降低高血压大鼠的血管损伤[20].在阿尔兹海默氏病大鼠组织中检测到LncRNA-MEG3表达降低,产生氧化应激损伤和炎性损伤[21].然而,关于LncRNA在氧化损伤小鼠肌肉中表达情况尚不清楚,因此本实验挑选5种与氧化应激有关的LncRNA,即LncRNA-GAS5,LncRNA-HOTAIR,LncRNA-MALAT1,LncRNA-MEG3,LncRNA-SNHG1.实验结果发现,LncRNA-GAS5表达降低,LncRNA-HOTAIR,LncRNA-MALAT1,LncRNA-MEG3,LncRNA-SNHG1表达升高,其中LncRNA-MEG3在氧化损伤小鼠肌肉中的表达最高,是DMSO组的14.48倍.因此本实验着重探究LncRNA-MEG3的表达情况.灌胃紫云英苷后,LncRNA-MEG3的表达量随着紫云英苷浓度的增加而降低,从而证明紫云英苷对氧化损伤小鼠肌肉具有修复作用,研究结果可为后续实验奠定理论基础.
[1] Jia Q,Wang T,Wang X,et al.Suppresses Inflammatory Responses and BoneDestruction in Mice With Collagen-Induced Arthritis and in Human Fibroblast-LikeSynoviocytes[J].Front Pharmacol,2019,10:94.
[2] Zheng D,Liu D,Liu N,et al.reduces lipopolysaccharide-induced acute lung injury in rats via induction of heme oxygenase-1[J].Arch Pharm Res,2019,42:704-711.
[3] Alblihed M.attenuates oxidative stress and acute inflammatory responses in carrageenan-induced paw edema in mice[J].Mol Biol Rep,2020,47(9):6611-6620.
[4] Kopp F,Mendell JT.Functional Classification and Experimental Dissection of Long Noncoding RNAs[J].Cell,2018,172(3):393-407.
[5] Shi X,Sun M,Liu H,et al.Long non-coding RNAs:a new frontier in the study of human diseases[J].CancerLett,2013,339(2):159-166.
[6] 李哲,刘子倩,王胤,等.氧化应激状态下心肌细胞中长链非编码RNA的差异表达谱分析[J].青岛大学学报(自然科学版),2021,34(4):9-15.
[7] Shi Y.MEG3 regulates apoptosis of adipose-derived stem cells[J].Mol Med Rep,2020,21(6):2435-2442.
[8] Wang Y,Wang N,Cui L,et al.Long Non-coding RNA MEG3 Alleviated Ulcerative Colitis Through Upregulating miR-98-5p-Sponged IL-10[J].Inflammation,2021,44(3):1049-1059.
[9] Wang X,Wang J.High-content hydrogen water-induced downregulation of miR-136 alleviates non-alcoholic fatty liver disease by regulating Nrf2 via targeting MEG3[J].Biol Chem,2018,399(4):397-406.
[10] Bayer M L,Mackey A,Magnusson S P,et al.Treatment of acute muscle injuries[J].UgeskrLaeger,2019,181(8):V11180753.
[11] Powers S K,Jackson M J.Exercise-induced oxidative stress:Cellular mechanisms and impact on muscle force production[J].hysiological reviews,2008,88(4):1243-1276.
[12] Yavari A,Javadi M,Mirmiran P,et al.Exercise-induced oxidative stress and dietary antioxidants[J].Asian journal of sports medicine,2015,6(1):e24898.
[13] 陈发菊,彭梅,王丽.藤茶总黄酮对酒精性肝损伤小鼠的保护作用[J].中成药,2021,43(1):200-203.
[14] 孙要军,孙博健,张艳霞,等.还原型谷胱甘肽对大鼠心肌缺血-再灌注后脑组织损伤的保护作用[J].中国药物与临床, 2020,20(23):3905-3907.
[15] Zhu L,Chen J,Cui T,et al.induced selective kidney cancer cell death and these effects are mediated via mitochondrial mediated cell apoptosis,cell cycle arrest,and modulation of key tumor-suppressive miRNAs[J].J Buon,2019,24(3):1245-1251.
[16] Liu L,Wang D,Qin Y,et al.Promotes Osteoblastic Differentiation in MC3T3-E1 Cells and Bone Formation in vivo[J].Front Endocrinol,2019,10:228.
[17] Qu D,Han J,Ren H,et al.Cardioprotective Effects ofagainst Myocardial Ischemia/ReperfusionInjury in Isolated Rat Heart[J].Oxid Med Cell Longev,2016,8194690.
[18] Meng K,Jiao J,Zhu R R,et al.The Long Noncoding RNA Hotair Regulates Oxidative Stress and Cardiac Myocyte Apoptosis during Ischemia-Reperfusion Injury[J].Oxid Med CellLongev,2020,1645249.
[19] Diao L,Bai L,Jiang X,et al.Long-chain noncoding RNA GAS5 mediates oxidative stress in cardiac microvascular endothelial cells injury[J].J Cell Physiol,2019,234(10):17649-17662.
[20] Xue Y,Li Z,Liu W,et al.Down-regulation of LncRNA MALAT1 alleviates vascular lesion and vascular remodeling of rats with hypertension[J].Aging,2019,11(14):5192-5205.
[21] Yi J,Chen B,Yao X,et al.Upregulation of the LncRNA MEG3 improves cognitive impairment,alleviates neuronal damage,and inhibits activation of astrocytes in hippocampus tissues in Alzheimer's disease through inactivating the PI3K/Akt signaling pathway[J].J Cell Biochem,2019,120:18053-10865.
Effect ofon the expression of LncRNA-MEG3 in muscle tissues of mice with oxidative damage
LUO Haijing1,WU Qiuxue1,LI Tie1,2,SHAO Shuli1,2,ZHANG Weiwei1,2
(1. School of Life Sciences,Agriculture and Forestry,2. Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering and Protection of Biodiversity in Cold Areas,Qiqihar University,Qiqihar 161006,China)
In order to explore the effect of(AG)on the expression of antioxidant-related LncRNA-MEG3 in the muscle tissue of oxidatively damaged mice,48 8-week-old c57BL/6J male mice were randomly divided into 4 groups:DMSO group,exercise group,exercise +50 mg/kg AG group,exercise +100 mg/kg AG group.Except for the DMSO group,the other 3 groups of mice were given a one-time exhaustive exercise for 4 hours.After exhaustive exercise,mice in the exercise+50 mg/kg AG group and exercise+100 mg/kg AG group were given 50 and 100 mg/kg AG respectively.The animals were killed by intragastric administration for 1 hour.Muscle tissues were taken to determine the alanine aminotransferase(ALT)activity,reduced glutathione(GSH)content and the expression of oxidation-related genes LncRNAs in the muscle tissues.The results showed that compared with the DMSO group,the ALT activity in the muscle tissue of the exercise group was increased(<0.01),and the GSH content was reduced(<0.01).After gavage of different concentrations of AG,compared with the exercise group,the ALT activity in the muscle tissue of AG mice with different concentrations decreased,and the GSH content increased.The expression of LncRNA-MEG3 in the muscle tissue of mice increased after sports injury,which was 14.48 times higher than that in the DMSO group(<0.01).After gavage with different AG,the expression of the antioxidant-related gene LncRNA-MEG3 decreased,and the LncRNA-MEG3 expression in the 100mg/kg AG group was reduced by 89%(<0.05).In summary,it shows thatcan repair the muscle tissue of oxidatively damaged mice and affect the expression of the antioxidant-related gene LncRNA-MEG3 in the muscle tissue.The results of the study provide an experimental basis for the development and application of.
;LncRNA-MEG3;oxidative damage
1007-9831(2022)03-0072-05
Q955
A
10.3969/j.issn.1007-9831.2022.03.015
2021-12-09
国家青年科学基金项目(31801148);黑龙江省自然科学基金项目(LH2021C099);黑龙江省教育厅基本业务专项(135209260);黑龙江省省属高等学校基本科研业务费科研项目(YSTSXK201874)——植物性食品加工技术特色学科专项;2020年齐齐哈尔大学研究生创新科研项目(YJSCX2020045)
罗海静(1997-),女,天津武清人,在读硕士研究生,从事肌细胞增殖与分化研究.E-mail:837701979@qq.com
张伟伟(1981-),女,山东临沂人,教授,博士,从事肌细胞增殖与分化研究.E-mail:zww121@163.com
