沙棘多糖对胰岛素抵抗HepG2细胞氧化应激的保护作用与机制
2022-04-07王秋丹赵凯迪林长青
王秋丹 赵凯迪 林长青
(延边大学医学院中医系,吉林 延吉 133000)
沙棘(HippophaerhamnoidesL.)是一种胡颓子科、沙棘属落叶性灌木,在世界各地均有种植。研究[1]显示,沙棘多糖具有一定的缓解体力疲劳、增强小鼠运动能力和抗氧化的作用。
植物多糖是植物细胞代谢产生的聚合度超过10个的聚糖。如今,植物多糖因其具有无毒、可生物降解、低成本、易获得的特性,已被广泛应用于食品、医药、农业和化妆品行业[2-3]。但目前对于沙棘多糖的报道多是集中在沙棘多糖的提取工艺以及纯化研究[4-5],在功能性方面报道过沙棘多糖抗疲劳、抗氧化、抗炎等[6-8]。
2型糖尿病(T2DM),一种内分泌代谢疾病,占糖尿病病例的大多数,已成为世界性的问题[9-10]。据报道[11],2019年糖尿病病例数量达到4.63亿例,预计2030年将增至约5.78亿例,2045年将增至7.00亿例。T2DM主要是由于体内产生胰岛素抵抗,使机体代谢失调从而引发糖尿病的发生,因此对于T2DM的治疗可从胰岛素抵抗方面着手。目前市售治疗糖尿病的药物多为西药,如二甲双胍,此类药物依赖性强,且长期使用会有一定的副作用[12]。
沙棘富含多种营养活性成分,但目前对沙棘多糖改善胰岛素抵抗方面的报道较少,且仅停留于动物层面的研究[13]。试验拟研究沙棘多糖对胰岛素抵抗细胞模型的改善作用及可能机制,旨在为开发沙棘成为新型治疗糖尿病产品提供理论参考。
1 材料与方法
1.1 材料与仪器
沙棘:延吉市海兰江药店;
盐酸吡格列酮:江苏万邦生化医药股份有限公司;
人肝细胞癌细胞系HepG2:上海ATCC细胞库;
2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐(CCK-8):上海碧云天生物技术有限公司;
重组人胰岛素、DMEM高糖培养基、双抗、胰酶、糖原试剂盒:北京索莱宝科技有限公司;
胎牛血清:美国Gibco公司;
葡萄糖试剂盒、一氧化氮合成酶(NOS)测定试剂盒:南京建成生物工程研究所;
离心机:TDZ5-WS型,湖南湘仪实验室仪器开发有限公司;
电热恒温水浴锅:HWS-24型,上海一恒科学仪器有限公司;
荧光倒置显微镜:Olympus IX73型,奥林巴斯(中国)有限公司;
细胞培养箱:MCO-5AC型,日本SANYO有限公司;
酶标仪:BK-EL10C型,山东博科生物产业有限公司;
电泳仪:Western Blot型,BIO-RAD Laboratories Inc.;
凝胶成像系统:BioSpectrum510型,美国UVP公司。
1.2 试验方法
1.2.1 沙棘多糖的提取 参考祝敏等[14]的方法并稍作改动,将沙棘烘干粉碎,过40目筛,超声波功率300 W,料液比(m沙棘粉∶V水)为1∶30 (g/mL),提取时间1 h,提取温度80 ℃浸提两次,合并两次提取液,用80%乙醇醇沉24 h,Sevage法除蛋白,1%活性炭脱色,冷冻干燥24 h,冻干成粉,4 ℃保存备用。
1.2.2 沙棘多糖含量的测定 采用苯酚硫酸法[15]。
1.2.3 细胞培养 取液氮中冻存的细胞,快速解冻后加入预先已添加10 mL含10%胎牛血清的DMEM培养基的15 mL离心管中,1 500 r/min离心5 min,弃上清,用1 mL 完全培养基重悬细胞,将细胞接于培养皿中,加入含10%胎牛血清的DMEM培养基,于37 ℃、0.5% CO2培养箱中进行培养。当细胞贴壁生长至80%~90%且生长状态良好时,使用0.25%的胰酶消化传代,并计数。
1.2.4 沙棘多糖对HepG2细胞活力的影响 采用CCK-8法。取对数期HepG2细胞,将其稀释成5×104个/mL单细胞悬液,并接种于96孔板中,每孔200 μL。分别配制质量浓度为50,100,200,400,800,1 600 μg/mL的沙棘多糖,对HepG2细胞进行干预24 h,每孔加入10 μL CCK-8,在培养箱中继续培养2 h,用酶标仪测定450 nm处的吸光值,计算各组细胞活力以筛选出沙棘多糖安全剂量。
1.2.5 胰岛素抵抗细胞模型的建立与分组 取生长状态良好,细胞贴壁生长达90%的HepG2细胞,稀释成5×104个/mL单细胞悬液,每孔100 μL接种至96孔板中。细胞共分为5组,分别为正常组、模型组、沙棘多糖低剂量组(200 μg/mL)、沙棘多糖高剂量组(400 μg/mL)、阳性组(盐酸吡格列酮200 μg/mL)。除正常组外,其余各组用含5×10-8mol/L胰岛素的培养基诱导48 h[16]。
1.2.6 葡萄糖消耗量测定 取培养基上清,用葡萄糖试剂盒检测培养基上清中葡萄糖含量,具体操作按说明书进行,并按式(1)计算葡萄糖消耗量。
ΔG=G0-Gx,
(1)
式中:
ΔG——各组细胞的葡萄糖消耗量,mmol/L;
G0——未接种细胞的空白组中葡萄糖含量,mmol/L;
Gx——测得各组培养液中葡萄糖含量,mmol/L。
1.2.7 糖原相对含量测定 收集5×106~10×106个细胞到离心管内,离心后弃上清,加入0.75 mL提取液超声波破碎细胞并转移至10 mL 试管中,置于沸水浴中煮沸20 min,冷却后,用蒸馏水定容到5 mL,混匀,8 000×g、25 ℃离心10 min,取上清液待测,按糖原试剂盒说明书进行后续操作。
1.2.8 SOD、MDA测定 收集细胞上清液用于SOD检测,分别消化收集细胞用于MDA检测。按SOD、MDA、ROS、SOD试剂盒说明书操作,测定各指标,并计算结果。
1.2.9 相关蛋白测定 Western Blot法。用RIPA强裂解液进行细胞蛋白的提取,12 000×g离心10 min,取上清并用BCA蛋白浓度测定试剂盒测定蛋白浓度,5×蛋白上样缓冲液进行煮沸,-20 ℃保存备用。根据目标蛋白分子量大小选择合适的分离胶浓度,电压100 V,电泳时间120 min,电泳结束后以100 V,60 min进行转膜,之后于5%的脱脂奶粉中封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育1 h,ECL显影并拍照。
1.2.10 统计学分析 使用SPSS 23.0对整理后的试验数据进行统计学分析,计算各组均值与标准偏差,进行显著性差异分析。所得的数据以图表和均值±标准偏差的形式表示。P<0.05表示有显著性差异,P>0.05表示无显著性差异即无统计学意义。
2 结果与分析
2.1 沙棘多糖含量
多糖得率为9.15%,图1为葡萄糖标准液吸光度及标准曲线,标准曲线为y=10.075x+0.009 4(R2=0.996 4)。由此算出沙棘多糖含量为88.46%。

图1 多糖标准曲线Figure 1 Standard curve of polysaccharides
2.2 沙棘多糖对HepG2细胞活力的影响
根据细胞活力筛选出后续使用的安全剂量。图2为不同质量浓度沙棘多糖对HepG2细胞干预24 h后的细胞活力情况。由图2可知,在沙棘多糖质量浓度为50~400 μg/mL时,细胞活力均在80%以上,在沙棘多糖质量浓度达到800 μg/mL时,细胞活力出现显著下降(P<0.05),因此后续试验选择的最大安全质量浓度为400 μg/mL。可见,当浓度超过一定范围后,沙棘多糖对细胞活力会出现显著性影响。
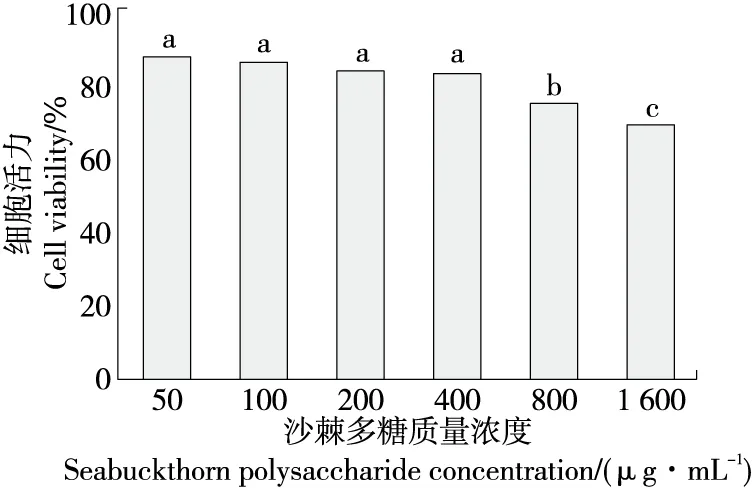
字母不同代表差异显著(P<0.05)图2 沙棘多糖质量浓度对HepG2细胞活力的影响Figure 2 The effect of different concentrations of seabuckthorn polysaccharides on the viability of HepG2 cells
2.3 沙棘多糖对葡萄糖消耗量的影响
在正常机体内,细胞利用胰岛素将葡萄糖吸收并分解,以便为机体提供能量,当发生胰岛素抵抗时,由于细胞对胰岛素的敏感度降低,不能有效识别胰岛素传递的信号,导致细胞对血液内的葡萄糖摄取率下降,因此葡萄糖的消耗减少,而血液内的葡萄糖则增多[17]。加入能够改善胰岛素抵抗的药物后,细胞对葡萄糖的消耗量有所增多。由图3可知,与正常组相比,模型组葡萄糖消耗量显著降低(P<0.05),经沙棘多糖高剂量组处理后能够显著提高其葡萄糖消耗量(P<0.05),且与阳性组间无显著性差异(P>0.05)。可能是由于沙棘多糖调节了细胞识别胰岛素的敏感程度,从而提高了细胞对葡萄糖的吸收。因此推测,沙棘多糖能够调节胰岛素抵抗细胞对葡萄糖的摄取。Chen等[18]的研究也表明,仙人掌多糖能够提高胰岛素抵抗HepG2细胞对葡萄糖的吸收。

字母不同代表差异显著(P<0.05)图3 沙棘多糖对葡萄糖消耗量的影响Figure 3 The effect of seabuckthorn polysaccharides on glucose consumption
2.4 沙棘多糖对糖原含量的影响
糖原是机体储存糖的主要形式,糖原合成会使血糖升高,糖原分解会使血糖降低,因此其对维持血糖的相对稳定极为重要,同时能够指示胰岛素抵抗状况[19]。如图4 所示,模型组糖原的相对含量显著降低(P<0.05),经沙棘多糖处理后能够显著提高糖原相对含量(P<0.05)。这主要是由于沙棘多糖提高了细胞对葡萄糖的摄取,葡萄糖在各种酶的作用下合成糖原,最终导致糖原含量升高。由此可见,沙棘多糖能够改善胰岛素抵抗的HepG2细胞中糖代谢紊乱,减轻高糖高脂引起的糖原含量下降。Zhu等[20]研究了苦瓜中水溶性多糖和碱溶性多糖对胰岛素抵抗细胞模型的作用,发现其也能够提高糖原含量。

字母不同代表差异显著(P<0.05)图4 沙棘多糖对糖原含量的影响Figure 4 The influence of seabuckthorn polysaccharides on glycogen content
2.5 沙棘多糖对SOD、MDA水平的影响
表1为沙棘多糖对HepG2细胞中SOD、MDA水平的影响,与正常组相比,模型组细胞中SOD水平显著下降(P<0.05),MDA水平显著升高(P<0.05)。与模型组比较,经沙棘多糖处理后的HepG2细胞SOD水平得到显著提高(P<0.05),MDA水平显著下降(P>0.05)。可能是由于沙棘多糖具有抗氧化活性,因此对细胞内的氧化应激相关酶起到了调控作用。说明沙棘多糖能够有效改善胰岛素抵抗细胞模型的氧化应激水平。Wei等[21]对沙棘浆果中的多糖进行了研究,发现其具有抗氧化活性,并能够提高小鼠SOD活力,降低MDA活力。

表1 沙棘多糖对HepG2细胞中SOD、MDA水平的影响†
2.6 沙棘多糖对氧化应激蛋白表达的影响
环氧氯丙烷相关蛋白(Keap1)与核因子E2(Nrf2)在细胞质中结合,激活血红素加氧酶1(HO-1)的启动子,HO-1蛋白表达会在受到氧化应激和细胞损伤后上调[22]。由图5可知,模型组中Nrf2和HO-1二者表达量显著降低(P<0.05),Keap1表达量显著升高(P<0.05),经沙棘多糖处理后能够显著提高Nrf2和HO-1的表达水平(P<0.05),显著降低Keap1的表达水平(P<0.05)。可见,沙棘多糖能够调控胰岛素抵抗细胞模型的氧化应激相关蛋白。其可能机制如图6所示,沙棘多糖通过膜蛋白将其转运进细胞内,Nrf2与Keap1在细胞质中处于结合状态,在受到沙棘多糖刺激后,两者分开,Keap1留在细胞质中,而Nrf2到细胞核中与反应元件ARE结合,促进下游蛋白HO-1表达升高,进而导致氧化应激及相关酶的变化。因此推测沙棘多糖是通过调控Nrf2/HO-1/Keap1信号通路从而起到保护胰岛素抵抗HepG2细胞氧化应激的作用。
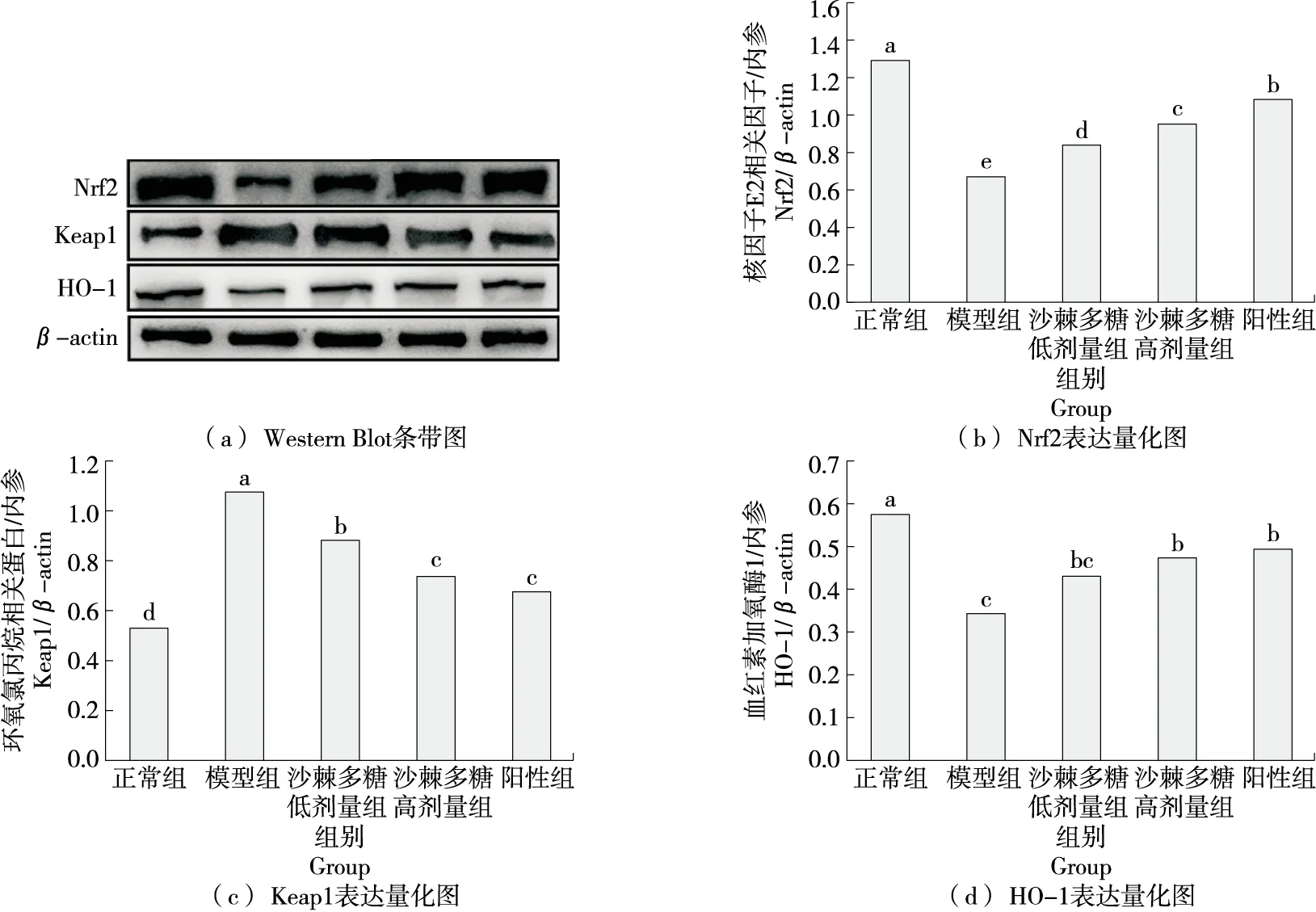
字母不同代表差异显著(P<0.05)图5 沙棘多糖对氧化应激蛋白表达的影响Figure 5 The effect of seabuckthorn polysaccharides on the expression of oxidative stress protein

图6 沙棘多糖对胰岛素抵抗HepG2细胞氧化应激的保护作用可能机制Figure 6 The possible mechanism of the protective effect of seabuckthorn polysaccharides on insulin-resistant HepG2 cells against oxidative stress
3 结论
沙棘多糖能够提高HepG2细胞胰岛素抵抗模型中葡萄糖消耗量以及糖原相对含量,提高其超氧化物歧化酶水平,降低丙二醛水平,改善胰岛素抵抗细胞模型异常糖代谢情况和氧化应激水平,并通过调控环氧氯丙烷相关蛋白/核因子E2/血红素加氧酶1通路起到改善胰岛素抵抗的作用。该试验弥补了沙棘多糖在胰岛素抵抗细胞层面上的空白,但仅从细胞层面测定了糖代谢的基础指标以及不同氧化酶和氧化应激相关蛋白,未在动物层面对其胰岛素抵抗作用进行研究,后续将对沙棘多糖在动物水平的胰岛素抵抗作用进行深入研究。
