米糠蛋白源ACE抑制肽的酶解制备及活性研究
2022-04-07张玲瑜苗建银戴伟杰李振伟
张玲瑜 苗建银 曹 愚 戴伟杰 刘 果 李振伟 曹 庸
(1. 华南农业大学食品学院广东省功能食品活性物重点实验室,广东 广州 510642;2. 广东惠尔泰生物科技有限公司,广东 广州 511356;3. 河源绿纯食品有限公司,广东 河源 517000)
高血压是一种心血管疾病,临床症状表现为血压升高,伴随头晕、头痛等[1]。随着人口老龄化及城镇化进程的加速,高血压发病人数持续增加,目前中国高血压患者约2.45亿人[2],高血压的防治已成为备受关注的问题。神经紧张素转换酶(Angiotensin I-converting Enzyme,ACE)是一类锌蛋白酶,主要存在于肺部毛细血管和肾脏上皮细胞,在肾素—血管紧张素系统中,ACE可以将血管紧张素Ⅰ裂解为可引起血管收缩的血管紧张素Ⅱ,进而引起高血压[3-5]。因此,研究中常用抑制ACE的手段达到降血压的效果。
市面上常见的降压药如卡托普利、赖诺普利等化学合成类物质,虽具有明显的降压效果,但服用会伴随一些副作用,如咳嗽、皮肤过敏、味觉紊乱等[6]。食源性生物活性肽来源广泛,安全性高,是化学合成药品的理想替代物,而目前有大量研究表明具有ACE抑制活性的食源性生物活性肽有显著的降血压功效,如南瓜籽肽[7]、大米肽[8]、芝麻籽肽[9]、香菇蛋白肽[10]等。
中国水稻产量丰富,稻谷年均总产量达2亿t以上,但稻米加工仍处于初加工状态,有效利用率只有60%~65%,大量米糠等资源未得到有效开发[11]。米糠是稻谷脱壳后精碾大米的副产物,稻米在加工为食用大米时约产生10%的米糠,而这些米糠含有的营养物质几乎占整个稻米的65%[12]。米糠中含有约12%~20%的蛋白质,氨基酸含量十分丰富[13],米糠蛋白经水解后可获得多种生物活性肽,如阿片拮抗肽[14]、抗氧化肽[15]、免疫功能调节肽[16]等。目前关于米糠蛋白ACE抑制肽的研究报道较少,且在酶解工艺上多采用碱性蛋白酶[17-18],而过高的pH在实际生产中易对工厂设备造成腐蚀损耗且后续加工增加了脱盐环节。此外酶添加量、酶解时间、温度等因素的选择都会对实际生产的能耗产生影响,因此寻求经济、环保的生产工艺值得深入探讨。
试验拟以ACE抑制率为指标,从酶种类、pH、酶添加量、底物质量浓度、酶解温度等方面进行酶解工艺的优化以获取ACE抑制肽制备的最优工艺条件,并检测其氨基酸组成,通过超滤进行初步分离,以期为进一步对ACE抑制肽进行分离纯化和研究其ACE抑制机理提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
米糠:由实验室自制;
胃蛋白酶:3.0×103NF·U/mg,广西南宁庞博生物工程有限公司;
木瓜蛋白酶:2.0×105U/g,广西南宁庞博生物工程有限公司;
胰蛋白酶:2.5×105U/g,广西南宁庞博生物工程有限公司;
中性蛋白酶:5 U/mg,上海麦克林生化科技有限公司;
4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)、N-[3-(2-呋喃基)丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG)、血管紧张素转换酶(ACE,来源于兔肺):美国Sigma公司;
氢氧化钠:分析纯,上海麦克林生化科技有限公司;
盐酸:分析纯,河南标准物质研发中心。
1.1.2 主要仪器设备
pH计:PHS-3CW型,赛多利斯科学仪器(北京)有限公司;
数显恒温水浴锅:HH-4型,金坛市华城海龙实验仪器厂;
电子天平:ME204/02型,梅特勒—托利多仪器(上海)有限公司;
多功能酶标仪:2300型,美国Perkin Elmer公司;
台式低速离心机:L530型,湖南湘仪实验室仪器开发有限公司;
冷冻干燥机:FD-1型,海门市其林贝尔仪器制造有限公司;
恒温振荡培养箱:HZQ-C型,常州澳华仪器有限公司。
1.2 方法
1.2.1 米糠蛋白酶解物制备 称取一定量的米糠蛋白粉,用蒸馏水溶解后调节pH至合适范围,将样品放入水浴锅,待样液温度达到设定温度后添加一定比例蛋白酶,水浴酶解3 h,90 ℃水浴灭酶10 min,冷却至室温,4 000 r/min 离心20 min,取上清液,即为米糠蛋白酶解物。
1.2.2 ACE抑制率测定 参照骆琳等[19]的方法,修改如下:用96孔板,在样品孔中分别添加40 μL的样液、50 μL的呋喃丙烯酰三肽(FAPGG)和10 μL的ACE酶;在空白孔中分别加入40 μL的HEPES缓冲溶液、50 μL的FAPGG和10 μL的ACE酶,使用酶标仪检测其340 nm处的吸光值并记录,在37 ℃下恒温保存30 min后再检测一次其在340 nm处的吸光值并记录,按式(1)计算ACE抑制率。
(1)
式中:
R——ACE抑制率,%;
a1——空白孔340 nm处的初始吸光度;
a2——37 ℃保温30 min后空白孔340 nm处的吸光度;
b1——样品孔340 nm处的初始吸光度;
b2——37 ℃保温30 min后样品孔340 nm处的吸光度。
1.2.3 最优酶的筛选 选取胰蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶,底物质量浓度为4 g/100 mL蒸馏水,酶添加量为0.3 g/100 g米糠蛋白,酶解3 h,以及各自最适pH和温度条件下制备米糠蛋白酶解物,将酶解物稀释10倍后测定其ACE抑制率以筛选出最优蛋白酶。
1.2.4 单因素试验
(1)pH对ACE抑制率的影响:用米糠蛋白与蒸馏水按4 g/100 mL底物质量浓度混合均匀,在pH为5.5,6.0,6.5,7.0,7.5条件下加入0.3 g/100 g米糠蛋白的酶在45 ℃下酶解3 h,将酶解物稀释10倍后测定其ACE抑制率以筛选出最佳pH条件。
(2)酶解温度对ACE抑制率的影响:用米糠蛋白与蒸馏水按4 g/100 mL底物质量浓度混合均匀,在pH为7.0条件下加入0.3 g/100 g米糠蛋白的酶分别在35,40,45,50,55 ℃下酶解3 h,将酶解物稀释10倍后测定其ACE抑制率以筛选出最佳酶解温度条件。
(3)底物质量浓度对ACE抑制率的影响:用米糠蛋白与蒸馏水分别按2,4,6,8,10 g/100 mL的底物质量浓度混合均匀,在pH为7.0条件下加入0.3 g/100 g米糠蛋白的酶在45 ℃下酶解3 h,将酶解物稀释10倍后测定其ACE抑制率以筛选出最佳底物质量浓度条件。
(4)酶添加量对ACE抑制率的影响:用米糠蛋白与蒸馏水按4 g/100 mL的底物质量浓度混合均匀,在pH为7.0条件下加入0.1,0.2,0.3,0.4,0.5 g/100 g米糠蛋白的酶在45 ℃下酶解3 h,将酶解物稀释10倍后测定其ACE抑制率以筛选出最佳酶添加量条件。
1.2.5 响应面优化试验 在单因素试验基础上,选取pH、底物质量浓度和酶解温度3个因素,根据Box-Benhnken试验设计原理,以米糠蛋白ACE抑制率为响应变量进一步优化酶解工艺。
1.2.6 酶解物和超滤组分ACE抑制活性评价 将最佳工艺条件下制备的酶解液通过超滤将其分成分子量>3 kDa 和<3 kDa两部分,随后将最优酶解物和超滤组分冷冻干燥至粉末,在0.5,1.0 mg/mL两个质量浓度下分别计算其ACE抑制率。
1.2.7 氨基酸组分测定 参照GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》的外标法,酸水解后测定酶解物中氨基酸的组成及其含量,在此测定中色氨酸被完全破坏。
1.2.8 数据处理 部分数据图采用Origin 8.6进行绘制。采用Design-Expert 8.0软件进行响应面试验的设计与分析,采用SPSS Statistics 21软件以单因素ANOVA法和Duncan法分析数据间差异,P<0.05表示存在显著性差异。
2 结果与分析
2.1 最优酶的筛选
天然食源性蛋白质经体外酶解或体内消化后,能产生具有特殊生理功能的肽段,而不同的蛋白酶因具有不同酶切位点,即使使用同种蛋白质原料,酶解后产生的肽段活性也存在差异[20]。如图1所示,中性蛋白酶酶解产物显示出最高的ACE抑制活性,ACE抑制率为(67.39±2.78)%,明显优于其他3种蛋白酶(P<0.05)。因此,后续试验均使用中性蛋白酶对米糠蛋白进行酶解。

字母不同表示在P<0.05水平存在显著性差异图1 蛋白酶种类对ACE抑制率的影响Figure 1 The effect of protease types on ACE inhibition rate
2.2 单因素试验
2.2.1 pH对米糠蛋白酶解物ACE抑制率的影响 由图2 可知,pH为7.0时,酶解物显示最好ACE抑制率,明显优于当pH为5.5,6.0,6.5时的(P<0.05)。这可能是pH偏离中性时中性蛋白酶的活性受到抑制,活性基团的解离状态发生改变,酶和底物的结合能力降低从而导致酶解效果不佳[21],所以最佳pH为7.0。
2.2.2 底物质量浓度对米糠蛋白酶解物ACE抑制率的影响 由图3可知,底物质量浓度在一定范围内变化较为明显,在到达4 g/100 mL的质量浓度后,虽有正增长,但变化缓慢,在8 g/100 mL的底物质量浓度条件下有最大ACE抑制率为(69.70±2.79)%,但与10 g/100 mL的底物质量浓度条件下ACE抑制率差异并不显著,可能是因为在此酶添加量下,底物已达到饱和,所以即使再加大底物质量浓度也不会再提高酶解液的ACE抑制率。所以,确定最佳底物质量浓度条件为8 g/100 mL。
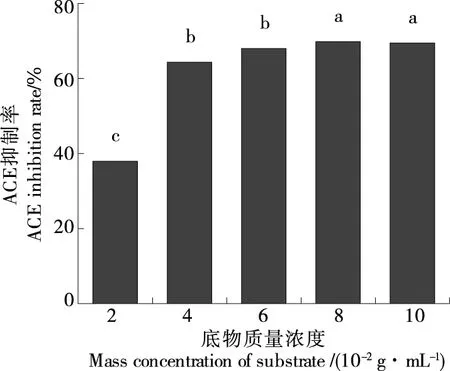
字母不同表示在P<0.05水平存在显著性差异图3 底物质量浓度对ACE抑制率的影响Figure 3 The effect of mass concentration of substrate on ACE inhibition rate
2.2.3 酶解温度对米糠蛋白酶解物ACE抑制率的影响
由图4可知,当酶解温度条件设置为45 ℃时,有最好的ACE抑制率(64.35±1.25)%,此结果明显优于其他温度下的(P<0.05)。中性蛋白酶最适宜的温度条件是45 ℃,温度在一定范围内升高,促进分子运动的加快,酶与底物的碰撞几率增大,从而提高酶的活性,得以释放更多肽段[22]。但是过高的温度又会一定程度上破坏酶的结构,而导致酶的活力受到影响甚至失活。所以选取的最佳酶解温度条件为45 ℃。
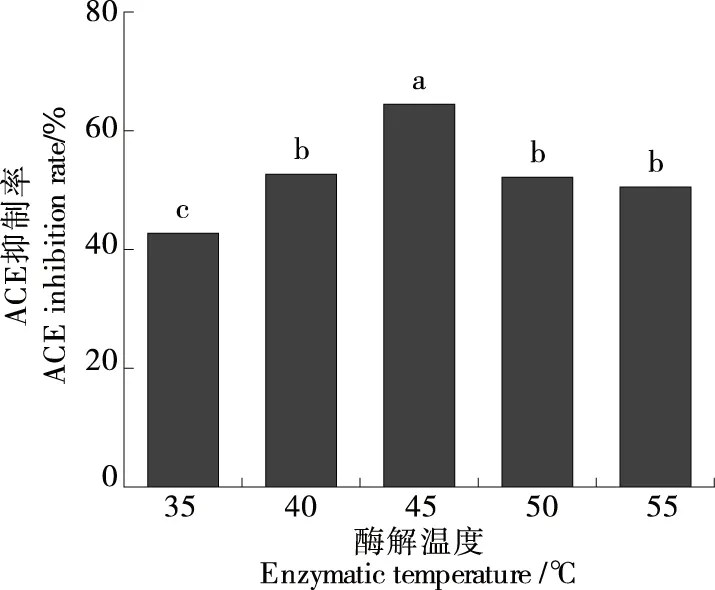
字母不同表示在P<0.05水存在显著性差异图4 酶解温度对ACE抑制率的影响Figure 4 The effect of enzymatic temperature on ACE inhibition rate
2.2.4 酶添加量对米糠蛋白酶解物ACE抑制率的影响
如图5所示,酶添加量与ACE抑制率在0.1~0.3 g/100 g 米糠蛋白浓度范围内呈正相关关系,在酶到达0.3 g/100 g米糠蛋白的添加量后,基本不再变化,有最大ACE抑制率为(68.73±2.11)%,此时再加大酶添加量,ACE抑制率变化并不显著,可能是因为在底物一定的情况下,酶添加量已达到饱和。从经济角度出发,确定最佳酶添加量为0.3 g/100 g米糠蛋白。

字母不同表示在P<0.05水平存在显著性差异图5 酶添加量对ACE抑制率的影响Figure 5 The effect of the enzyme addition on ACE inhibition rate
2.3 响应面优化试验
在单因素试验基础上,选定酶添加量为0.3 g/100 g米糠蛋白,以pH、底物质量浓度和酶解温度3个因素(见表1)进行进一步优化,响应面设计及结果如表2所示。

表1 响应面因素水平设计表Table 1 Response surface factor level design

表2 响应面设计方案及试验结果Table 2 Response surface design scheme and experimental results
运用Design-Expert 8.0对响应面结果进行多元回归拟合,得到ACE抑制率对于pH、底物质量浓度和酶解温度的二次回归方程为:
Y=72.08+4.02A+3.20B+2.02C-0.065AB+2.31AC-0.35BC-4.06A2-1.47B2-3.72C2。
(2)
根据方差分析(表3),回归模型高度显著(P<0.01),失拟项不显著(P>0.01),表明此模型比较稳定和理想。决定系数R2=0.964 2,表明模型与实际试验拟合较好。因素A、B、C的一次项均显著(P<0.01),说明pH、底物质量浓度和酶解温度均对酶解产生显著的影响。交互项AB、AC、BC均不显著,说明任意两因素间交互作用不显著,两个因素间的交互作用详见图6。比较表3各因素的F值,可以得知3个因素对酶解液ACE抑制率的影响作用大小顺序为:pH>底物质量浓度>酶解温度。
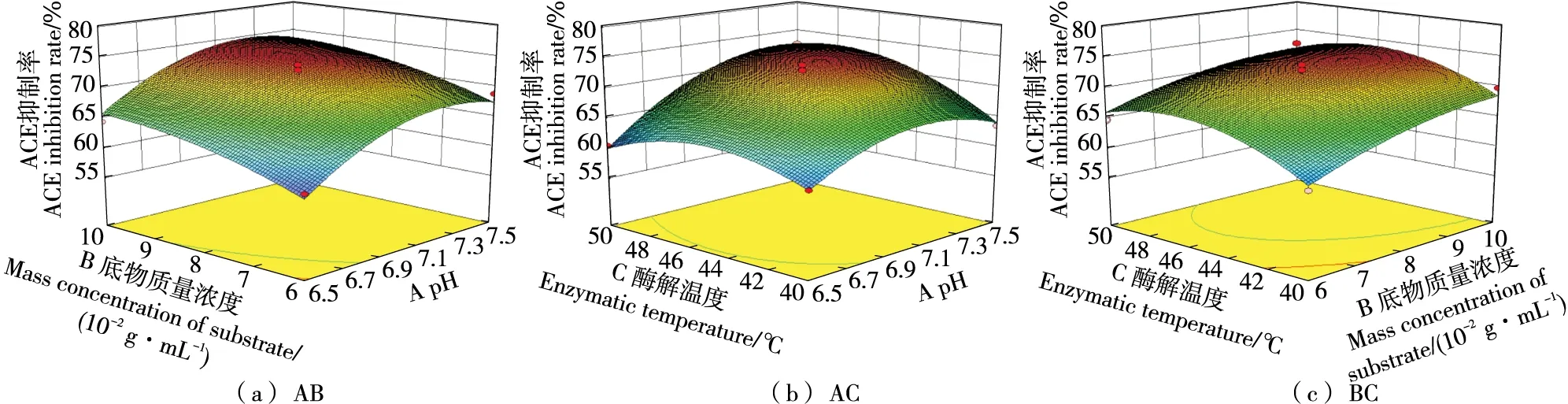
图6 pH、酶解温度、底物质量浓度交互作用对ACE抑制率的影响Figure 6 The influence of the interaction of pH,enzymatic hydrolysis temperature,and substrate mass concentration on the inhibition rate of ACE
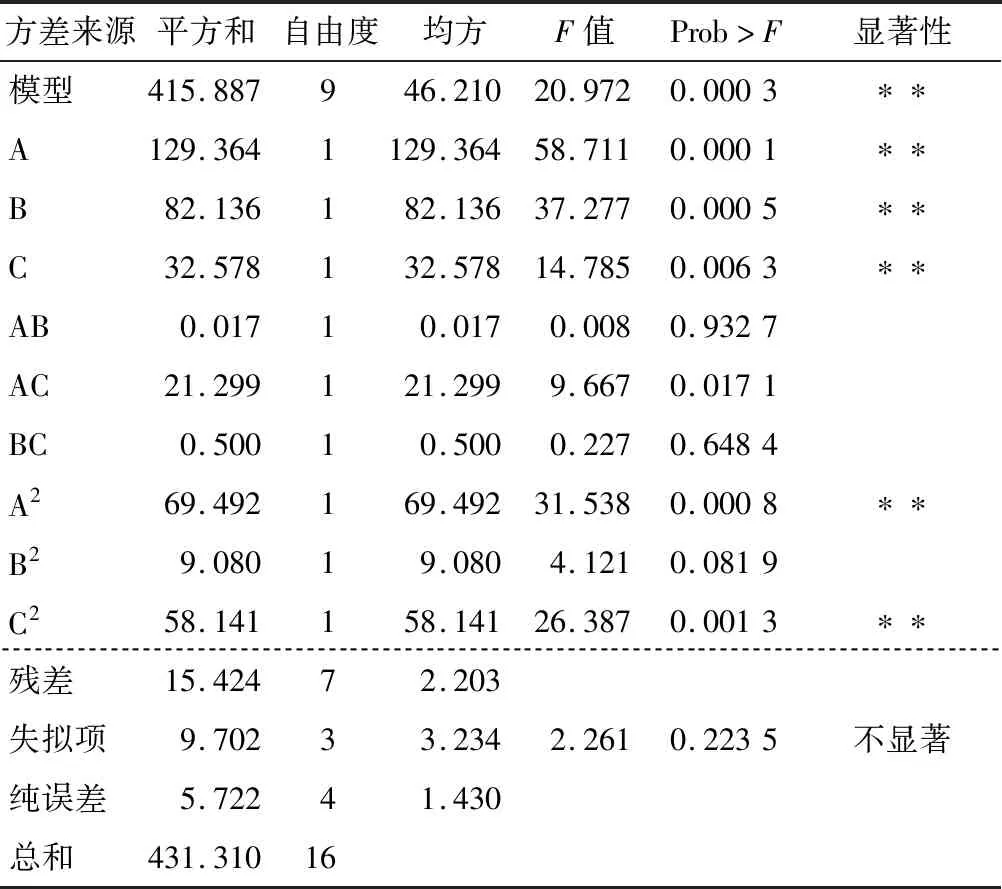
表3 回归模型方差分析†Table 3 Analysis of variance of regression model
根据模型预测,在pH 7.23,底物质量浓度8.22 g/100 mL,酶解温度46.43 ℃时有最好的ACE抑制率73.96%,按实际情况将工艺调整为pH为7.2,底物质量浓度为8.2 g/100 mL,酶解温度为46 ℃,酶解3 h后测其ACE抑制率为(74.63±1.01)%,结果符合模型预测,证明此模型与实际情况较为相符。因此,米糠蛋白源ACE抑制肽的酶解制备最优工艺为:pH 7.2,底物质量浓度8.2 g/100 mL,酶解温度46 ℃,酶添加量0.3 g/100 g米糠蛋白,酶解时间3 h。
2.4 酶解物和超滤组分ACE抑制活性评价
利用3 kDa超滤膜超滤分离酶解物,冷冻干燥后测定酶解物和不同超滤组分在同一浓度条件下的ACE抑制率,同时与降血压药物卡托普利、马来酸依那普利进行阳性对照,结果如图7所示。在1.0 mg/mL的质量浓度下,阳性药物卡托普利和马来酸依那普利有最好的ACE抑制活性,其他组分都表现出显著的ACE抑制活性,分子量<3 kDa组分的ACE抑制率[(81.68±1.08)%]显著优于酶解物[(72.64±1.61)%]和分子量>3 kDa组分的[(58.65±2.31)%]。Yu等[23]将鱼胶原蛋白酶解物超滤分成4个不同分子量大小的组分,结果表明最小分子量组分有最好的ACE抑制率;Yang等[24]将阿拉斯加鳕鱼皮蛋白酶解物分成分子量>10,3~10,<3 kDa的组分,其中<3 kDa组分有最好的ACE抑制率。说明分子量大小与ACE抑制率有显著的联系,分子量越小,其ACE抑制率越高。
2.5 氨基酸组成分析
由表4可知,米糠蛋白酶解物中有16种氨基酸,包含除色氨酸外的7种必需氨基酸和9种非必需氨基酸,其中谷氨酸含量最高(11.88 g/100 g),占氨基酸总量的18.75%,其次是精氨酸(5.62 g/100 g)和亮氨酸(5.14 g/100 g)。

表4 米糠蛋白酶解物中的氨基酸含量†Table 4 Amino acid content in rice bran enzymatic hydrolysate
必需氨基酸总含量为22.82 g/100 g,占氨基酸总量的36.01%,符合FAO/WHO提出的理想蛋白模式[25]。同时,酶解物中疏水性氨基酸含量丰富,约为23.09 g/100 g。研究[26-27]发现,氨基酸C端疏水性和正电荷正向影响肽的ACE抑制活性,这是因为肽的C端氨基酸有助于抑制剂在ACE活性位点的结合,ACE抑制活性依赖疏水性氨基酸,所鉴定的疏水氨基酸含量较高的ACE抑制肽通常比疏水氨基酸含量较低的ACE抑制肽活性更高。说明米糠是提取ACE抑制肽的理想原料,有很好的应用前景。
3 结论
以米糠蛋白为原料,以神经紧张素转换酶抑制率为指标,利用响应面法优化酶解工艺。用4种不同的蛋白酶对其进行酶解,选取中性蛋白酶进行单因素以及响应面试验,最佳酶解工艺参数为:pH 7.2,底物质量浓度8.2 g/100 mL,酶解温度46 ℃,酶添加量0.3 g/100 g米糠蛋白,酶解时间3 h,此工艺参数反应条件温和,应用于工业生产较为经济友好。在此条件下制备获得的酶解物的神经紧张素转换酶抑制率为(74.63±1.01)%,有显著的ACE抑制活性。酶解物超滤后通过活性分析表明分子量大小显著影响其神经紧张素转换酶抑制活性。氨基酸分析显示米糠蛋白酶解物有22.82 g/100 g的必需氨基酸和23.09 g/100 g的疏水性氨基酸,与前人[26-27]认为神经紧张素转换酶抑制活性与疏水性氨基酸有关的研究一致。试验仅限于体外的神经紧张素转换酶抑制功效,后续将继续对酶解物进行分离纯化和结构鉴定以得到单体肽段,并深入探究其抑制神经紧张素转换酶的具体机制。

字母不同表示在P<0.05水平存在显著性差异图7 不同组分在同一质量浓度(1 mg/mL)下的ACE抑制率Figure 7 ACE inhibition rate of different components at the samemass concentrations (1 mg/mL)
