镁毒害抑制茉莉酸信号通路增加拟南芥对南方根结线虫敏感性的研究*
2022-04-07胡先奇
刘 沛,王 丹,胡先奇
(云南农业大学,云南生物资源保护与利用国家重点实验室,云南 昆明 605201)
矿质元素是植物正常生长所必需的营养元素,也对植物响应病害的发生和发展具有直接或间接的影响[1]。按植物对矿质元素的需求量和植物体内矿质元素的含量等标准划分,镁被认为是重要的中量元素[2];亦有学者将镁的重要性上升至继氮、磷、钾之后的第四大必需元素[3]。镁参与植物细胞内多种生长和发育过程,特别是在植物叶绿素的生物合成过程中,镁的作用尤为凸显。镁居于叶绿素分子核心结构卟啉环的中央位置,对于卟啉环结构的稳定和功能的发挥意义重大。植物细胞内镁的变化首先通过叶绿素的变化体现出来。同时,镁还作为辅酶因子参与植物细胞内碳元素的固定和碳代谢等过程[4]。植物对镁的需求主要通过土壤吸收满足。一方面,随着农田复种指数不断提高,土壤中的镁随农作物的吸收被不断带出,形成了农作物长期镁缺乏并逐年加重的趋势;另一方面,种植于蛇纹岩土等特定生境中的农作物又面临镁过量进而形成镁胁迫的情况[5]。研究显示:土壤中镁含量小于125 μmol/L会对植物形成镁缺乏胁迫;而当镁含量超过8.5 mmol/L 时,又会对植物造成镁毒害胁迫[6]。因此,深入分析镁对植物生理过程的影响具有重要意义。
在植物响应病害发生发展过程中,镁的作用呈摇摆性。有研究报道:由水稻(Oryza sativa)转运蛋白CorA 介导的镁吸收是稻瘟菌(Magnaporthe oryzae)在水稻上生长发育、侵染致病的基础[7];而另有研究却表明:镁元素可以抑制枯萎病和软腐病病原菌的生长,进而增进植物对病害的抗性[8]。造成镁对植物病害影响呈摇摆性的原因可能是镁与钾、钙元素均会产生拮抗作用[9]。前人研究指出:钾、钙元素都具有促进植物抗病的生理功能。镁对钾或钙的拮抗,影响了后者生理功能的发挥或其介导的相关抗病通路信号的传导等过程,从而造成植物对病害的敏感性上升[10]。但目前关于镁对植物病害发生发展影响的研究还不够充分,尤其其中的分子机理有待揭示。
根结线虫是重要的土传性植物寄生线虫,其代表种群是南方根结线虫(Meloidogyne incognita)。根结线虫寄主范围广泛,危害严重,对农业生产的威胁巨大[11]。根结线虫通过头感器、食道腺和尾感器等多个器官分泌结构多样、功能复杂的效应因子,调控植物细胞的生长、发育和分化等过程,从而促进根结线虫寄生致病[12-14]。效应因子通常靶向于植物细胞内特定的互作靶标,通过复杂的分子互作达到调控细胞各生理过程的目的。已有研究多关注于根结线虫效应因子与植物细胞靶标蛋白的互作关系[15],对于矿质元素在这一互作过程中的影响分析较少。对于这一科学问题,有必要进行更深入的研究。
1 材料与方法
1.1 拟南芥培养
将Col-0 生态型拟南芥种子经2%次氯酸钠水溶液表面消毒10 min,之后以无菌水清洗3 次。将消毒后的拟南芥种子点播于含3%蔗糖和0.4% PhytagelTM试剂 (Sigma 公司) 的灭菌MS 培养基 (Sigma 公司) 表面,竖直置于光照培养箱 (22 ℃,16 h 光照/8 h 黑暗) 中生长约2 周。
将用于测定叶绿素含量的拟南芥幼苗移栽至口径10 cm×10 cm、高8 cm、装有灭菌蛭石基质的塑料花盆中,每盆移栽1 株幼苗。移栽后将幼苗置于温室 (22 ℃,16 h 光照/8 h 黑暗) 中培养,按每盆50 mL 用量立即浇灌营养液(按MS 培养基[16]配方配制)。以分别添加终浓度为1.5 mmol/L 和15 mmol/L MgCl2的营养液作为试验处理,以不添加MgCl2的营养液为对照处理 (CK)。移栽后每7 d 浇灌1 次营养液,并分别取每株拟南芥的3 片莲座叶进行叶绿素含量测定,每个处理取5 株。
将用于线虫敏感性分析的拟南芥幼苗按上述方法移栽,并置于温室(22 ℃,16 h 光照/8 h 黑暗)中培养。移栽后按每盆50 mL 用量立即浇灌营养液(配方与上述相同)。以添加终浓度为15 mmol/L MgCl2的营养液作为试验处理,以不添加MgCl2的营养液为对照处理 (CK)。移栽后每7 d 浇灌1 次营养液。移栽30 d 后,对拟南芥幼苗接种南方根结线虫进行敏感性分析。
向无菌的12 孔细胞培养板的每1 孔加入含3%蔗糖的灭菌MS 液体培养基(Sigma 公司) 2 mL,以添加15 mmol/L MgCl2的MS 液体培养基为试验处理,以不添加MgCl2的MS 液体培养基为对照处理(CK)。将用于转录组测序和实时荧光定量PCR (qPCR) 验证的拟南芥幼苗分别移入上述培养基中,每孔1 株;将幼苗置于光照培养箱(22 ℃,16 h 光照/8 h 黑暗) 中生长7 d 后收集材料备用。转录组测序中,每个处理分别包含3个生物学重复,每个重复15 株幼苗;qPCR 试验中,每个处理收集15 株幼苗用于验证。
1.2 叶绿素含量测定
于每株拟南芥上取3 片莲座叶记录质量;之后将叶片置于10 mL 塑料离心管中,加入95%乙醇6 mL 浸泡提取叶绿素,静置提取2 d后通过比色法测定叶绿素含量。以95%乙醇为空白对照,分别测定649 和665 nm 波长下各浸提液的吸光值(OD 值)。每个处理分别测定5 株拟南芥,共进行3 次生物学重复。按以下公式计算叶绿素a (ρa,mg/mL)、叶绿素b (ρb,mg/mL)、总叶绿素 (ρt,mg/mL)和鲜叶单位质量叶绿素(ω,mg/g) 的含量[17]:

式中:V为加入乙醇体积,6 mL。
1.3 线虫培养及敏感性分析
南方根结线虫的培养和扩繁参照NIU 等[18]报道的方法进行。收集新鲜孵化的南方根结线虫2 龄幼虫,按每株约400 头的数量接种于前述拟南芥根部,进行线虫敏感性分析。接种30 d 后,小心将拟南芥根系取出洗净,通过酸性品红染色法[19]染色后分别统计根上的雌成虫数和根结数。每个处理至少统计15 株拟南芥,共进行3 次生物学重复。
1.4 转录组测序
转录组测序由上海美吉生物医药科技有限公司完成。以log2FC>1 且P<0.05 为选择标准 (FC为2 组样本表达量比值),筛选出与对照组相比在3个生物学重复中均显著上调或下调的基因进行KEGG 注释并进一步分析其功能。转录组测序数据已上传至国家基因组数据中心 (https://bigd.big.ac.cn/gsa,登录号:CRA003055)。
1.5 差异表达基因的qPCR 验证
以试剂盒Total RNA Kit II (Omega 公司)提取拟南芥总RNA;通过试剂盒GoldenstarTMRT6 cDNA Synthesis Kit (TsingKe 公司)反转录获得cDNA。在qPrimerDB 数据库 (https://biodb.swu.edu.cn/qprimerdb/) 中查询获得拟南芥基因特异的qPCR 引物(表1)[20],分别以MON1和TIP41作为内参基因[21]。qPCR反应使用2×TSINGKE Master Mix (TsingKe 公司)试剂,在ABI7500 Real-time PCR System (Applied Biosystem 公司)上进行。反应使用两步法程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃复性/延伸30 s,共40个循环。结果使用软件SDS v2.0 进行分析,以2-ΔΔCt法计算基因表达差异[22]。

表1 qPCR 验证引物列表Tab.1 List of primers used for quantitative PCR
1.6 统计分析方法
统计分析使用SPSS 13.0 的ANOVA 方法。
2 结果与分析
2.1 镁毒害抑制拟南芥叶绿素合成
由图1 可知:1.5 mmol/L MgCl2处理组的叶绿素含量与同时期CK 相比均没有显著差异,说明不添加镁元素的液体MS 培养基浇灌处理可满足拟南芥叶绿素合成的需求,而加入适量镁元素(1.5 mmol/L)并没有显著促进拟南芥叶绿素的合成,符合镁作为中量元素的生物学作用。镁毒害处理组(15 mmol/L MgCl2)的叶绿素含量均显著或极显著低于CK 组(P<0.05 或P<0.01),说明过量添加镁元素(15 mmol/L MgCl2)可抑制拟南芥叶绿素合成,对拟南芥形成毒害胁迫。

图1 镁毒害抑制拟南芥叶绿素合成Fig.1 Magnesium toxicity inhibiting the chlorophyll synthesis in Arabidopsis
2.2 镁毒害增加拟南芥对南方根结线虫的敏感性
由图2 可知:镁毒害处理组 (15 mmol/L MgCl2)根内的雌成虫数为36±8,根表形成的根结数为30±6,分别显著高于CK 处理的雌成虫数(17±7)和根结数 (13±5)。

图2 镁毒害增加拟南芥对南方根结线虫敏感性的影响Fig.2 Effect of magnesium toxicity increasing on the sensitivity of Arabidopsis to Meloidogyne incognita
2.3 转录组测序揭示镁毒害引起的基因表达差异
挖掘转录组测序数据后共得到差异表达基因70个,其中,表达上调的基因48个,表达下调的基因22个。上、下调基因中分别有8个基因具有KEGG 注释信息(表2)。

表2 具KEGG 注释的差异表达基因Tab.2 Differential expressed genes with KEGG annotations
8个表达上调基因分属7个生物学过程:氨基酸代谢、次级代谢产物生物合成、碳水化合物代谢、辅酶因子和维生素代谢、萜类和多酮类化合物代谢、信号转导以及环境适应。可以看出,在感受到镁毒害胁迫信号后,拟南芥细胞启动了碳水化合物、氨基酸、脂、维生素和次级代谢产物等多个与正常营养生长和生物量积累相关的重要代谢过程。但相关基因上调的结果可能不足以回补镁毒害胁迫造成的不良影响,拟南芥仍然表现出以叶绿素含量下降为标志的生长受抑制表型。
8个表达下调基因分属4个生物学过程:氨基酸代谢、碳水化合物代谢、脂类代谢和信号转导。有别于上调基因较为分散地涉及多个生物学过程,下调基因中有5个基因(MYC2、VSP1、VSP2、JAZ9和JAZ10)同属于植物信号转导途径中的茉莉酸信号传导相关通路(ath04016 和ath04075);而AOC2则属于茉莉酸生物合成通路(ath00592)。这一结果与前述镁毒害胁迫下拟南芥对南方根结线虫敏感性增加的结果相一致。研究结果初步表明:茉莉酸在拟南芥与南方根结线虫的互作中发挥着帮助植物抗线虫的生物学功能。
进一步通过qPCR 方法,分别使用2个拟南芥内参基因MON1和TIP41对具有KEGG 注释信息的差异表达基因进行表达验证分析。结果(图3)显示:每个差异表达基因在经过双内参校正后,其表达上、下调趋势相一致;与CK 相比表达差异明显,与转录组测序数据吻合。荧光定量PCR 的结果进一步佐证了镁毒害胁迫对拟南芥茉莉酸生物合成和信号传导途径的影响。
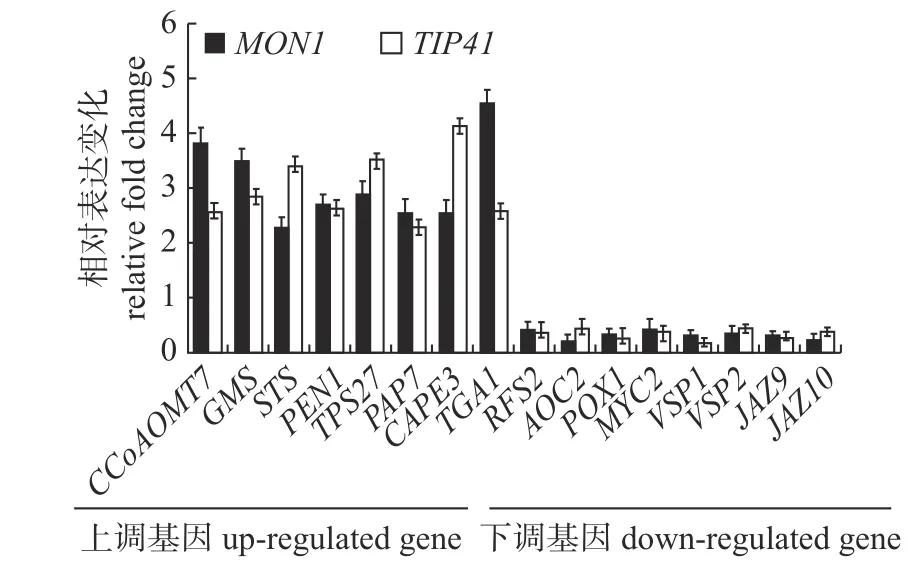
图3 qPCR 验证基因的表达Fig.3 qPCR verifications for differential expressed genes
3 讨论
自然环境中,镁毒害是特殊生境下植物面临的非生物胁迫,过量施用镁肥也会产生相应问题。已有研究显示:镁毒害抑制拟南芥淀粉含量和生物量积累[6]。在此基础上,本研究发现镁毒害抑制拟南芥叶绿素合成。镁元素的一项重要生物学功能即是参与植物细胞中叶绿素的生物合成,而镁毒害胁迫反而抑制了该过程,预示着植物对镁的吸收利用可能存在反馈抑制的机制。对受镁毒害胁迫拟南芥材料进行转录组测序和qPCR 验证的结果进一步证明:在镁毒害胁迫下,拟南芥多个代谢相关基因显著上调,但相关基因的上调表达并没有在表型上回补镁毒害产生的影响。相关研究结果明确了过量施用镁肥并不能如预期增产,反而会对植物生长产生不利影响[23]。因此,合理施用镁肥,不论是从节约生产成本和保护生态环境等角度,还是从促进植物正常生长角度分析,都具有重要意义。
镁毒害增加了拟南芥对南方根结线虫侵染的敏感性,同时还会干扰拟南芥茉莉酸生物合成和茉莉酸介导防卫反应信号通路的信号传导,表明了二者之间潜在的联系。茉莉酸是研究较为充分的植物防卫反应相关激素[24]。已有研究表明:茉莉酸在植物响应昆虫啃食、机械创伤和死体寄生病原物过程中发挥作用[25]。对于茉莉酸在植物应对根结线虫寄生过程中的作用,目前研究还存在较大争议。研究报道显示:通过叶片喷施茉莉酸类化合物-茉莉酸甲酯会诱导植物对根结线虫的抗性[26-27];而亦有研究发现:茉莉酸信号通路是否完整是线虫侵染番茄的关键[28]。本研究结果证明:在拟南芥与南方根结线虫互作过程中,茉莉酸发挥了帮助植物抵抗线虫的生物学功能。综上所述,镁毒害增加拟南芥对南方根结线虫的敏感性,可能是镁毒害对拟南芥正常生长影响和干扰茉莉酸介导防卫反应的综合作用,相关潜在作用机理还有待深入研究。
4 结论
镁毒害胁迫下,拟南芥叶片的叶绿素生物合成受到显著抑制,同时,拟南芥植株对南方根结线虫侵染的敏感性显著增加。转录组测序分析发现:镁毒害胁迫下拟南芥多个代谢相关基因表达显著上调,而5个与茉莉酸生物合成或信号传导相关的关键基因则显著下调。qPCR 分析验证了转录组测序的结果。本研究首次表明:镁元素参与了茉莉酸介导的拟南芥对南方根结线虫的防卫反应;镁毒害对拟南芥茉莉酸合成和信号通路的干扰,增加了拟南芥对南方根结线虫的敏感性。
