ghrelin-GHSR-1a对高糖环境下视网膜血管内皮细胞的保护作用△
2022-04-06姚国敏周凌霄
李 蓉 姚国敏 周凌霄 张 敏 闫 瑾
ghrelin是一种肽激素,因其在刺激食欲和摄食行为、能量稳态和碳水化合物代谢中的作用而闻名[1]。ghrelin与生长激素分泌素受体(GHSR)结合并激活下游信号,发挥一系列的生物学效应[2],而针对ghrelin-GHSR系统的各种化合物在动物和体外干预肥胖及相关代谢紊乱方面均显示出良好的疗效[3]。近年来研究表明,由于其抗炎、抗氧化、抗凋亡等作用机制,ghrelin在葡萄膜炎、白内障、青光眼、缺血性视网膜病变等眼科疾病方面显示出治疗潜力[4]。鉴于内源性ghrelin系统对全身代谢的多种有益作用,其药理靶向被认为是治疗糖尿病的一种有价值的方法[5]。本研究在体外观察了ghrelin对高浓度葡萄糖条件下视网膜血管内皮细胞增殖和凋亡的影响,为进一步研究ghrelin对糖尿病视网膜病变(DR)的治疗潜能提供理论依据。
1 材料与方法
1.1 实验材料永生化人视网膜血管内皮细胞系(HRMECs)购自上海中乔新舟生物科技有限公司;M199培养基购自武汉普诺赛生命科技有限公司;胎牛血清购自上海金畔生物科技有限公司;ghrelin购自美国Glpbio公司;GHSR-1a抗体购自美国Affinity公司;浓缩型正常山羊血清、荧光(Cy3)标记羊抗兔IgG均购自武汉博士德生物工程有限公司;CCK-8细胞增殖及细胞毒性检测试剂盒和Annexin-V/FITC-PI 凋亡检测试剂盒均购自武汉伊莱瑞特生物科技有限公司;引物由北京擎科生物科技有限公司合成;LipofectamineTM2000 Reagent购自美国Invitrogen公司;RNA提取试剂盒购自美国Thermo Fisher公司;HiScript®II Q RT SuperMix和SYBR Green Master Mix均购自南京诺唯赞生物科技股份有限公司;兔多抗Bax抗体及Bcl-2抗体均购自美国Abcam公司;兔多抗GAPDH抗体购自杭州贤至生物科技有限公司;辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 HRMECs培养及分组将HRMECs置于含10% 胎牛血清的M199培养基中,在37 ℃、体积分数5% CO2及饱和湿度条件下培养。为了检测GHSR-1a的表达,将HRMECs随机分为对照组(在含5.5 mmol·L-1葡萄糖的M199培养基中培养)和高浓度葡萄糖组(在含30.0 mmol·L-1葡萄糖的M199培养基中培养),两组细胞均培养48 h,采用免疫荧光染色法检测两组细胞中GHSR-1a的表达。然后另取HRMECs分为C组(处理同对照组),G组(处理同高浓度葡萄糖组)和不同浓度ghrelin组(用30.0 mmol·L-1葡萄糖分别联合0 nmol·L-1,2.5 nmol·L-1,5.0 nmol·L-1,10.0 nmol·L-1,20.0 nmol·L-1,40.0 nmol·L-1ghrelin处理细胞),培养12 h、24 h、48 h和72 h,以选择ghrelin的最佳作用浓度和时间进行后续实验。为检测细胞增殖和细胞凋亡情况,另取HRMECs随机分为5组:正常对照(NC)组(处理同对照组)、高糖(HG)组(处理同高浓度葡萄糖组)、HG+ghrelin组(HRMECs在含30.0 mmol·L-1葡萄糖、10.0 nmol·L-1ghrelin的M199培养基中培养)、HG+ghrelin+siGHSR-1a组(HRMECs转染GHSR-1a-特异性siRNA,24 h后在含30.0 mmol·L-1葡萄糖和10.0 nmol·L-1ghrelin的M199培养基中培养)和HG+ghrelin+NC-siGHSR-1a组(非特异性序列转染HRMECs,24 h后在含30.0 mmol·L-1葡萄糖和10.0 nmmol·L-1ghrelin的M199培养基中培养),孵育48 h。
1.2.2 免疫荧光化学法检测HRMECs中GHSR-1a的表达HRMECs爬片用PBS冲洗,40.0 g·L-1多聚甲醛固定15 min。PBS冲洗后,在室温下用5.0 g·L-1Triton X-100处理玻片20 min。洗涤干燥后,用山羊血清室温浸泡30 min。每张玻片滴加抗GHSR-1a(1100)一抗,4 ℃孵育过夜;然后用Cy3标记的山羊抗兔IgG (1100)二抗37 ℃孵育1 h。滴加DAPI 避光孵育5 min,然后用抗荧光淬灭的密封液封片。荧光显微镜下采集图像,每组选取3张400倍的放大图像,采用IPP6.0软件分析光密度。
1.2.3 CCK-8法检测HRMECs的细胞活力将C组、G组和不同浓度ghrelin组以及NC组、HG组、HG+ghrelin组、HG+ghrelin+siGHSR-1a组和HG+ghrelin+NC-siGHSR-1a组的HRMECs以5.0×103个·mL-1接种于96孔板中,在37 ℃,体积分数5% CO2条件下培养48 h,每孔加入10.0 μL CCK-8试剂,继续孵育4 h之后,采用酶标仪检测450 nm波长处的吸光度(A)值。细胞活力(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.4 siRNA细胞转染对数生长期HRMECs接种于6孔板中,37 ℃培养箱培养24 h。当细胞生长融合约为50%时,按照说明书采用LipofectamineTM2000试剂向HRMECs转染20.0 μmol·L-1GHSR-1a特异性siRNA。将转染了GHSR-1a特异性siRNA和非特异性序列(阴性对照)的细胞分别设为GHSR-1a-siRNA组和NC-siRNA组。未转染的细胞作为转染对照组。转染24 h后用RT-PCR法检测HRMECs中GHSR-1a的表达。
1.2.5 RT-PCR检测GHSR-1a mRNA水平按照说明书采用RNA提取试剂盒从HRMECs中提取总RNA。为了获得cDNA,采用HiScript®II Q RT SuperMix对2 μg mRNA进行反转录PCR。采用SYBR Green Master Mix在PCR系统中进行RT-PCR。用于靶基因mRNA检测的引物序列如下:GHSR的上游引物为5’-CTACAGTCTCATCGGCAGGA-3’,下游引物为5’-GAGAGAAGGGAGAAGGCACA-3’;GAPDH的上游引物为5’-TCAAGAAGGTGGTGAAGCAGG-3’,下游引物为5’-TCAAAGGTGGAGGAGTGGGT-3’。采用2-ΔΔCt法计算GHSR-1a的mRNA相对表达量。
1.2.6 流式细胞术检测HRMECs的细胞凋亡情况取对数生长期HRMECs,以每孔0.5×106个接种于6孔板中,37 ℃培养箱孵育48 h。消化后收集细胞并离心,用500 μL结合缓冲液重悬,然后加入5.0 μL AnnexinV-FITC避光振荡混匀,室温孵育15 min,上机前5 min加入5.0 μL PI染色,用流式细胞仪检测530 nm和575 nm波长处细胞凋亡情况。
1.2.7 Western blot检测HRMECs中Bax和Bcl-2蛋白的表达收集各组HRMECs,用RIPA裂解液提取HRMECs总蛋白,BCA试剂盒测定蛋白含量,用SDS-PAGE凝胶电泳分离目标蛋白,然后转移到PVDF膜上,用含50.0 g·L-1脱脂奶粉的TBST孵育膜2 h,分别加入稀释的多克隆抗体Bax(12000)、Bcl-2 (11000)和GAPDH(11000),4 ℃孵育过夜。TBST洗膜,用辣根过氧化物酶标记的二抗(110 000)在室温下孵育2 h,与一抗结合。使用化学发光试剂盒对蛋白条带进行显色处理,并用Bandscan 5.0 软件对其进行量化处理。以GAPDH作为内参,计算Bax和Bcl-2蛋白的相对表达量。
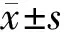
2 结果
2.1 高糖对HRMECs中GHSR-1a表达的影响免疫荧光染色结果显示, GHSR-1a在高浓度葡萄糖组中的表达低于对照组,两组细胞的光密度分别为0.002±0.000和0.018±0.004,组间差异具有统计学意义(t=-6.93,P<0.05)(图1)。

图1 免疫荧光法观察对照组与高浓度葡萄糖组HRMECs中GHSR-1a的表达
2.2 ghrelin对高糖环境下HRMECs细胞活力的影响G组、2.5 nmol·L-1ghrelin组和40.0 nmol·L-1ghrelin组的细胞活力从12 h到72 h随时间延长而下降。5.0 nmol·L-1ghrelin组、10.0 nmol·L-1ghrelin组和20.0 nmol·L-1ghrelin组的细胞活力从12 h到48 h随时间增加而增加,从48 h到72 h则下降。因此,本研究选择10.0 nmol·L-1ghrelin处理48 h进行后续实验。
2.3 转染siRNA对HRMECs中GHSR-1a表达的影响siRNA转染沉默GHSR-1a在HRMECs中的表达后,转染对照组、NC-siRNA组和GHSR-1a-siRNA组细胞中GHSR-1a mRNA相对表达量分别为1.00±0.00、1.01±0.04和0.29±0.02,组间比较差异有统计学意义(F=821.23,P<0.001),GHSR-1a-siRNA组与转染对照组和NC-siRNA组GHSR-1a mRNA相对表达量比较差异均有统计学意义(均为P<0.001),而转染对照组与NC-siRNA组比较差异无统计学意义(P>0.05),表明GHSR-1a被成功敲低。
2.4 ghrelin-GHSR-1a对高糖环境下HRMECs细胞活力的影响CCK-8检测显示,NC组、HG组、HG+ghrelin组、HG+ghrelin+siGHSR-1a组和HG+ghrelin+NC-siGHSR-1a组细胞活力分别为1.00、69.87%±0.68%、92.31%±3.62%、75.98%±4.67%和90.87%±1.95%,总体比较差异有统计学意义(F=59.33,P<0.001)。进一步两两比较显示,除HG+ghrelin组细胞活力与HG+ghrelin+NC-siGHSR-1a组比较差异无统计学意义(t=-0.61,P>0.05)外,其余各组HRMECs的细胞活力两两比较差异均有统计学意义(均为P<0.05),这提示,ghrelin-GHSR-1a可提高HRMECs在高糖条件下的细胞活力。
2.5 ghrelin-GHSR-1a对高糖环境下HRMECs细胞凋亡的影响流式细胞仪检测结果显示,NC组、HG组、HG+ghrelin组、HG+ghrelin+siGHSR-1a组和HG+ghrelin+NC-siGHSR-1a组的细胞凋亡率分别为5.76%±0.36%、20.53%±0.38%、10.84%±0.52%、14.93%±0.18%和11.03%±0.62%,总体比较差异有统计学意义(F=468.88,P<0.001)。进一步LSD-t检验比较结果显示,除HG+ghrelin组细胞凋亡率与HG+ghrelin+NC-siGHSR-1a组比较差异无统计学意义(t=0.40,P>0.05)外,其余各组HRMECs细胞凋亡率两两比较差异均有统计学意义(均为P<0.05)(图2),这表明ghrelin-GHSR-1a降低了高糖条件下HRMECs的细胞凋亡率。

A:NC组;B:HG组;C:HG+ghrelin组;D:HG+ghrelin+NC-siGHSR-1a组;E:HG+ghrelin+NC-siGHSR-1a组。图2 流式细胞仪检测各组HRMECs细胞凋亡率
2.6 ghrelin-GHSR-1a对高糖环境下HRMECs中Bax和Bcl-2蛋白相对表达量的影响Western blot结果显示,NC组、HG组、HG+ghrelin组、HG+ghrelin+siGHSR-1a组和HG+ghrelin+NC-siGHSR-1a组细胞的Bax蛋白和Bcl-2蛋白的相对表达量分别为0.17±0.03 和 0.64±0.05,0.75±0.04和0.14±0.02,0.38±0.04和0.49±0.08,0.56±0.04和0.33±0.07,0.40±0.06和0.46±0.09,总体比较差异均有统计学意义(均为P<0.001),两两比较显示,除HG+ghrelin组与HG+ghrelin+NC-siGHSR-1a组Bax蛋白和Bcl-2蛋白表达差异无统计学意义(均为P>0.05)外,其余各组间HRMECs中Bax和Bcl-2蛋白表达比较差异均有统计学意义(均为P<0.05)(图3),这表明ghrelin-GHSR-1a降低了高糖条件下HRMECs中的Bax蛋白的相对表达水平,增加了Bcl-2蛋白的相对表达水平。

A:NC组;B:HG组;C:HG+ghrelin组;D:HG+ghrelin+NC-siGHSR-1a组;E:HG+ghrelin+NC-siGHSR-1a组。图3 Western blot检测各组HRMECs中凋亡蛋白Bax和Bcl-2的相对表达量
3 讨论
Kojima等[6]的研究首次在大鼠和人胃黏膜及下丘脑弓状核的内分泌细胞中发现了一种新的脑肠肽激素ghrelin,该激素可与G蛋白偶联受体GHSR结合,调节生长激素(GH)的释放。已有研究证实,ghrelin具有增加摄食量、影响睡眠节律、调节胰腺内分泌功能、调节葡萄糖代谢、减少脂肪利用等一系列功能,最终实现机体能量正平衡[2]。Ghrelin由28个氨基酸残基组成,相对分子质量为3314[6]。ghrelin通过内分泌或旁分泌形式作用于GHSR,该受体由7个跨膜α螺旋组成,广泛分布于中枢神经系统和周围组织[7],并以1a型和1b型两种形式存在,GHSR-1a是目前已知的唯一能与ghrelin结合介导其代谢效应的受体[8]。已有报道称ghrelin和GHSR-1a在人眼睫状体色素上皮、视网膜色素上皮(RPE)和虹膜中表达[9],在房水[10]中也有表达,这提示ghrelin在眼的生理功能中起调节作用,与眼内疾病的发生密切相关。为了明确ghrelin-GHSR-1a系统对HRMECs的影响,本研究观察了GHSR-1a在HRMECs中的表达情况,免疫荧光检测结果显示,GHSR-1a在HRMECs中有表达,与大鼠视网膜血管内皮细胞的结果相似[11]。同时,高糖条件下,HRMECs中GHSR-1a的表达明显低于正常对照组,提示ghrelin-GHSR-1a信号下调可能与糖尿病视网膜血管损伤有关。
ghrelin-GHSR-1a在眼部组织中的表达和作用已受到关注,靶向干预该系统在包括青光眼[10]、白内障[12]、早产儿视网膜病变[11]等在内的多种眼科疾病中可能发挥一定的治疗作用。然而,ghrelin对DR是否也发挥有益作用还不清楚。在本研究中,为了明确ghrelin与其受体GHSR-1a结合的保护作用,我们利用siRNA阻断受体,观察了ghrelin对HRMECs的细胞活力和细胞凋亡的影响,结果显示,阻断GHSR-1a后,ghrelin对HRMECs的细胞活力的促进作用显著降低,对细胞凋亡的抑制作用也明显减弱。此外,本研究还观察了关键凋亡蛋白Bax和Bcl-2的表达情况。结果与细胞凋亡率一致,HG组中Bax蛋白表达水平高于对照组,而Bcl-2蛋白表达水平低于对照组。外源ghrelin抑制Bax蛋白的表达,促进Bcl-2蛋白的表达。阻断GHSR-1a后,ghrelin对这两种蛋白表达的影响显著降低。这些结果表明,ghrelin在高糖条件下能够促进HRMECs的细胞活力,并抑制细胞凋亡,而且通过其受体GHSR-1a发挥这些作用,提示ghrelin-GHSR-1a系统对DR患者的血管损伤可能具有保护作用。与本研究结果类似,对人心脏微血管内皮细胞、脐静脉内皮细胞和真皮微血管内皮细胞的研究认为ghrelin-GHSR-1a对细胞生存具有保护作用[13-15],但也有研究发现ghrelin对人脐静脉内皮细胞的增殖和大鼠脑微血管内皮细胞增殖发挥抑制作用[16-17]。以上结果存在差异可能与细胞所处的病理环境不同有关。
临床研究发现,糖尿病肾病患者血浆中ghrelin水平明显低于无糖尿病并发症的患者,提示ghrelin在内皮细胞功能中发挥重要作用,在动脉粥样硬化、微血管疾病等糖尿病并发症中发挥保护作用[18]。在糖尿病小鼠模型中发现内源性ghrelin表达下调,补充外源性ghrelin可明显增强其下肢动脉灌注,改善下肢缺血,提示ghrelin是一种治疗外周动脉疾病的潜在药物[19]。本研究结果提示,ghrelin可以通过保护高糖环境下的视网膜微血管内皮细胞功能,从而在DR的防治中发挥有益作用,但其详细的作用机制仍有待于进一步的研究。本研究仅在体外观察了ghrelin对HRMECs增殖和凋亡的影响,对细胞的功能是否产生影响还有待进一步研究。如像在其他糖尿病微血管并发症中的效应一样,ghrelin-GHSR-1a是否对DR的疾病进展发挥有益作用还不得而知,有必要通过体内实验阐明ghrelin在DR中的保护作用及其分子机制。
