掺杂锂电池正极材料的第一性原理研究
2022-04-06霍德璇陈许敏胡旖航
叶 盼,霍德璇,陈许敏,程 杰,胡旖航
(杭州电子科技大学电子信息学院,浙江 杭州 310018)
0 引 言
锂离子电池具有价格低、环境污染小、充放电容量高、性能稳定等优点,在电子产品、汽车、能源等领域应用广泛[1-2]。近年来,锂电池的研究主要聚焦在负极材料和电解质材料上,但正极材料的研究仍旧缺乏[3]。2005年,Nyten等[4]成功制备了Li2FeSiO4,实验测试的充电容量为165 mAh/g,充电循环几次后,充电容量仍能保持在140 mAh/g左右。二锂正硅酸盐氧化物Li2MnSiO4和Li2FeSiO4拥有类似的性质,是一种典型的锂电池正极材料,已有研究表明,其比容量可以达到333 mAh/g[5],Li2MnSiO4因其高容量特性成为锂电池正极材料研究的热门材料[6-7]。但是,Li2MnSiO4的导电性能和循环性能不理想,严重制约了该材料的应用推广潜能。目前,改善其导电率、提升循环性能的方法主要包括碳包覆和金属离子掺杂等手段[8]。Aravindan等[9]制备出Li2MnSiO4/C复合正极材料,由42%的碳组成的复合电极的导电性得到提高,在室温下表现出非常稳定的放电容量140 mAh/g,并能稳定循环40次。Moriya等[10]以葡萄糖为碳源,采用喷雾热解法制备了Li2MnSiO4纳米颗粒与碳的杂化结构,其容量约为200 mAh/g且能稳定循环,稳定的循环性能归功于10~20 nm纳米杂化颗粒Li2MnSiO4的原位包覆碳相,实现了均匀脱锂/锂化,提供了较高的放电容量和库仑效率。还可以使用离子掺杂技术来提升锂电池正极材料的循环和导电性能,例如,董悦[11]采用固相法在Li2MnSiO4的Mn位分别掺入Ti,Zn,研究其电化学性能的改变,在相同条件下,掺杂比为3%时,Ti掺杂结构的首次放电量显著提升,达到209.5 mAh/g,但Zn掺杂材料的放电能力改善有限。马东玮[12]为进一步提升碳包覆的Li2MnSiO4/C材料电化学性能,在碳包覆后的Li2MnSiO4的Mn位掺入Ce,Ni元素,研究发现,当掺杂Ce的比例为3%时,首次放电比容量达到210 mAh/g,库伦效率接近90%,循环50次后,放电容量保持在90 mAh/g;Ni掺杂样品首次放电容量达到175 mAh/g。研究表明,金属离子掺杂可以同时改善材料的循环和倍率性能,显著提高了材料的放电比容量,是一种提升锂电池正极材料性能的有效手段。对Li2MnSiO4进行金属离子掺杂可以提升其导电性和循环性[13]。目前,从理论角度对Li2MnSiO4进行离子掺杂改性的研究是一种高效可行的方法,掺杂的Li2MnSiO4逐渐成为人们研究高性能锂电池的重要对象之一[14]。本文构建了Ni,Ti,Ce替位掺杂Mn的LixMnyM1-ySiO4(x=2,1,0;y=0.5,1;M=Ni,Ti,Ce)结构,采用第一性原理从结构稳定性、导电性、脱锂特性等理论角度寻找一种可靠掺杂构型,为锂电池正极材料的掺杂改性研究提供参考。
1 本文计算方法和模型
1.1 计算方法
在自旋极化状态下,本文采用基于密度泛函理论的第一性原理的投影增广波方法[15],计算离子掺杂的Li2MnSiO4材料的形成能,并分析其脱锂结构稳定性和电子态密度。其中,交换关联势使用Perdew-Burke-Ernzerhof(PBE)参数化中的广义梯度近似(Generalized Gradient Approximation, GGA)[16]。电子自洽过程中,能量的收敛标准设为10-5eV,平面波展开的截断能选取500 eV,采用Monkhorst-Pack型K点网格在布里渊区积分。考虑到Li2MnSiO4掺杂体系中Ce,Mn,Ni,Ti的电子的强关联相互作用,采用Anisimov等[17]提出的GGA+U方法,对其中Ce的4f,5d电子和Mn,Ni的3d电子采用Ueff=5.5 eV[18-19]进行修正,对Ti的3d电子采用Ueff=5.0 eV[20]进行修正。
1.2 计算模型
Li2MnSiO4的晶胞结构如图1(a)所示,其中晶格常数a=0.631 986 nm,b=0.533 067 nm,c=0.494 637 nm,α=β=γ=90°。该晶体结构属于第31号空间群,具体为Pmn21,晶胞包含4个Li,2个Mn,2个Si,8个O。结构中Mn与4个O连接构成[MnO4]四面体,Si与4个O连接构成四面体,[MnO4]四面体与[SiO4]四面体共用顶角O离子周期性交替排列,Li离子位于[MnO4]和[SiO4]层间四面体位[21]。
Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)是在Mn位以50%比例替位掺杂的构型,M元素掺入Mn2位形成构型A,M元素掺入Mn1位形成构型B,2种掺杂构型分别如图1(b)和(c)所示。选取能量低的结构作为稳定掺杂构型进行几何结构优化、态密度计算。根据晶体结构的对称性可知,未掺杂结构Li2MnSiO4和掺杂结构Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)根据脱锂位置的不同存在3种不同的一次脱锂结构:(1)脱去Li1,Li2的结构为构型Ⅰ;(2)脱去Li1,Li3的结构为构型Ⅱ;(3)脱去Li1,Li4的结构为构型Ⅲ。选取3种构型中能量最低的结构作为稳定脱锂结构,并以此结构进行态密度的计算。二次脱锂即Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)将锂离子全部脱去形成脱锂结构MnSiO4和Mn0.5M0.5SiO4(M=Ni,Ti,Ce),对其进行结构优化和态密度计算。
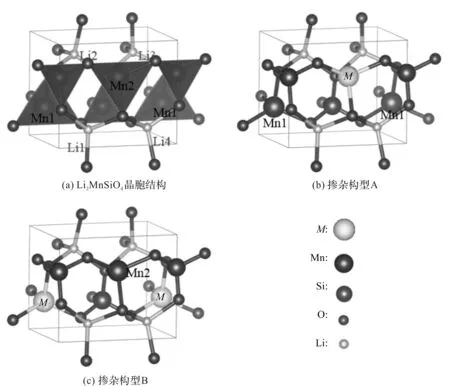
图1 Li2MnSiO4晶胞结构及其掺杂构型
2 计算结果与分析
2.1 几何结构优化分析
对Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)进行结构优化,得到各自的晶格常数、晶胞体积、体系能量如表1所示。
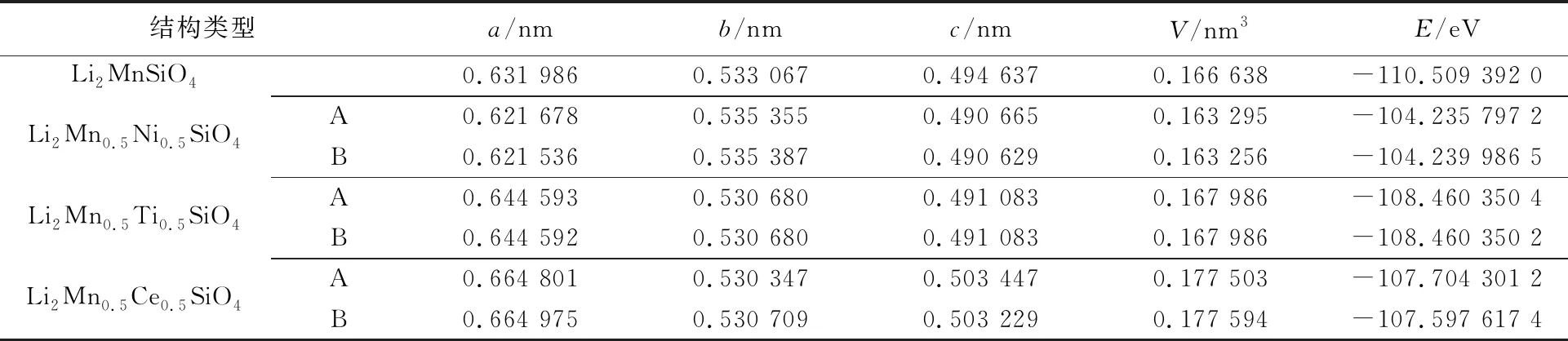
表1 全锂相Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)晶胞参数和体系能量
从表1可以看出,在全锂相结构中,采用GGA+U方法结构优化得到的Li2MnSiO4晶格常数与文献[22-23]的实验值和其他第一性原理计算值[24]基本一致。对于掺杂构型Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce),构型A和B中能量低的构型即为稳定掺杂结构。比较表1中掺杂结构Li2Mn0.5Ni0.5SiO4,Li2Mn0.5Ti0.5SiO4,Li2Mn0.5Ce0.5SiO4各自掺杂构型的能量可以看出,三者的稳定掺杂构型分别为构型B、构型A和构型A。相比于Li2Mn2SiO4,掺杂结构Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)的晶格常数a都有所增加,b和c基本不变;Li2Mn0.5Ni0.5SiO4的晶胞体积在减小,Li2Mn0.5Ni0.5SiO4和Li2Mn0.5Ni0.5SiO4的晶胞体积增大;掺杂后体系能量都有所增加。
对全锂相结构Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)的能量最低构型分别进行脱锂结构计算,得到脱锂结构LiMnSiO4和LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)的晶格常数、晶胞体积、体系能量如表2所示。
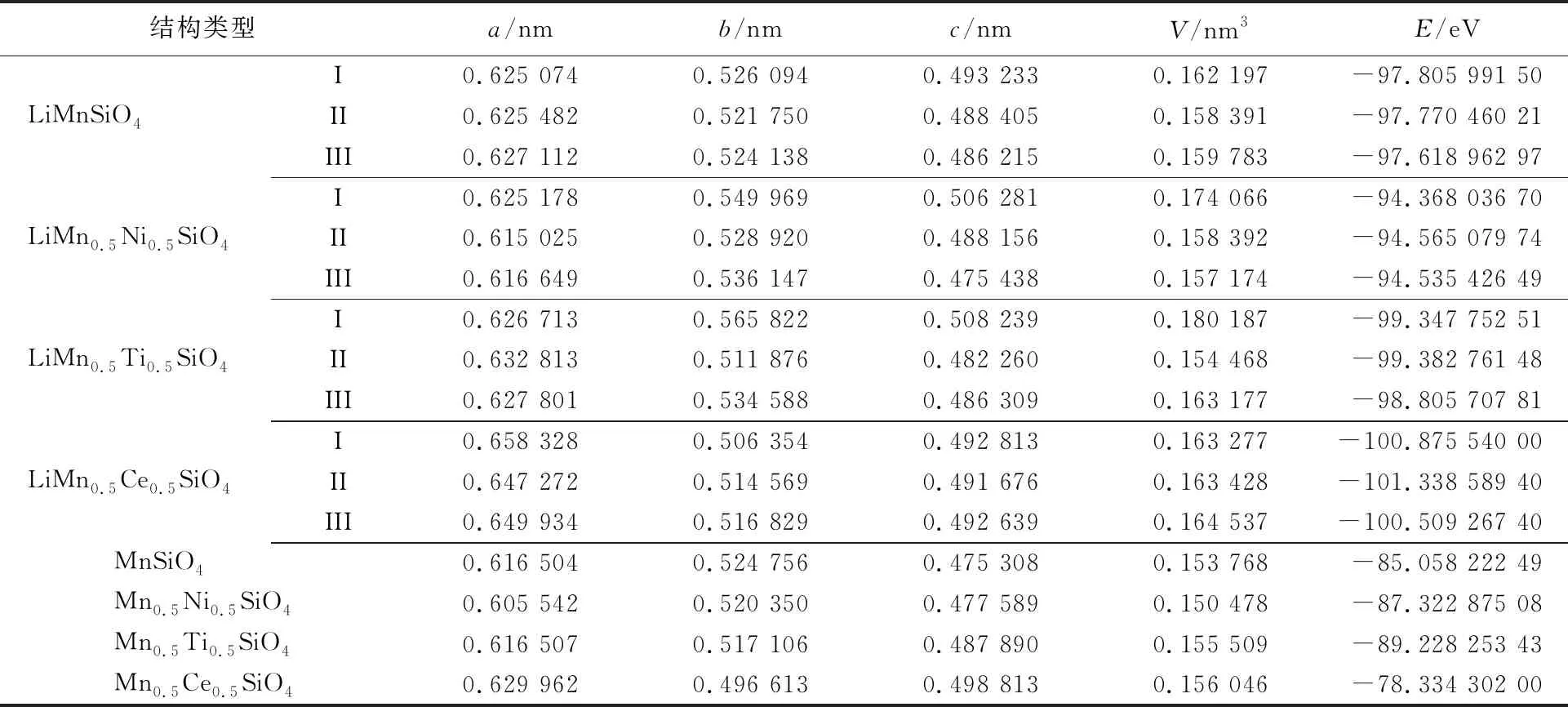
表2 一次脱锂相结构、二次脱锂相结构的晶胞参数和体系总能量
一次脱锂结构中,LiMnSiO4的最低能量的稳定构型为I型,掺杂结构LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)稳定构型均为II型。二次脱锂结构中,各个构型的晶格常数、晶胞体积、体系能量都较一次脱锂结构发生明显变化,晶格常数、晶胞体积减小,体系能量增加。
一次脱锂相结构的形成反应式如下[7]:
(1)
一次脱锂相结构的形成能计算如下[6,25]:
(2)
式中,y=1或0.5,E表示对应结构的能量,Ef表示LiMnSiO4和LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)的形成能。使用表1和表2中全锂相结构、一次脱锂相结构和二次脱锂相结构的体系能量代入式(2),计算得到一次脱锂结构LiMnSiO4和LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)的形成能分别为-0.251 410 675 eV,-3.277 935 49 eV,-1.491 14876 eV,-2.872 312075 eV。掺杂后的形成能均小于掺杂前的形成能,说明Li2MnSiO4掺杂后,增加了其一次脱锂结构的稳定性,其中掺入Ni的一次脱锂结构最稳定。
在电循环的过程中,Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)的体积变化起着重要作用,体积变化小,有利于电极材料的充放电循环[26]。从表1和表2中晶胞体积的变化可以看出,Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)在脱锂过程中,体积逐渐减小,一次脱锂后体积变化量分别为-2.66%,-2.98%,-8.05%和-7.93%;二次脱锂后体积变化量分别为-7.72%,-7.82%,-7.42%和-12.10%。综上分析,可以看出,Li2MnSiO4掺杂Ti和Ce后,在脱锂过程的体积变化明显,不利于充放电循环;Li2MnSiO4掺杂Ni后,脱锂过程中的体积变化与未掺杂结构基本一致。
各个体系脱锂前后的Mn—O,M—O,Si—O键长变化和平均键长如表3所示。
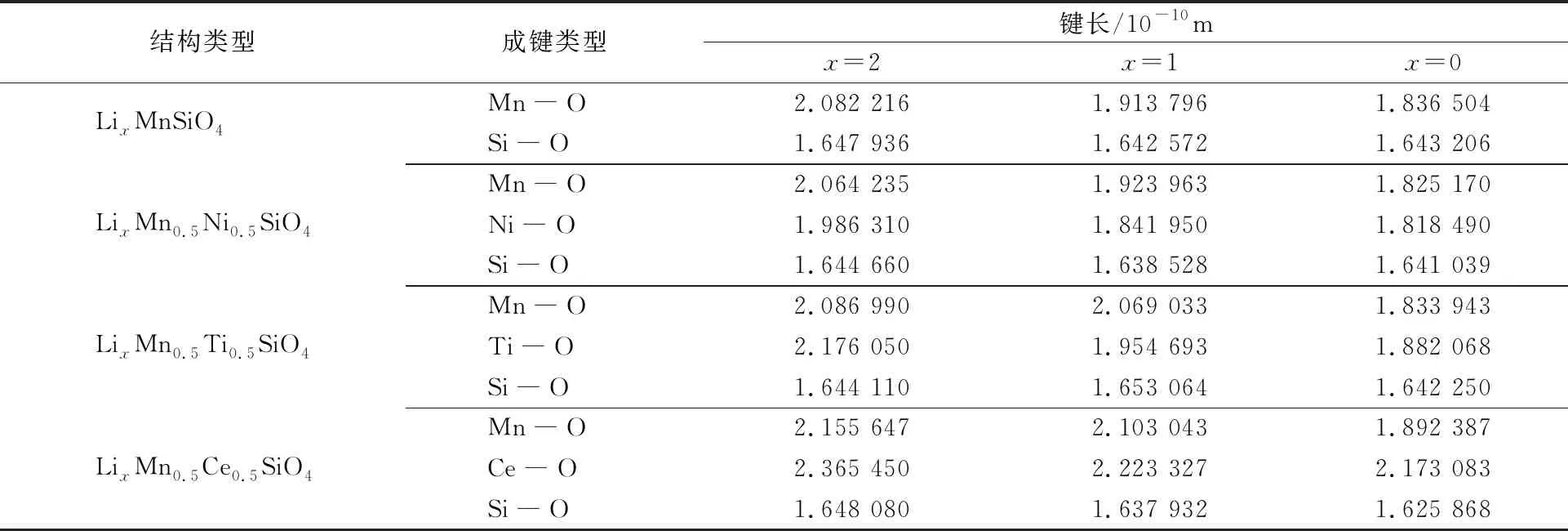
表3 LixMn0.5M0.5SiO4(M=Ni,Ti,Ce)和LixMnSiO4的Mn—O,M—O,Si—O平均键长
从表3可以看出,Si—O键长在脱锂过程中基本保持不变,在材料的电循环过程中,[SiO4]四面体保持稳定,并维持体系结构的稳定性[6]。随着脱锂过程的进行,Mn—O,M—O的键长逐渐减小,结构对称性逐渐发生改变,结构中的[MnO4]四面体、[MO4]四面体也随着改变发生变形,从而影响结构的体积变化。M—O(Ni,Ti,Ce)键长在一次脱锂后的变化比例分别为-7.27%,10.20%,-6.01%;二次脱锂后键长变化程度分别为-8.45%,-13.50%,-8.13%。
键长变化顺序为Ti—O>Ni—O>Ce—O,虽然Ce—O键长在脱锂过程中的变化比例略小于Ni—O键长的变化比例,但在Li2Mn0.5Ce0.5SiO4体系中,Ce—O键长与Mn—O键长差距明显,[MnO4]四面体和[CeO4]四面体严重不对称,晶体结构畸变,导致在脱锂过程中,Li2Mn0.5Ce0.5SiO4的体积变化比Li2Mn0.5Ni0.5SiO4更为剧烈[27]。因此,Ni掺杂体系在脱锂过程键长和体积上的稳定性能比掺入Ti和Ce更优越,更有利于提高正极材料的电循环性能。
2.2 态密度和导电性
Li2MnSiO4自身的导电性能并不理想,通过在Mn位掺入金属离子可以改善其电子结构,从而改善Li2MnSiO4自身的电导率问题。Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)自旋向下的态密度图如图2所示,其中正值表示自旋向上的态密度,负值表示自旋向下的态密度,0 eV处的实线EF表示费米能级。图2(a)为Li2MnSiO4的态密度图,其价带顶处态密度主要由Mn的3d轨道和O的2P轨道构成,价带顶的位置被Mn—O的自旋耦合作用决定,导带处的态密度主要由Mn的3d轨道电子态密度构成。从图2(a)可以看出,Li2MnSiO4禁带宽度为3.44 eV,与文献[6-7]得到的3.44 eV一致。
图2(b)—图2(d)分别为掺杂后Li2Mn0.5Ni0.5SiO4,Li2Mn0.5Ti0.5SiO4,Li2Mn0.5Ce0.5SiO4的态密度图。图2(b)中,Ni掺杂后,Ni的3d轨道上deg轨道完全排满,但其d2g轨道上只排布了自旋向上状态的2个电子,自旋向上的状态电子已经穿过费米面,这是直接导致其导电性变好的原因。对比Ni掺杂前态密度图2(a)可以看出,图2(b)中的Li2Mn0.5Ni0.5SiO4体系的价带顶位置的态密度在Ni—O键自旋耦合作用下越过费米面,体系呈现半金属性。图2(c)中,Ti掺杂后,由于Ti的3d轨道存在2个自旋向上的电子,费米面两侧出现Ti的自旋向上态密度,使得总态密度带隙比Li2MnSiO4的带隙明显减小,禁带宽度为0.54 eV,体系呈现半导体性质。图2(d)中,Ce掺杂后,Ce的5d,4f自旋向上的电子态密度和O的2p电子态密度穿过费米面,使得总态密度的导带底位置跨过费米面,体系呈现金属性。综上分析表明,掺杂Ni,Ti和Ce均能改善Li2MnSiO4的导电性能。
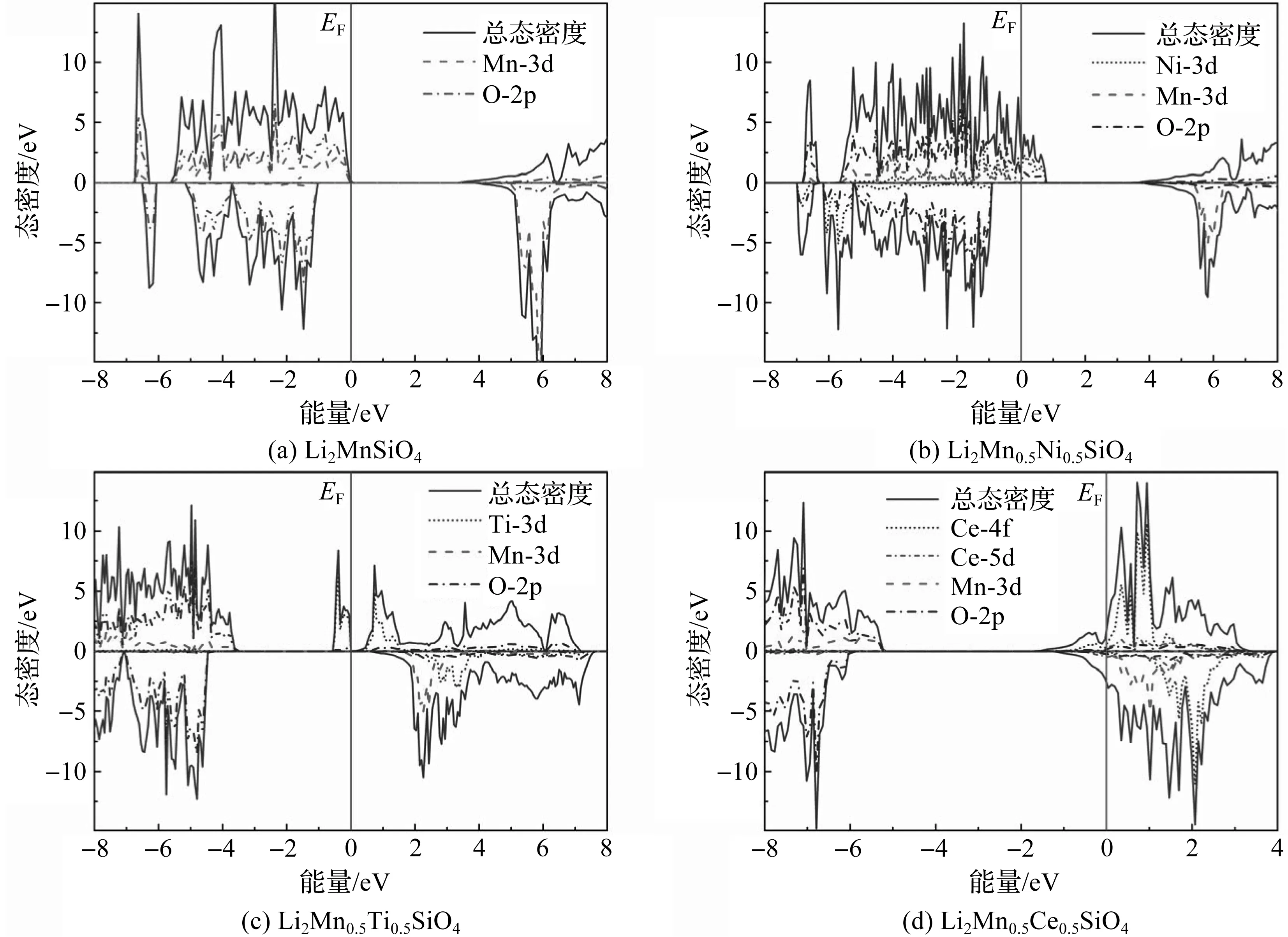
图2 全锂相结构Li2MnSiO4和Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)的总态密度及分态密度
一次脱锂结构LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)和二次脱锂结构Mn0.5M0.5SiO4(M=Ni,Ti,Ce)的态密度分别如图3、图4所示。充电过程中,首先Li2MnSiO4的一个锂离子从正极材料中脱离,通过电解液迁移嵌入负极材料,同时释放电子,Li2MnSiO4的Mn2+离子被氧化成LiMnSiO4的Mn3+离子[28]。Mn的3d轨道从5个电子丢失1个电子变成3d4,LiMnSiO4呈现半导体特性,其态密度图3(a)显示的带隙为0.13 eV。随着第2个锂离子的脱去,Mn3+被继续氧化成Mn4+,3d轨道继续丢失1个电子形成3d3,使得图4(a)中MnSiO4自旋向上的态密度穿过费米面,MnSiO4呈现半金属性。
图3(b)—图3(d)分别是掺杂体系一次脱锂后LiMn0.5Ni0.5SiO4,LiMn0.5Ti0.5SiO4,LiMn0.5Ce0.5SiO4的态密度图,可以看出,费米面右侧的导带位置主要由掺杂原子和O原子的自旋轨道耦合决定,且均呈现半导体特性,带隙分别为0.396 5 eV,1.546 4 eV,1.362 3 eV。图4(b)—图4(d)分别是掺杂体系二次脱锂后Mn0.5Ni0.5SiO4,Mn0.5Ti0.5SiO4,Mn0.5Ce0.5SiO4的态密度图,可以看出,自旋向上的态密度均穿过了费米面,呈现半金属性质,且越过费米面的态密度主要由Mn的3d和O的2d电子态密度组成。
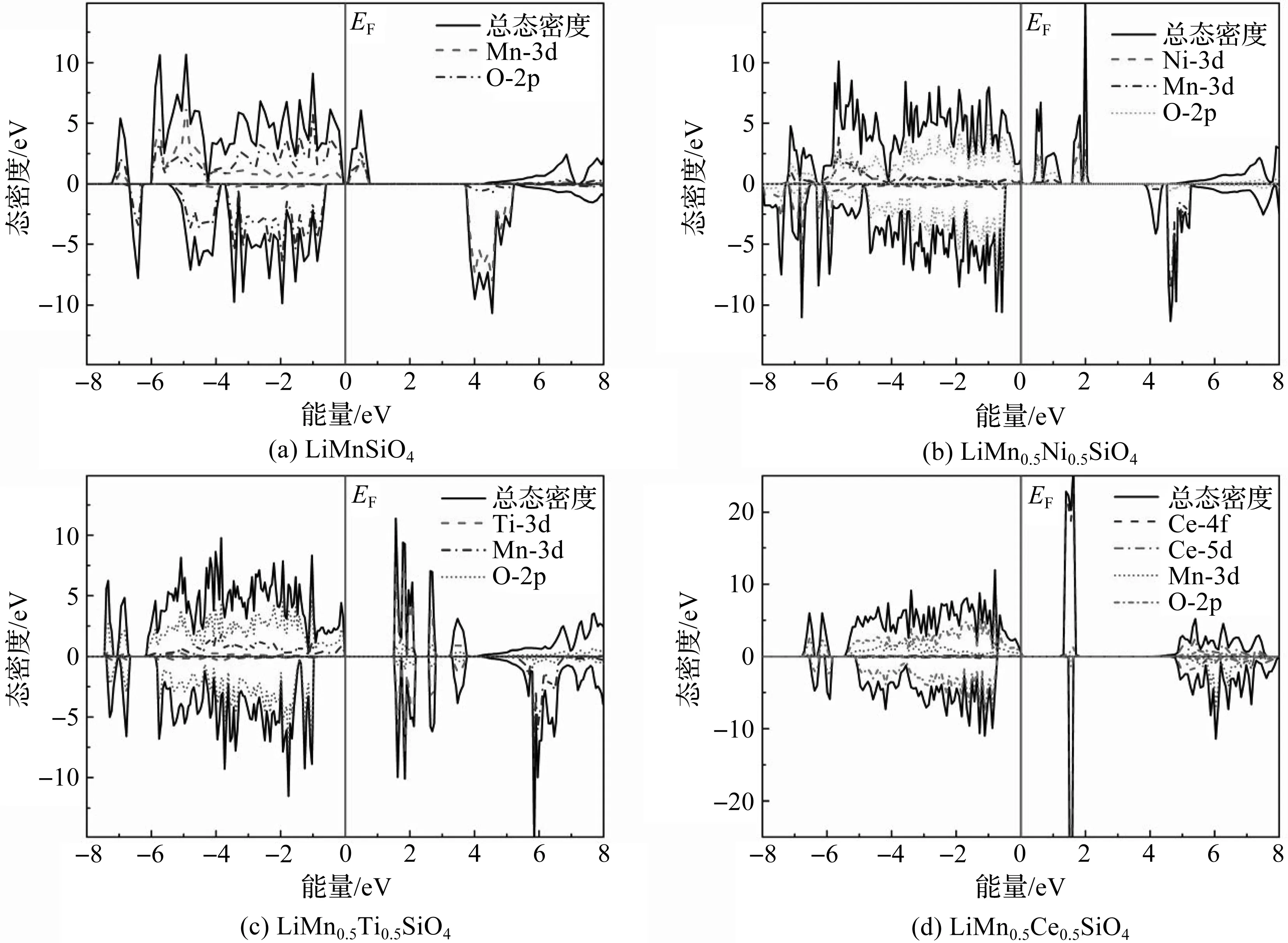
图3 一次脱锂结构LiMnSiO4和LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)的总态密度及分态密度
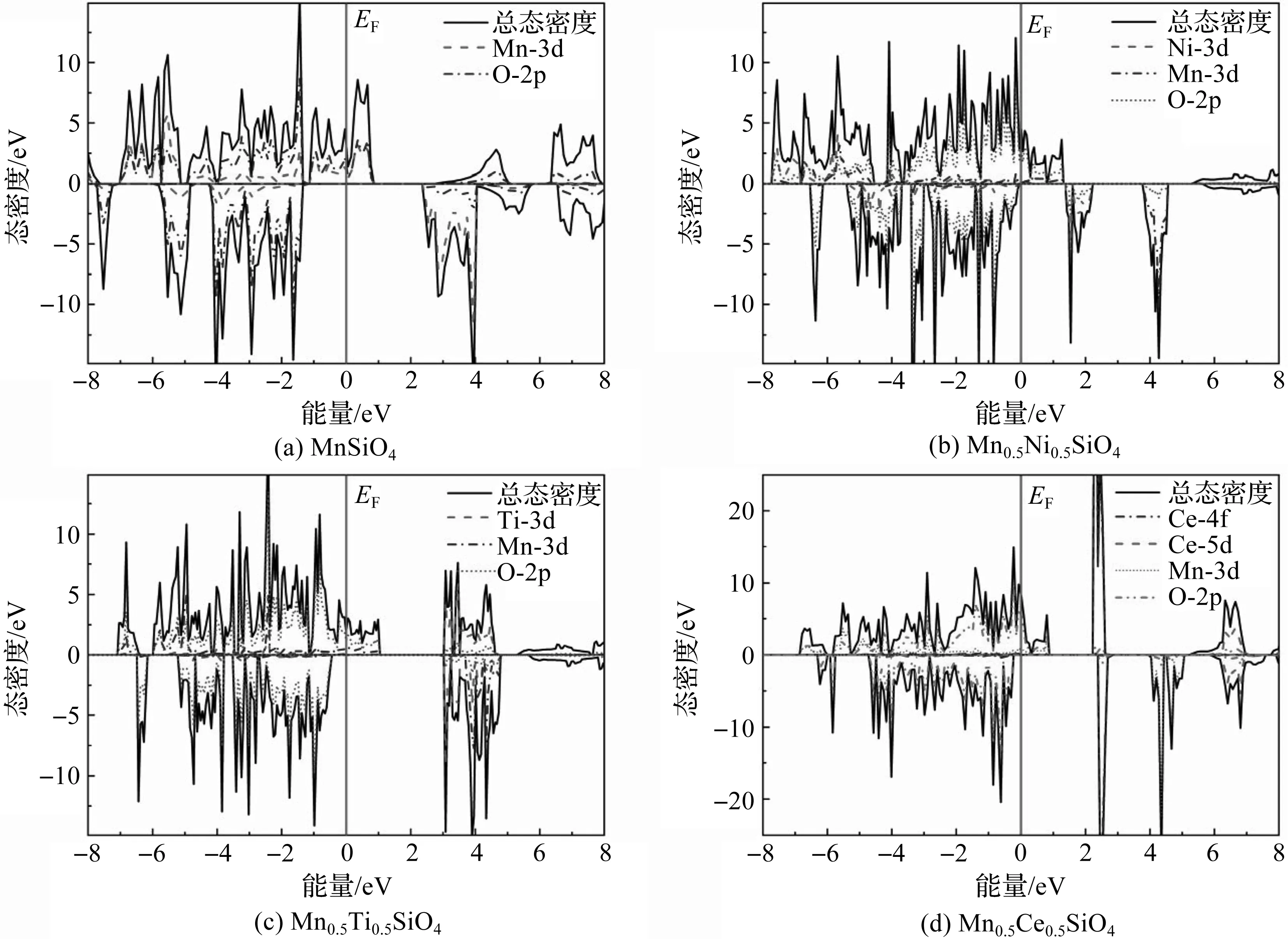
图4 二次脱锂结构MnSiO4和Mn0.5M0.5SiO4(M=Ni,Ti,Ce)的总态密度及分态密度
从图2—图4中掺杂前后的态密度可以看出,Li2MnSiO4在掺入Ni,Ti,Ce后,导电性能均有不同程度的提升,其中Ni掺杂呈现半金属性,Ti掺杂带隙减小,Ce掺杂后呈现金属性;在脱锂过程中,一次脱锂结构的态密度均显示出半导体性质,禁带宽度大小顺序为LiMnSiO4>LiMn0.5Ni0.5SiO4>LiMn0.5Ce0.5SiO4>LiMn0.5Ti0.5SiO4;二次脱锂相结构的自旋向上态密度均穿过费米面,呈现半金属特性。
3 结束语
本文通过建立Li2MnSiO4结构和Mn位掺杂后Li2Mn0.5M0.5SiO4(M=Ni,Ti,Ce)结构,运用第一性原理,在自旋极化状态下对其进行几何结构优化和电子态密度计算,并按照能量最低原则比较不同掺杂构型和脱锂构型的稳定性。计算结果表明,Li2MnSiO4在Mn位掺杂Ni,Ti,Ce后,禁带宽度明显减小,分别呈现半金属性质、半导体性质和金属性质,导电性能提升;一次脱锂结构LiMn0.5M0.5SiO4(M=Ni,Ti,Ce)具有比LiMnSiO4更低的形成能和更好的结构稳定性;但掺杂并没有降低Li2MnSiO4在脱锂过程中体积减小的幅度,充放电循环能力未得到提升。因此,Ni,Ti,Ce掺杂能有效改善Li2MnSiO4的导电性及其一次脱锂结构的稳定性。后续将针对如何提升Li2MnSiO4电循环能力展开进一步研究。
