继代次数对天津七里海野生珍稀苇蘑菌种的活性影响*
2022-04-06刘西周
刘西周
(天津师范大学生命科学学院,天津 300387)
天津七里海位于中国天津市宁河区,属于典型滨海地带沼泽湿地类型,是具有古代中国海岸地貌特征的大型湿地之一。七里海天然湿地自然生态资源多样性丰富,但由于环境变化和人类活动的双重影响,如今七里海沿岸的湿地正在严重萎缩[1-2]。近年来,由于自然因素和无节制地采摘等人为因素,该域内野生苇蘑的产量和品质逐年下降,野生苇蘑几乎绝迹。
为保护苇蘑种质资源,从七里海地区采集到野生苇蘑菌株,经初步鉴定其为拟蜡伞科(Hygrophoropsidaceae)拟蜡伞属 (Hygrophoropsis)。经查阅国内外相关资料,目前有关苇蘑的报道有苇蘑多糖提取工艺研究[3]、抗氧化作用研究[4]、分类学研究[5]、液体培养基优化[6-8]、人工驯化等[9],但尚未发现其继代次数对菌种活性影响的相关报道。苇蘑作为天津七里海地区特色的菌物资源,对其进行驯化、栽培研究具有极大的应用前景,且生态效益和经济效益显著。因此,通过探究苇蘑不同继代次数对菌种活性的影响,为保护菌种资源、恢复天津七里海湿地生态系统物种多样性提供科学依据,同时对苇蘑的进一步研究以及实现苇蘑合理、有序地开发和利用具有重要的意义。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
苇蘑(Hygrophoropsis sp.)菌株,保藏于天津师范大学蕈菌研究所。
1.1.2 培养基及试剂
1)PDA综合培养基:马铃薯200 g、葡萄糖20 g、VB110 mg、硫酸镁1.5 g、磷酸二氢钾3 g、琼脂20 g,蒸馏水1 000 mL,pH自然。
2)培养料配方:稻草52%、麦粒24%、芦苇腐殖质24%[9]。
3)染色剂:吉姆萨染色液。
1.2 试验方法
1.2.1 苇蘑菌种继代培养
苇蘑子实体组织分离获得的菌种标记为第1代,接种到PDA综合培养基上,于25℃培养。选取苇蘑菌落边缘生长部位,使用无菌枪头打孔,接种至PDA综合培养基上,进行继代培养。每代接种8个平板,连续从第1代传至第10代。
1.2.2 栽培种制作
选取2 cm~4 cm稻草段,浸水12 h进行预湿,然后沥干水分;麦粒浸泡24 h后预煮至透明无白芯;选择无杂质的芦苇腐殖质,过筛(孔径3 mm)备用。
按培养料配方进行称料,将预湿后的稻草、煮好的麦粒、芦苇腐殖质进行混匀拌料,调整培养料含水量约为56%;然后装入聚丙烯袋(300 mm×150 mm×0.05 mm),湿重150 g,于121℃灭菌2 h;冷却后接种,每代接20袋。
1.2.3 苇蘑菌落特征的比较与分析
1)菌落直径大小
自每代菌种转接至新平板培养开始,每隔1天用卡尺按“十”字交叉法测出固体培养基中菌落直径,并拍照记录;绘制各代菌落生长折线图,比较和分析不同继代次数菌落大小的差异与成因。
2)菌丝稀疏程度比较与分析
自每一代菌种转接至新平板培养开始,观察菌丝稀疏程度以及老化(褐化)出现时间,并拍照记录。
3)菌种老化(褐化)时间比较与分析
观察、记录菌落出现色素沉积(褐化)的时间并拍照,比较和分析不同继代次数菌种老化程度与形成原因。
4)菌种退化程度与分析
观察记录菌落出现停止生长与退行性生长的时间并拍照。5)不同继代次数苇蘑菌种菌丝特征比较与分析观察、记录不同继代次数苇蘑菌种菌丝特征,分析形成原因。
1.2.4 不同继代次数苇蘑栽培种生长情况对比
无菌条件下分别将不同继代次数的菌种进行栽培种培养基接种,接种块为1 cm2,于25℃黑暗条件培养;观察并记录不同菌种萌发与菌丝体长势,满袋与否及抗杂菌能力。
2 结果与分析
2.1 菌落直径大小比较与分析
第1代~第8代苇蘑菌落生长变化曲线见图1。

图1 不同继代次数苇蘑菌落生长曲线Fig.1 Growth curve of the Hygrophoropsis sp.colony with different subculture times
如图1所示,第1代~第7代苇蘑菌种菌落总体生长趋势在0~19 d基本趋同,从第21天起逐渐分化,菌落直径持续增大;前6代在传代27天后,所有苇蘑菌落生长迟缓;第8代苇蘑较前7代菌落生长速度极其缓慢,到第11天苇蘑菌落生长明显变慢,几乎停滞。前3代培养37天后苇蘑菌落不生长,平均菌落大小(直径)停留在7.85 cm,由此可见,随着继代次数增加,前6代菌落生长接近正常,至第8代菌落生长速度明显减慢,培养至第11天基本停止生长,说明连续传代至第8代时,在营养与其他条件满足的前提下,苇蘑菌种出现断崖式退化,因此在苇蘑批量化栽培过程中需要严格控制传代次数,以减少不必要的菌种退化。
2.2 菌丝稀疏程度的比较与分析
对比不同继代次数苇蘑菌种培养13 d的菌丝生长情况,见图2。
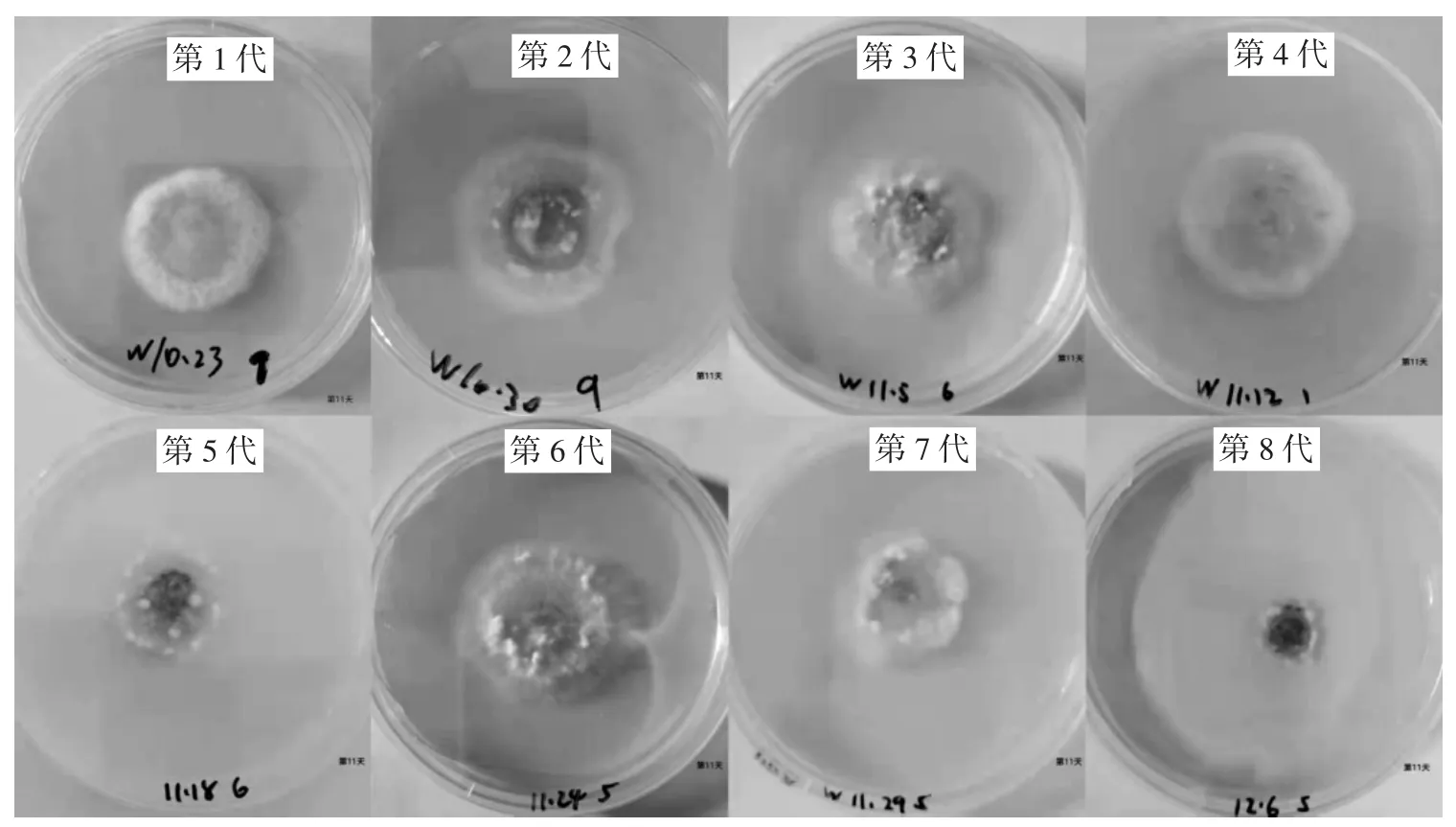
图2 不同继代次数苇蘑菌种培养13 d的菌落生长情况Fig.2 Colony growth of the Hygrophoropsis sp.cultured for 13 days with different subculture times
如图2所示,其菌丝疏密程度随继代次数呈逐渐下降趋势。第1代苇蘑菌丝最密集;第3代苇蘑菌丝密度开始降低;直至第8代菌丝稀疏最明显,且不再生长,出现断崖式改变。
不同继代次数苇蘑的菌丝体密集程度变化见表1。

表1 不同继代次数苇蘑的菌丝体密集程度Tab.1 The density of mycelium of the Hygrophoropsis sp.with different subculture times
如表1所示,随着继代次数增加,菌丝体密集度随之降低,前3代苇蘑菌丝体较密集,且在培养全过程中变化不大;第4代~第7代菌丝体密集程度降低;从第6代开始,菌丝体密集程度明显下降,直至第8代最明显;第8代菌丝体在培养5天后变得稀疏,且相比其他继代次数,从菌丝体稀疏度和菌丝体呈现稀疏时间都比其他代数提前。正常苇蘑菌种一般情况菌丝体疏密度不会有太大变化,菌丝体稀疏程度与生物量相关,一定程度上反应了菌种活性,可见第8代继代菌种出现活性骤降,退化明显,且不可恢复。
2.3 菌种老化时间的比较与分析
不同继代次数苇蘑菌种老化时间及生长情况,见图3。

图3 不同继代次数下菌种首次出现菌落老化时间Fig.3 The colony aging time appeared for the first time under different subculture times
如图3所示,第8代苇蘑菌种与其他7代差异最为明显,菌种生长速度明显变慢,且在第6天有些菌落变为黄褐色,第9天苇蘑菌落全部变为黑褐色,由于菌丝分泌的褐色素,菌落周围培养基变为黄色,不同继代次数苇蘑菌丝体老化程度记录见表2。
从表2可知,培养9 d~13 d苇蘑菌种老化程度随继代次数逐渐增强。第3代苇蘑菌种老化速度明显变快,且比第4代~第7代的菌丝褐变程度更加严重,第3代苇蘑菌种中后期菌落边缘菌丝体聚集成球状;第3代苇蘑菌落后期彻底变为黑褐色,PDA综合培养基内看不到白色菌丝体,苇蘑菌落未长满培养基,PDA综合培养基变成深黄色。第4代~第7代苇蘑菌落生长状况较第3代而言老化速度变慢。每一代菌种培养4 d,菌落中央就开始呈现浅黄色。总体来看,前4代菌种老化均出现在培养25 d~27 d,随着继代次数增加老化程度出现时间越来越早,至第8代培养约9 d即出现大面积褐化现象,菌落不再生长,培养至第8代骤然出现菌种老化。
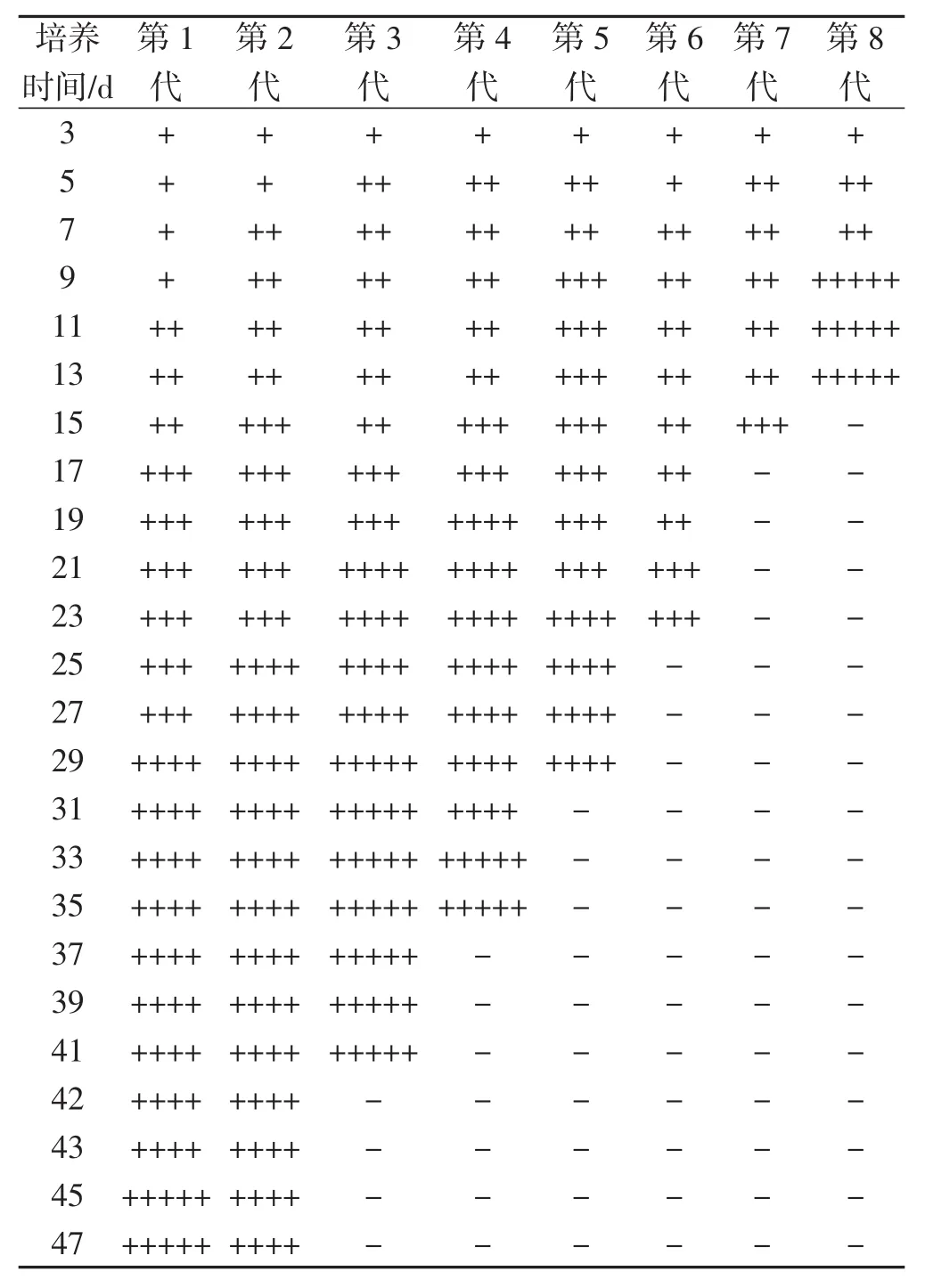
表2 不同继代次数代苇蘑菌种老化程度Tab.2 The aging degree of Hygrophoropsis sp.culture with different subculture times
2.4 不同继代次数苇蘑菌种退化程度与分析
以第1代苇蘑为例,不同培养时间的菌落特征见图4。
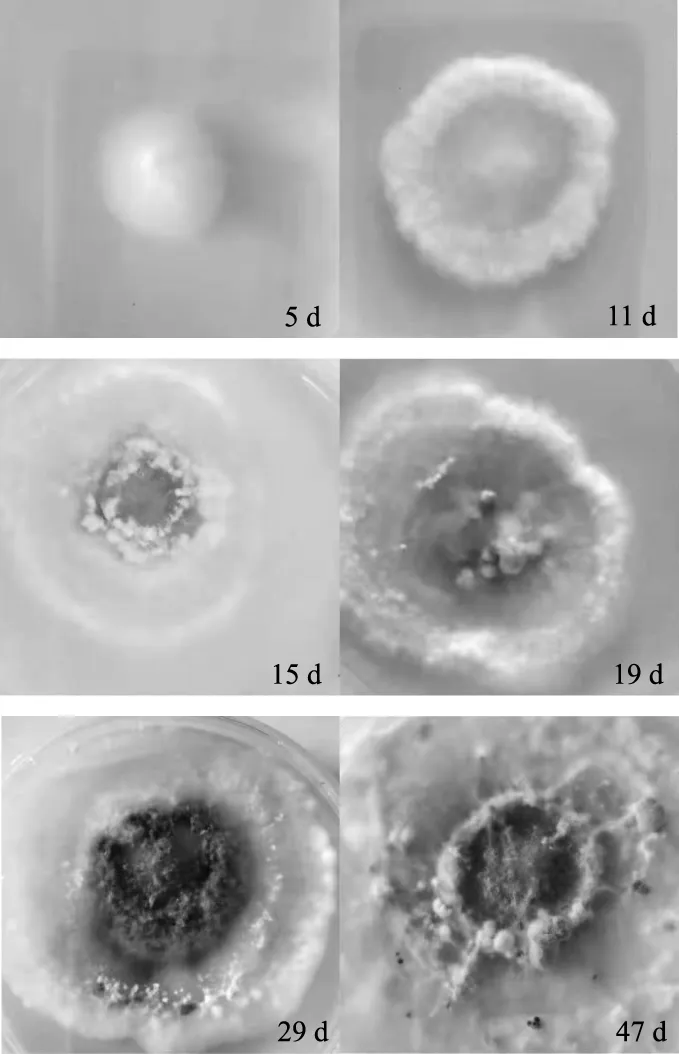
图4 第1代苇蘑不同培养时间菌落特征Fig.4 Colony characteristics of the 1th generation of Hygrophoropsis sp.at different culture time
由图4可知,第1代苇蘑菌种在PDA综合培养基上,1 d~5 d菌丝生长状态良好,菌落呈现白色,菌丝密集并且呈现绒毛状;11 d菌落中心凹陷,菌落外周菌丝体呈现绒毡状,菌丝体呈浅黄色,之后逐渐加深;15 d菌落中部呈深黄色,且于中央出现菌核;19 d菌核变大,菌落中央菌丝体密集度增加;培养29 d,菌落中央呈深棕色且颜色向四周逐渐变浅,中央处菌核变大;培养至后期,由于其分泌的褐色素使菌落中央变为黑褐色。而第2代~第8代苇蘑菌落生长趋势相同,唯一不同是随着菌种继代次数的增加,菌落整体生长周期明显缩短;第1代29 d出现褐化;第6代~第8代主要表现为菌落不生长,且菌落褐化时间提前。经转板重复验证,该规律重复出现,可视为菌种的退化。由此可见,菌落老化是外在表现,一定程度上也反映菌种退化的规律;菌落从活性较强到菌丝稀疏,甚至不再生长,说明菌种已经退化,需要重新分离新菌种;且退化现象不可逆,一旦出现无法修复。
2.5 不同继代次数苇蘑菌丝特征对比
不同继代次数苇蘑菌丝微观形态见图5,菌丝特征量化指标见表3。
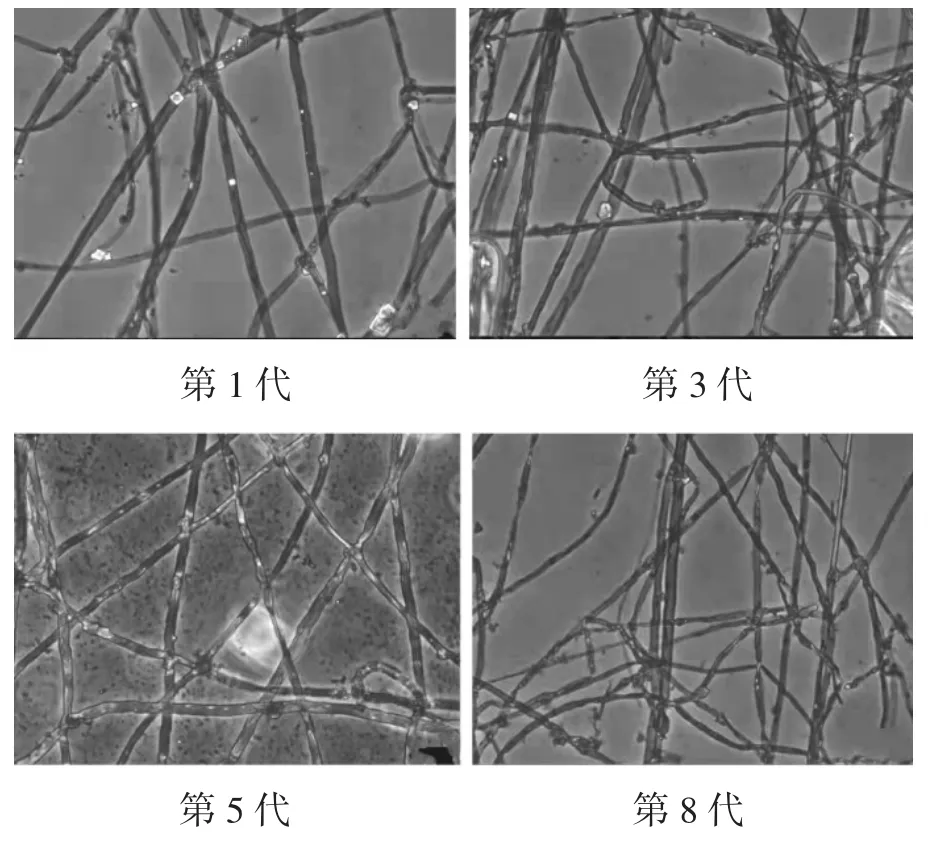
图5 苇蘑菌丝染色结果Fig.5 Mycelial staining results of the Hygrophoropsis sp.

表3 不同继代次数苇蘑菌丝特征量化指标对比Tab.3 Comparison of quantitative indexes of mycelial characteristics of the Hygrophoropsis sp.with different subculture times
如图5和表3所示,苇蘑菌丝随着继代次数增加菌丝逐渐变细,其中骨架菌丝数量减少且变弱,生殖菌丝数量多和锁状联合有所减少,由此可见菌种老化与退化不仅表现在菌落特征上。从微观形态观察其菌丝特征可以明显看到随着继代次数递增,骨架菌丝和联络菌丝的形态与数量基本保持不变,生殖菌丝明显变少,分支变多,菌丝纤细。
2.6 不同继代次数苇蘑栽培种生长情况对比
不同继代次数苇蘑栽培种的菌丝生长情况见表4。

表4 不同继代次数苇蘑栽培种生长情况Tab.4 Growth of the Hygrophoropsis sp.spawn with different subculture times
由表4可知,第1代苇蘑栽培种菌丝萌发周期约为24 h,之后随继代次数增加萌发周期逐渐增加;至第8代需72 h萌发且菌丝基本不吃料,无健壮生长迹象。满袋时长随继代次数增加呈逐渐增加的趋势,至第7代和第8代开始,长时间不能满袋。原基数量和抗杂菌能力同样呈现相同趋势,这可能是由于菌丝较弱形成不了优势菌落,杂菌容易侵染。由此可见菌种老化与退化不仅表现在菌落特征和微观形态,从栽培种的生长情况也可以明显看到;随着继代次数递增,菌丝萌发活力逐渐降低,甚至不再生长。苇蘑菌丝体在培养料中定植和生长的情况,更直观地反应了菌丝活性变化规律以及继代次数。由此可知,在实际生产中应该重视继代次数,以免造成大面积减产或损失。
3 讨论
寻找食用菌的最佳继代次数有利于食用菌菌种保藏和食用菌规模化生产,通过多次继代培养的食用菌菌种都会出现退化的现象。不同菌种的老化属于生理现象,由于菌种的基因型没有变化,所以并不会遗传给下一代,但退化现象是可遗传的。研究表明,继代培养过程中菌种的继代次数越多,其菌落大小、生长速率、菌丝的密度均呈下降趋势;同时菌种开始逐渐退化,退化菌种的菌丝形态要比正常菌丝细弱,且生长速度也远低于正常菌丝[10-11]。相比正常菌种而言,退化菌种的生长优势缺失,抗杂菌能力降低;继代过程中菌落形态发生了明显变化;同时菌种的遗传物质也发生了改变[12-13]。蛹虫草(Cordyceps militaris)继代培养相关研究表明,随继代次数的增加,原基形成数量逐渐变少,形成原基和子实体的时间逐渐延后,生物转化率降低,品质下降的同时出现畸形菇的概率上升[14]。通过观察不同继代次数苇蘑菌种的生长速度、菌落和菌丝形态、栽培种萌发等情况,发现继代次数对其菌种活性影响较大;继代培养到第8代时,菌种生长速度变慢,菌丝体密集程度下降,老化程度加深,原基数量减少,退化现象明显;因此,苇蘑最佳继代次数应严格控制在8代以内,这为苇蘑菌种保藏和批量化生产提供了理论和实践指导。
