不同光质对人参愈伤组织生长及皂苷含量的影响
2022-04-02任跃英晨1王京京1鹤1许永华1
任跃英,牛 晨1,,王京京1,,杨 鹤1,,许永华1,*,刘 志*
1. 吉林农业大学人参新品种选育与开发国家地方联合工程研究中心,吉林 长春 130118 2. 吉林农业大学中药材学院,吉林 长春 130118
引 言
人参(PanaxginsengC.A. Mey.)是五加科人参属多年生药用植物,人参肉质根为著名的强壮滋补药,味甘、微苦,微温,具有大补元气,复脉固脱,补脾益肺,生津养血,安神益智之功效[1]。 人参在《神农本草经》中被列为上品滋补药物,具有“多服久服不伤身,轻身益气不老延年”的作用[2],其具有多种生物活性,包括抗肿瘤、调节免疫力、抗衰老和抗疲劳等,同时亦有提高记忆力和改善心肌缺血损伤作用[3]。 人参含有多种化学成分, 包括人参皂苷、多糖、蛋白质、氨基酸、黄酮类、无机元素、维生素等物质,而人参皂苷是人参中主要的活性成分,属于三萜类皂苷,根据糖苷配基结构不同分为达玛烷型四环三萜类和齐墩果酸型五环三萜类(主要包括Ro)[4],达玛烷型人参皂苷又根据其苷元不同分为原人参二醇型(PPD型,主要包括Rb1,Rb2,Rb3,Rc,Rd)和原人参三醇型(PPT型,主要包括Rg1,Re和Rf)[5]。
人参育种工作已经开展了几十年,但发展缓慢,是由于人参自身的某些特性所导致的[6]。 利用植物组织培养技术可使植物实现离体快繁,大大缩短育种时间。 在植物组织培养过程种,光是重要的影响因素之一。 有研究表明,光质对植物的结构发育及形态有很大的影响[7],对于次生代谢产物的产生有促进作用[8],并且对完整植物和离体的植物组织均有影响[9]。 而光质对于植物的影响会因植物种类的不同而产生不同的影响[10]。 目前,有关光质对人参愈伤组织皂苷含量影响还没有相关研究。 本工作以人参愈伤组织为试验材料,探究光质对人参愈伤组织中人参皂苷含量的影响,旨在提高人参皂苷含量。
1 实验部分
1.1 试验材料
人参采自吉林农业大学药植园,愈伤组织由二年生人参越冬芽诱导而来。
1.2 方法
1.2.1 人参愈伤组织诱导与培养
取二年生人参越冬芽,先用流水冲洗4~6 h,除去泥土,再用洗洁精进行表面清洗,后用滤纸吸干表面水分,放入干净的组培瓶中转至超净工作台。 将人参越冬芽外植体用75%酒精消毒15~20 s,再用无菌水冲洗1次,0.1%升汞消毒10~15 min,无菌水冲洗4~5次。 人参愈伤组织的诱导与继代培养基为MS基础培养基,添加蔗糖30 g·L-1、琼脂7 g·L-1,2,4-D 2.0 mg·L-1、6-BA 1.0 mg·L-1,pH 5.8。 培养条件为暗培养,温度(25±2)℃,湿度60%。
1.2.2 不同光质处理人参愈伤组织及其形态观察
以培养4周且生长状态良好的人参愈伤组织为材料,接种至MS基础培养基中,每瓶均匀接种5块,每块鲜重约0.2 g,每个处理30瓶,重复3次,共接种180 瓶。 将其平均分为 6 组,分别置于红光、红蓝光、蓝光、绿光、黄绿光、黑暗(CK)五 种不同光质条件下培养。 不同光源技术参数如表1所示。 培养温度(25±2) ℃,光照时长16 h·d-1,光照强度(200±10) μmol·m-2·s-1,培养28 d,在第5,15,21,25和30 d时拍照、观察并记录其形态。

表1 不同LED光源技术参数Table 1 Different LED light source technical parameters
1.3 项目测定
收获培养28 d的人参愈伤组织,用滤纸吸干其表面水分,称重,记为鲜重,后置于40 ℃烘箱中烘干至恒重,称其重量记为干重,再用研钵研磨成粉末,过80目筛,保存备用。 精密称取0.1 g的样品粉末,置于5 mL的离心管中,加入2.5 mL氨水-水-甲醇溶液(NH3+H2O+CH3OH=4+21+75,V:V), 封口胶封住管口,用混匀器混匀,超声提取30 min(功率600 W,频率35 kHz),静置48 h,取上清液,0.22 μm微孔滤膜过滤,用超高相液相色谱进行检测。 每个样品重复3次。
1.4 数据分析
用DPS对实验数据进行分析,采用Duncan新复极差法进行显著性分析,Excel 2019进行图形分析。
2 结果与讨论
2.1 不同光质对人参愈伤组织形态的影响
不同光质处理对人参愈伤组织生长及形态变化有明显差异。 如图1所示,蓝光处理下人参愈伤组织最早出现发白现象,且边缘产生灰色物质[图1(A1)],处理第30 d时,愈伤组织逐渐呈灰白色,愈伤块增大[图1(A5)];红光处理下人参愈伤组织也出现变白现象,但程度低于蓝光处理[图1(B1)],后又呈现黄白色,处理第30天时,与对照相比,红光处理后的愈伤偏白,且有愈伤发生褐变,愈伤块明显缩小[图1(B5)];绿光处理下人参愈伤组织颜色发白,但次于其他光质,但逐渐出现大面积的褐变愈伤,少部分仍呈白色[图1(C5)],可能是由于绿光能加速愈伤组织老化,促进次生代谢产物的积累;红蓝光处理下愈伤也呈现白色,但程度低于蓝光而高于其他光质,处理第30 d时,颜色偏灰褐色,且愈伤块缩小,老化程度严重[图1(D5)]。 黄绿光处理下人参愈伤组织初期无明显的颜色变化,后亦发白,且边缘有褐色物质产生[图1(E1)],处理第30 d时,黄绿光处理后大部分愈伤呈白色,白色程度最显著,强于其他光质[图1(E5)];黑暗条件下人参愈伤组织偏黄,边缘有红色物质产生,组织疏松,含水量大[图1(F1)],处理第28 d时,愈伤组织表面呈现红褐色[图1(F5)]。

图1 不同光质对人参愈伤组织形态的影响 A: 蓝光;B: 红光;C: 绿光;D: 红蓝光;E: 黄绿光;F: 黑暗(CK);1,5分别代表第5天、第30天Fig.1 Effects of different light qualities on callus morphology of P.ginsengA: Blue light;B: Red light;C: green light;D: Red and blue light;E: Yellow and green light;F: Dark(CK); The numbers 1and 5 on the figures represent the treatment of the 5th and 30th day, respectively
2.2 不同光质对人参愈伤组织生长的影响
不同光质对人参愈伤组织生长影响如图2所示。 与对照相比,蓝光对愈伤组织生长有促进作用,其他光质对愈伤组织鲜重积累呈不同程度的抑制作用,但与对照相比差异都不显著(p>0.05);除蓝光外,其他光质对鲜重影响均低于对照,但其干重均略高于对照,分析原因可能是由于折干率不同,且不同光质的折干率与对照相比差异显著(p<0.05)。 由此可见,经过蓝光处理,愈伤组织的鲜重、干重均达到最大,说明蓝光对愈伤组织生长起到较好的促进作用,但彼此之间差异不显著(p>0.05)。

图2 不同光质对人参愈伤组织生长的影响
2.3 不同光质对人参愈伤组织中PPD、PPT型、齐墩果酸型人参皂苷和总皂苷含量的影响
不同光质对人参愈伤组织中PPD、PPT型 、齐墩果酸型人参皂苷和总皂苷的影响见表2,其中a—d表示不同光质处理样品中皂苷含量差异的显著性(p<0.05),若字母相同则表示差异不显著(下同)。 由表2可知,不同光质处理后人参愈伤组织中PPD型、PPT型、齐墩果酸型人参皂苷和总皂苷含量多数低于对照,且与对照差异显著(p<0.05);但相比其他光质,绿光处理后PPD型、PPT型、齐墩果酸型人参皂苷和总皂苷含量均较高;蓝光、红蓝光、黄绿光处理后齐墩果酸型人参皂苷消失,而红光、绿光处理后其明显减少;蓝光、红蓝光、黄绿光处理后PPD型、PPT型人参皂苷和总皂苷含量极低;但经过蓝光、红蓝光、黄绿光处理后PPT型人参皂苷含量略高于PPD型皂苷含量,其中蓝光和红蓝光导致的变化最为凸显,黄绿光导致的变化不明显;绿光处理后总皂苷略低于对照,而PPT型人参皂苷略高于对照,但彼此差异都不显著(p>0.05)。 不同光质对人参愈伤组织中总皂苷含量的影响依次为黑暗>绿光>红光>黄绿光>蓝光>红蓝光;对PPD型人参皂苷的影响依次为黑暗>绿光>红光>黄绿光>蓝光>红蓝光;对PPT型人参皂苷的影响依次为黑暗>绿光>红光>黄绿光>红蓝光>蓝光;对齐墩果酸型人参皂苷的影响均较弱。 红光和绿光对人参皂苷作用不明显,而蓝光、红蓝光、黄绿光对人参皂苷合成却起到明显的抑制作用。

表2 不同光质对人参愈伤组织中PPD、PPT型、齐墩果酸型人参皂苷和总皂苷的影响
2.4 不同光质对人参愈伤组织中9种皂苷单体含量的影响
采用超高效液相色谱法测定不同光质对人参愈伤组织中9种皂苷单体含量的影响,结果如表3所示。 不同光质处理对人参愈伤组织中Rb3的含量无影响,均未检测到Rb3的存在;蓝光、红蓝光、黄绿光处理后9种皂苷类成分含量偏低,甚至检测不到Rf,Ro和Rc的存在;与对照相比,绿光处理后Rg1和Rf含量均偏高,此时含量分别为4.063和1.194 mg·g-1,对Rg1和Rf人参皂苷单体含量有促进作用,Rg1变化差异显著(p<0.05),但Rf之间差异不显著(p>0.05);相比蓝光、红蓝光、黄绿光,红光和绿光处理后人参皂苷单体含量较高,且绿光优于红光;总之,红光、蓝光、绿光、红蓝光、黄绿光处理对人参皂苷含量的影响均不如黑暗处理。
近年来,已有不少学者研究光对愈伤组织诱导、植株再生、诱导生根、组培苗生长和次生代谢产物积累等方面的影响,光照虽不是愈伤组织生长的必要条件,但在愈伤组织诱导分化、次生代谢产物积累方面却起着重要的作用,而光质、光照强度、光照周期是影响愈伤组织中次生代谢产物积累的主要因素。 魏喜等[11]研究发现,红蓝混合光有利于棉花愈伤组织的诱导分化。 刘生财等[12]也曾报道红蓝复合光有利于龙眼胚性愈伤组织中类黄酮及表儿茶素合成,且蓝光比例越大越有利于次生代谢物质的合成。 相比田间栽培,植物组织培养技术具有高效、快速等优点,也是生产次生代谢产物最有效的方法之一。 不同光质作为外界因素,会对细胞培养产生直接影响,导致其生长环境发生改变,引起细胞体系的改变,从而对愈伤组织生长和次生代谢产物积累产生影响。 本工作以愈伤组织为材料,探究不同光质对人参愈伤组织中9种人参皂苷单体及总皂苷含量的变化。 结果表明,不同光质处理后人参愈伤组织中PPD型、PPT型、齐墩果酸型人参皂苷和总皂苷含量均低于对照,红光和绿光对人参皂苷含量作用不明显,且蓝光、红蓝光、黄绿光对人参中主要皂苷类成分起到明显的抑制作用。 推测可能因不同光质都是由具有相对能量的光线组成的,会产生一定热量,从而使愈伤组织表面温度升高,而高温高压的环境会使人参皂苷发生降解和转化,可能会生成其他皂苷类成分或增加人参总糖含量,谢丽娟等[13]研究发现,温度较高(>30 ℃),会使人参失去部分糖基,易水解成原人参二醇、原人参三醇或其他的次生苷。 高越等[14]也证实了高温会降低Rg1,Re和Rb2人参皂苷单体的含量。 而且愈伤组织是由未分化的原始细胞团构成的,没有正常人参植株那么复杂的结构,降低了转化时的结构障碍,使得人参皂苷单体之间更易相互转化。
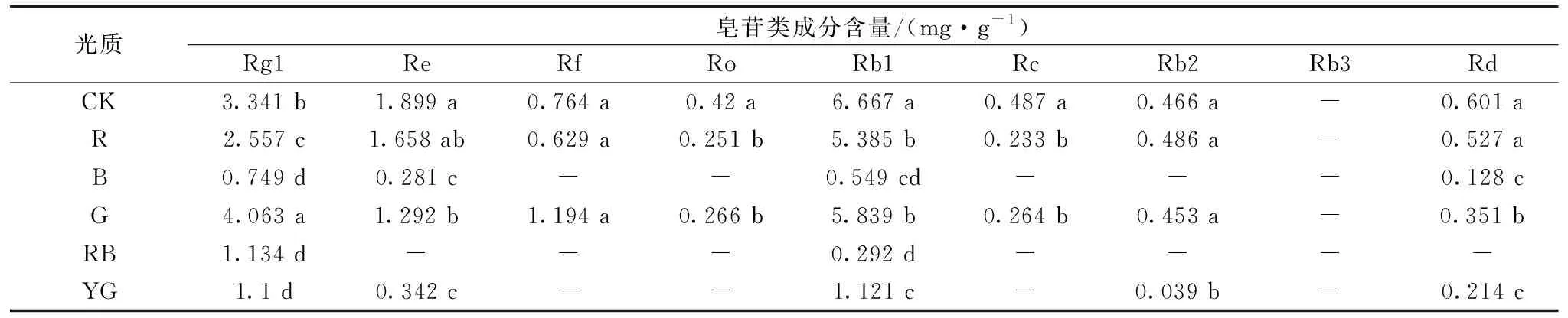
表3 不同光质对人参愈伤组织中9种皂苷类成分含量的影响Table 3 Contents of 9 kinds of individual ginsenosides in P.ginseng callus by different light qualities
3 结 论
光质处理会影响人参愈伤组织形态及生物量,绿光会加速人参愈伤组织老化,促进次生代谢产物积累,而蓝光对人参愈伤组织生长有促进作用。 在对人参愈伤组织中9种人参皂苷成分的研究中发现,蓝光、红蓝光、黄绿光处理后9种皂苷类成分含量极低;与对照相比,绿光处理后Rg1、Rf含量均偏高,对Rg1、Rf人参皂苷单体形成有促进作用;相比蓝、红蓝、黄绿三种光质,红光和绿光处理后人参皂苷单体含量较高,且绿光优于红光;总之,红光、蓝光、绿光、红蓝光、黄绿光处理对人参皂苷含量的影响均不如对照。
综上所述,绿光会加速人参愈伤组织老化,而蓝光会促进人参愈伤组织生长。 不同光质对人参愈伤组织中总皂苷及9种单体皂苷类成分的影响有所不同,绿光对Rg1、Rf人参皂苷单体含量有促进作用,并且其含量与光质所具能量高低有一定关系。 从光照的角度出发,对如何提高人参皂苷含量的方法还有待进一步深究。
