木本植物低温应答机制研究进展
2022-04-02刘紫烟刘佳乐朱圆圆杨雅舒陈利英张雪梅齐国辉
刘紫烟,刘佳乐,朱圆圆,杨雅舒,陈利英,张雪梅,齐国辉*
(1.河北农业大学 林学院,河北 保定 071001;2.河北省核桃工程研究中心,河北 邢台 054000;3.河北绿岭果业有限公司,河北 邢台 054300)
木本植物的生长和分布受低温的严重制约,然而部分抗寒性强的木本植物在长期的进化过程中,形成了适度应答低温胁迫的复杂而高效的调控机制,使木本植物细胞在生理和生化水平上进行适应性调整,最终抵御和适应低温胁迫。因此,了解并清楚强抗寒性木本植物的抗寒机理,找出诱导木本植物冷驯化和耐寒能力的关键基因,对于后期选育强抗寒性的木本植物种质资源尤为重要。
1 木本植物对低温胁迫的生理响应
1.1 膜系统
细胞膜又名质膜,由磷脂双分子层、蛋白质以及少量的糖类组成。在受到低温胁迫时,细胞膜会由液晶态转成凝胶态,膜透性增大,电解质失衡(改变Ca2+通道的开关及其他的信号转导过程),使细胞代谢紊乱,甚至导致死亡[1]。鉴于这一原理,常采用电导法来检测植物抗冷冻性,再通过Logistic方程拟合拐点求出植株的低温半致死温度(Lethal temperature,LT50),以此反映温度与抗寒性之间的数量关系。王国霞等[2]研究发现低温胁迫下油茶(Camelliaoleifera)的相对电导率随胁迫天数的增加而增加,在恢复1 d后较胁迫5 d时有下降,说明在一定伤害下,低温胁迫对细胞膜的伤害可逆。除油茶外,相对电导率在多种植物上应用均能较准确表现其抗寒性[3-4]。
在低温胁迫下,植物体内的自由基会增多,自由基使膜脂过氧化程度加剧。丙二醛(MDA)为膜脂过氧化的最终产物,MDA含量越高,植物抗寒性越弱[5]。李艳红等[3]研究发现低温胁迫后的4个沙棘(Hippophaerhamnoides)品种枝条的MDA含量随温度降低而升高。陈美谕等[5]研究也得出MDA含量和抗寒性的相关性,而且发现无论萌芽期还是展叶期椴树(Tiliatuan)的抗寒力都受MDA含量的影响。
1.2 保护酶系统
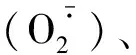
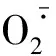
1.3 有机调节物质
1.3.1 脯氨酸(Pro) Pro不仅作为渗透调节物质维持渗透势[9],还可以清除ROS,作为蛋白质保护物,维持细胞的内环境,因此在御寒活动中至关重要。在低温胁迫下,植物体内Pro含量会增加几十倍甚至上百倍。赵红军等[10]研究发现,扁桃(Amygdaluscommunis)枝条在低温胁迫时,Pro的含量呈现“升—降—升”的变化趋势;邓拓等[11]研究发现随胁迫时间的延长核桃枝条的Pro含量呈现“升—降”的变化趋势,在胁迫24 h时达到峰值。这些结果可解释为不同树种间脯氨酸含量峰值可能不同,到达时间也不同。
1.3.2 可溶性糖(SS) SS的增加可以提高植物细胞的渗透压,增强保水能力,使植物抗寒性得以提高[9]。吴硕等[8]对4个核桃品种进行低温后生理指标的测定,发现3个品种的SS含量呈“降-升-降”的变化趋势。张淑文等[12]通过对不同杨梅(Morellarubra)种质生理指标的测定,发现低温处理后3个品种杨梅幼苗的SS含量变化趋势基本一致,呈现先升后降趋势,只是出现峰值的时间和变化幅度不一样。由上述试验结果发现,无论降-升-降还是先升后降的变化趋势,可能都是SS在低温胁迫中最大限度维持细胞渗透压后含量开始下降。
1.3.3 可溶性蛋白(SP) SP含量也是植物抗寒性的一个重要指标,具有极强的亲水性,低温胁迫下,SP含量的增加可以增加植物体内束缚水的含量,保持渗透势,防止细胞冻伤[9]。张海燕等[4]研究发现5个欧美杨(Populus×canadensis)无性系在低温胁迫试验中,SP含量发生了先升后降的趋势变化。而李艳红等[3]在不同沙棘品种的低温试验中,也发现SP含量随温度的降低先增后降。但马若晨等[13]研究发现,4个三角梅(Bougainvilleaglabra)品种叶片的SP含量随温度的降低而出现先减小后增加的趋势。笔者猜测SP在乔灌木中可能存在不同的御寒模式。
2 木本植物对低温胁迫的分子响应
2.1 木本植物响应低温信号的主要转导途径
2.1.1 Ca2+信号转导途径 Ca2+作为第2信使,在植物冷信号转导中至关重要。低温胁迫可使植物细胞质中Ca2+浓度增加,增加的Ca2+被Ca2+传感蛋白解码,Ca2+传感蛋白是一种具有EF-hand结构域[14]。根据EF-hand单元相关信息(数目、序列、排列方式、结构域等),将Ca2+传感蛋白分为3类:1)钙调蛋白(Calmodulin,CaM)和钙调素类蛋白(CaM-like protein,CML)[15],2)Ca2+依赖蛋白激酶(Ca2+dependent protein kinase,CDPK)[16],3)类钙调磷酸酶B蛋白(calcineurin B-like proteins,CBL)[17]。
CaM、CML及CBL只含有EF-hand基序,仅能依赖与Ca2+结合后其诱导的构象变化,结合下游蛋白发挥作用,其中CBL只能与一种特有的蛋白激酶CIPKs(CBL interaeting protein kinase)互作发挥作用,CDPK除了EF-hand基序外,还具有激酶结构域,在受到Ca2+激活后能直接发挥作用[18]。但这些Ca2+传感蛋白在植物中,特别是木本植物中的研究仍然十分有限,Zhang等[19]在苹果(Maluspumila)基因组中发现83个CMLs和7个CaMs,这些CMLs和CaMs含有高度保守的EF-hand基序,大多数CMLs是由激素和非生物胁迫诱导的,表明它们在调控苹果的生长、发育和胁迫反应中可能发挥作用。崔桥云[20]从茶树(Camelliasinensis)良种中扩增出5个茶树CML基因:除CsCML18-1外,其他4个茶树CML基因在低温胁迫下均为上调表达。综上所述,这些研究结果为CML可能参与木本植物低温胁迫提供了潜在的证据,但作用机理仍需进一步探明。
2.1.2 MAPK级联介导的冷信号转导途径 MAPK级联在植物御冷胁迫中也扮演着重要角色[21]。MAPK级联信号传递通路中包含MAPKKK(MAP3K或MEKK)、MAP2K(MKK或MEK)和MAPK 3类激酶,在受到低温胁迫时,细胞质内Ca2+不断积累,MAP3K-MAP2K-MAPK依次被磷酸化,将低温信号逐步传递给下游的应答因子,激活各种效应蛋白,进而调节目的基因的表达。焦瑾[22]利用生物信息学方法鉴定得到了23个白梨(Pyrusbretschneideri)MAPKs基因,发现在低温胁迫时,只有PbrMAPK13和PbrMAPK14 2个基因表达量显著上调,来应对低温胁迫,但多数基因积极响应其他各种处理,并且不同MAPK基因对不同的处理有不同应答模式。因此,MAPKs基因家族中并不是所有的基因都与低温胁迫有关,且MAPKs基因在木本植物中研究较少,更多研究于草本及作物。
2.2 木本植物抗寒转录组学(transcriptomics)研究
2.2.1 抗寒相关TFs TFs是对基因的转录过程起重要调控作用的一类蛋白质分子,在低温逆境下,被胁迫信号激活的TFs与冷应激相关基因启动子区相应的顺式作用元件相互作用,激活这些下游基因的表达[23]。近年来,有众多的TFs的功能在模式植物中逐渐被阐明,其中研究比较多的与抗寒性相关的TFs有AP2/ERF、MYB、NAC、WRKY、bHLH、bZIP类等TFs[24]。
2.2.1.1 AP2/ERF(TF) AP2/ERF类TF是植物中最大的转录调控家族之一,该TF包含AP2、RAV、DREB和ERF等4个亚家族。其中DREB和 ERF与低温胁迫密切相关,分别结合到下游功能基因启动子区域的DRE/CRT 位点(CCGAC)和GCC-box 位点(AGCCGCC)[25-26],调控下游基因的表达。目前,对DREB基因抵抗非生物胁迫的研究较多,在抗寒中研究较多的DREB[27]类TF为DREB1/CBF(dehydration-responsive element binding protein 1)/(C-repeat/DRE binding factor)TF,主要包括DREB1B/CBF1、DREB1C/CBF2及 DREB1A/CBF3,这些能大量调控冷诱导基因如 COR(cold-regulated)和 LTI(low temperature induced)基因的表达,以提高植物抗寒性。Yang等[28]从山荆子(Malus baccata)中克隆了1个DREB1(TF)基因,转基因结果表明MbDREB1作为TF,通过依赖和不依赖ABA的途径提高植物对低温的耐受性。说明DREB1转录因子可能通过多条途径参与木本植物低温胁迫响应。Lü等[29]研究发现BpERF13在白桦(Betulaplatyphylla)不同组织中均有差异表达,且可以通过冷处理(4 ℃)诱导表达,BpERF13过表达的转基因白桦株系抗寒性明显增强,减少了ROS,这些结果表明(TF)BpERF13可以调节着木本植物耐寒的生理过程。说明ERF或许通过产生抗氧化酶和抗氧化物来保护木本植物的耐寒性。
2.2.1.2 MYB(TF) MYB(TFs)是植物中最大的TFs家族之一,MYB家族的典型特征是在N-端具有由52个氨基酸残基组成的高度保守的MYB结构域[30]。根据MYB结构域中重复序列的数量不同,MYB家族[33]可分为R1MYB(MYB-related)、R2R3MYB、R1R2R3MYB和4RMYB 4个亚家族,其中大多数MYB(TF)都属于 R2R3MYB 类,MYB(TF)结合MYBRS顺式作用元件(A/TAACCA和C/TAACG/TG)参与了许多ABA和非生物胁迫的应答[31]。An等[32]从苹果中鉴定出R2R3-MYB(TF)Md MYB 23,发现Md MYB 23通过促进原花青素积累和ROS清除,参与了苹果的耐寒性和原花青素积累。张宇等[33]研究发现Bp MYB4基因在低温中的作用,并做了白桦转化试验,结果表明Bp MYB4转基因白桦在冷胁迫下保护物质增多,抗寒性增强。综上所述,MYB(TF)的抗寒机理推测是增加抗氧化物等保护物质来减少木本植物的低温逆境伤害。
2.2.2 低温诱导的转录调控途径 植物中存在2条响应低温胁迫的调控途径,即ABA依赖型与非依赖型调控途径,而非ABA依赖型调控途径又可分为CBF依赖(C-repeat binding transcription factor)的调控途径和不依赖调控途径。
在ABA依赖型中[23,34],ABA响应基因的启动子区域主要包括3类顺式作用元件:DRE/CRT、ABRE和MYCRS/MYBRS,能够被许多对应的TF诱导,如DREB2A/2B、AREB1、MYC/MYB,受ABA诱导的基因有冷诱导基因COR和抗冻基因LEA。在非ABA依赖型中,依赖于CBF的调控途径主要是ICE-CBF-COR途径,(TF)ICE[35]激活下游转录因子基因CBF的表达,CBF(TF)再激活更下游基因启动子中含有CCGAC序列的CRT/DRE顺式作用元件COR基因的表达,CBF基因在植物遭受低温胁迫的短时间内迅速被诱导,然后激活下游COR基因的表达。在1 200种受到低温调控的COR基因,仅有约170 种受CBF蛋白调控,说明不受CBF(TF)的调控COR表达路径大量存在着。Sarah Fowler试验得出只有12%的低温响应基因是CBF的特定成员,至少28%的低温响应基因不属于CBF(TF)[36]。在非CBF依赖型中,ROS-b ZIP-CRT/DRE和MYC/MYB-MYCRE/MYBRE两条通路在低温响应中起着重要的作用[37]。这些基因行使的主要功能包括冷感知或信号转导,冷响应,细胞膜稳定性,渗透感知,作为解毒酶等。
近年来,大多试验是针对依赖于CBF的抗寒调控途径的。Wisniewski Metal[38]发现桃树(Prunuspersica)CBF(PpCBF1)在苹果上的异位高表达导致了苹果冷驯化、休眠和生长的显著变化。拟南芥中组成性表达CBF1的转基因杨(AtCBF1)在低温胁迫下,AtCBF1的异位表达显著提高未驯化植物的叶片和梢的抗冻性[39]。这些转基因株系为研究这些季节性生命周期参数的整合提供了一个有用的模型。
2.3 木本植物抗寒蛋白组学(proteomics)研究
2.3.1 低温诱导的功能蛋白 冷胁迫会诱导大量的基因,这些基因翻译的结果大致分为2类[40-42],一是具有高度亲水性的保水功能蛋白(如LEA、抗冻、脱水、冷激蛋白,mRNA结合蛋白,热激蛋白(HSP)等)、毒性降解酶(如POD、SOD等);二是调控蛋白(如TFs(AP2/ERF、b HLH(TF)等)、转导胁迫信号的蛋白激酶(如MAPK激酶、受体蛋白激酶等)等。
抗冻蛋白(antifreeze protein,AFP)是一种能降低细胞间隙体液冰点的糖蛋白,其N端具有富含亮氨酸的重复受体结构域,具有亲水性,可以在质外液体中积累并抑制冰晶的形成[43]。Jarzabek等[44]从云杉针叶(Piceaabies)细胞间隙中提取出AFPs,冬云杉针叶的质外蛋白具有防冻活性,而夏云杉针叶的则不具有,在AFPs存在的情况下,冷冻后乳酸脱氢酶(LDH)的活性更高,此外云杉产生的AFPs分泌到针叶的质外体,冷驯化导致质外体中AFPs的积累表明这些蛋白可能在针叶植物细胞获得抗冻性中起作用。
LEA蛋白[45](late embryogenesis abundant,LEA)(晚期胚胎丰度蛋白)在植物对低温逆境的相应中也扮演重要角色,LEA蛋白富含亲水性的氨基酸,参与与水分子的结合、提高渗透压。LEA蛋白的作用有提高渗透压、保护抗氧化酶、缓解ROS伤害等。王晶[46]在蜡梅的抗逆性研究中发现,LEA基因可提高植物的抗寒性:随温度降低LEA基因的表达量逐渐加大,并在低温持续12 h时表达量最高,往后也没有下降的趋势。Zhao等[47]将可以增强转基因烟草耐旱性的柽柳(Tamarixchinensis)LEA基因,经过克隆转入半高丛北地蓝莓(Vacciniumuliginosum),发现低温胁迫下,过表达LEA基因提高了POD和SOD的活性,脂质过氧化作用在转基因线明显低于非转基因植物冷应激后MDA含量和REL。由此证实了LEA基因可以通过这种代谢途径产生以提高木本植物耐寒能力的物质。此外,功能基因在转基因植物体中的功能表达、表达模式仍因转基因植物的不同而异。
2.3.2 木本植物冷胁迫蛋白质组学研究 J.Renaut等[48]研究了低温(4 ℃)下3个月龄杨树(Populusprzewalskii)与对照温度(23 ℃)下的植株材料进行蛋白质比较。MALDI-TOF-MS提出大约30个低温响应差异蛋白点,其中约1/3与伴侣样蛋白(热休克、伴侣蛋白)有相似之处,脱氢酶等LEA蛋白参与应激反应的蛋白也被激活或新合成。不仅在杨树上,J.Renaut等[42]利用5 ℃和短光周期这2个因素对1年生桃树(Prunuspersica)树皮组织蛋白质组的变化也进行了研究,质谱法鉴定了凝胶上的57个蛋白点,它们为参与碳水化合物代谢(如烯醇化酶、苹果酸脱氢酶等)、防御或保护机制(如脱氢酶、热应激蛋白和PR蛋白)、能量产生和电子传递(如三磷酸腺苷合酶和裂解酶)以及细胞骨架组织(如微管蛋白和肌动蛋白)的蛋白质。
在侧柏(Platycladusorientalis)[49]、大桉(Eucalyptusgrandis)[50]上也都进行了蛋白质组学技术测定蛋白质表达变化情况,发现在低温下诱导许多蛋白质的生成,这些蛋白往往涉及抗氧化与胁迫防御、碳水化合物代谢、蛋白合成降解、无机离子转运和代谢、转录调控与蛋白翻译等,这些代谢途径对木本植物响应低温的网络有着重要作用。这些蛋白可能相互作用,在不同木本植物中进行着不同的结合与途径调控。
2.4 木本植物抗寒代谢组学(metabolomics)研究
代谢组学是指对生物体内相对分子质量<1 000的小分子代谢物进行定量分析的一门学科,被认为是植物基因组和植物表型之间的桥梁[51]。植物对生物或非生物逆境的应答过程中,常会产生一些如糖类,氨基酸类以及负责信号转导的脂类分子等负责调节植物生理活动的小分子物质[52]。代谢物反映了基因表达、蛋白质互作等不同调控过程的结果,因此比mRNA转录本或单独的蛋白质更接近表型[53]。
段二龙等[54]研究发现不同品种玉兰(Yulaniadenudata)采用GC-MS技术对低温胁迫下的红花玉兰和白玉兰茎尖进行代谢组分析,试验结果显示4 ℃低温胁迫下红花玉兰产生氨基酸类和糖类代谢物较多,白玉兰仅产生氨基酸类代谢物较多。表明同一种但不同品种间木本植物其低温胁迫的代谢结果也不尽相同。皇甫诗男[55]研究发现笃斯越橘(Vacciniumuliginosum)在低温暗培养下其差异基因与差异代谢物主要集中在植物激素信号转导,氨基酸生物合成通路中。近年来发现与低温相关的代谢物有糖类、氨基酸、有机酸、硫代谢物和三羧酸循环中间代谢物等[54-55],对这些代谢产物进行生物学分析,明确其功能,为从代谢水平上清晰植物抗寒机制提供理论基础。
3 展望
研究讨论了目前关于木本植物低温胁迫下的“已知和未知”。木本植物作为一个系统的生物体,在遭遇低温时,往往伴随的不仅是一种胁迫,干旱、光照、冻融交替胁迫也会使木本植物雪上加霜,在考虑和布设试验方面仍缺乏全面的试验设计;从信号转导、转录调控、基因表达到生理、形态变化应是一个连贯系统的过程,目前在冷胁迫下鉴定抗性相关的生理特性均已在木本植物上进行试验,但仅这些远不足以清晰木本植物的抗寒机制,信号转导、转录组、蛋白组、代谢物等不同层次的变化也在逐步揭示这些机制,而这些层次仅于模式植物及一些作物种类中研究较多,对木本植物的研究还很少,且单一组学和两两联合组学的分子探究不足以系统阐明木本植物抗寒机制;在信号转导中,对于各种胁迫如何被植物所感知,如ABA与MAPK等信号具体如何将冷胁迫信号转导至细胞核并引起转录变化,还待进一步探索。内含子、microRNAs的信息功能在木本植物应对低温胁迫时仍尚未可知;转录后加工、翻译后修饰、TF间互作、蛋白质互作等分子生物学问题仍需探究和阐明。
未来在考虑和布设试验方面,仍需全面和实际,使其结果更真实自然,从而使接下来的解决方案更直接和有效;针对于木本植物分子水平的抗寒机制仍需进行更多的探索,且将来需从分子组学(转录组、蛋白组、代谢组)多层面阐明木本植物抗寒机制,对3个“组学”中木本植物低温胁迫下的变化规律更明了,这也将更系统全面地揭示木本植物低温胁迫响应机制;似是而非、一知半解的信号转导机制仍然留给后续研究者若干可探索的奥秘;除3组学分析外,内含子、microRNAs的信息功能、转录后加工、翻译后修饰、TF间互作、蛋白质互作等也会对木本植物应对低温胁迫产生不同程度影响,因而这些分子生物学问题也将会成为更多人探究的领域。木本植物响应冷胁迫的基因的分子克隆、功能鉴定和注释方面,缺乏足够的突变资源,这仍然是一个长期的挑战。
