外源NO对核桃幼苗叶多酚及其抗氧化活性的影响
2022-04-02王田雨黄倩雪谢牧洪张尚昆杨桂燕
任 斌,王田雨,黄倩雪,谢牧洪,张尚昆,郝 艳,杨桂燕
(西北农林科技大学 林学院,陕西省核桃工程技术研究中心,陕西 杨陵 712100)
核桃(Juglansregia)是世界上分布广泛,具有重要价值的木本植物。在我国决战决胜脱贫攻坚上,核桃是规模较大、覆盖最广、惠及农户最多的第1大经济林果,在农户持续增收等方面发挥了重要作用。核桃果实中含有多种有益物质,如不饱和脂肪酸、蛋白质、矿物质、生育酚和黄酮,有健脑益智、预防心血管疾病、降血脂、降糖等多种作用,因此引起广泛关注和研究。但近年来,霜冻害严重制约核桃产量,给广大果农造成重大的经济损失,严重损害了核桃产业的健康可持续发展[1]。如陕西地区频繁出现的‘倒春寒’现象,在2018年导致商洛等地区的大面积核桃绝收;持续高温干旱气候,使得核桃果实落果现象增强。这对提高核桃的抗逆提出了新的要求。
植物多酚包括简单结构物质(如酚酸类、黄酮类化合物)和高分子聚合物(如木质素、单宁)[2],以类黄酮化合物最为常见。植物多酚积累与逆境响应具有重要关系,如,低温胁迫下,油菜素类固醇增强型表达基因BEE1与G2-类黄酮调节因子GFR通过抑制TT8、GL3(Glabrous3)和(/或)MYB的表达负调控花青素积累[3]。核桃种仁、青皮、叶片、树皮、花及枝条等各部分组织均含有高含量的多酚类物质[4]。刘畅等[2]研究表明,核桃中的多酚含量为油菜籽的1.65倍,其抗氧化能力与Vc相当或仅次于Vc。其他许多试验也证实核桃多酚具有优异的抗氧化及自由基清除能力[5-6]。基于此,核桃多酚相关产品逐渐被应用于医药(抗氧化调节剂等)、工业(化妆品和洗涤剂等)、农业(饲料等)等各个领域。同时,宋宇琴等[7]研究表明,核桃枝条总酚含量与抗寒、抗病相关,核桃1年生枝条韧皮部的总酚含量可作为判断核桃树体抗寒性的生理指标。可见,探究核桃多酚类物质的积累与核桃逆境耐受性之间的关系具有重要应用意义。
NO是重要的活性氮(RNS),低浓度NO可作为抗氧化剂迅速清除活性氧(ROS),并且能诱导抗氧化酶基因的表达,提高酶活性,与植物抗逆具有重要关系[8]。同时NO被认为是高等植物中重要的内源成熟和衰老调节剂,在调控植物发育、代谢、抗病性、胁迫和防御反应方面起着关键作用[9]。如,在施加硝普钠(sodium nitroprusside,SNP)提供外源NO情况下,翅果油树(Elaeagnusmollis)幼苗叶片叶绿素含量和叶片净光合速率提高而增强了对干旱的抵抗力[10],苦瓜(Momordicacharantia)的过氧化氢酶(CAT)活性、过氧化物酶(POD)活性及超氧化物酶(SOD)活性均被增强进而提高了低温适应性,促进低温胁迫下苦瓜幼苗的生长[11]。在抵抗盐胁迫方面,外源NO可以提高烟草(Nicotianatabacum)幼苗水分含量、叶绿素含量、根系活力以及多种抗氧化酶活性,从而减小盐胁迫对幼苗的伤害[12]。目前,关于外源NO对植物幼苗影响的研究多在草本植物以及其他农作物,针对核桃幼苗的研究还相对缺乏。因此,本研究通过不同浓度SNP对核桃多酚积累及抗氧化酶活性的影响,得出最适SNP浓度,可直接反应其与核桃抗逆之间的关系,有利于揭示外源NO影响核桃抗逆的可能作用机制,为外源NO(SNP)在核桃抗逆生产中的应用提供一定的理论基础。
1 材料与方法
1.1 材料与处理
‘香玲’核桃种子经2周浸泡预处理后种植于营养土——V(珍珠岩)∶V(蛭石)∶V(基质)=1∶2∶3,培养1 a。然后将‘香玲’核桃接穗嫁接于实生苗上,培养至1年生,用于SNP处理。查阅文献总结草本或木本植物进行SNP处理的最适浓度,其范围跨度较大,为0.1~0.5 mmol/L(表1)。因此,本研究针对核桃叶进行0、10、50、100、150、200、300、500 μmol/L的SNP处理,将配置好的不同浓度的SNP溶液于18:00喷洒于核桃植株的叶表面,每隔3 d喷施处理液1次,处理15 d后取叶进行指标测定,筛选最适浓度。

表1 不同植物SNP最适浓度
1.2 核桃叶多酚、总黄酮含量的测定
分别用200 μL量程移液器吸取0、60、120、180、240、300 μL没食子酸对照品溶液于试管中,再分别加入1 mL Folin-酚试剂,摇匀静置5 min,再加入碳酸钠(7.5%)溶液3 mL,并加水定容至10 mL,40 ℃水浴并暗中处理60 min。设定波长为760 nm,测量各组样品的吸光度值,建立标准曲线,y=0.067x-0.005 3,R2=0.996。依据Folin-酚法提取叶总多酚[19],总酚含量=0.003 75G/W×100%,G为标准曲线中查的总酚含量,单位μg;W为样品重量,单位g。
分别用200 μL量程移液器吸取1、2、3、4、5、6 mL芦丁标准品溶液(0.2 mg/mL)于25 mL容量瓶,再分别加1 mL 5%的NaNO2、10%的Al(NO3)3。混匀室温静置6 min,再加入10 mL 4%的NaOH,定容至25 mL,混匀,室温静置15 min。70%乙醇为空白对照。测定510 nm处的吸光度值。标准曲线为y=0.113 7x+0.001 4,R2=0.991 2。依此采用比色法测定各样品的总黄酮含量[20]。
采用Al(NO3)3比色法测定各样品(试验组与对照组)溶液的总黄酮含量。取上述核桃叶应用液0.5 mL加入1 mL 5% NaNO2溶液,摇匀后并放置6 min,再加入1 mL 10% Al(NO3)3,摇匀后,室温下静置6 min,加入4% NaOH溶液10 mL,加水定容至25 mL,摇匀放置15 min。在510 nm波长下测定样品的吸光度,以乙醇为空白对照。样品中总黄酮的含量以1 g核桃叶中总黄酮的当量芦丁来表示(mg/g)。
1.3 核桃叶多酚抗氧化活性测定
1.3.1 DPPH·清除能力 采用2,4-二硝基苯肼比色法测定Vc含量[21],以空白液作为对照,在517 nm处测定所有样品的吸光度。标准曲线为y=-0.848 7x+0.880 3,R2=0.992 4。采用80%的乙醇溶液分别配制核桃叶的提取物及各萃取部分一系列不同质量浓度的样品溶液(0、0.15、0.3、0.45、0.6、0.75 mg/mL),根据标准曲线,按照公式(1)计算DPPH·清除率。
DPPH·清除率=[A空白-(A样品-A对照)]/A空白×100%
(1)
式中:A空白、A样品、A对照分别为空白管、样品管、对照管吸光值。下同。
1.3.2 ABTS·清除能力测定 采取2,4-二硝基苯肼比色法,在734 nm处测定所有样品的吸光度。标准曲线y=-58 688x+0.633 5,R2=0.991 2。用80%乙醇溶液分别配制提取物及各部分一系列不同质量浓度的样品溶液(0、12.5、25、37.5、50、75、100 μg/mL),按照式(2)计算ABTS·清除率[22]。
ABTS·清除率=[A空白-(A样品-A对照)]/A空白×100%
(2)
1.4 核桃叶抗氧化酶活性测定
SOD活性用氮蓝四唑法测定,POD活性用愈创木酚显色法测定[23]。GST活性用谷胱甘肽-S转移酶(GSH-ST)试剂盒(比色法)(南京建成生物工程研究所)测定。
1.5 叶多酚含量与其他指标之间的差异显著性分析
采用多重比较法和q值检验法分析上述得到的数据,将核桃叶总多酚的含量与核桃叶总黄酮含量以及相关自由基的清除能力对比分析;将总多酚含量与相关抗氧化酶活性进行分析,得到总多酚含量与其他指标的相关性。
2 结果与分析
2.1 SNP处理下核桃叶总多酚、总黄酮含量变化
对不同浓度SNP处理后的叶多酚积累进行测定,结果发现,在0~50 μmol/L SNP处理下,植株的总多酚含量没有明显变化;浓度为100~150 μmol/L时,核桃叶总多酚含量随着浓度增加逐渐增多,之后开始逐渐下降;浓度为200~500 μmol/L时,总多酚含量下降幅度较大,在SNP浓度为150 μmol/L,叶总多酚含量最大,为26.45 mg/g(图1A)。总黄酮含量随着SNP浓度的变化与叶总多酚一致,在0~50 μmol/L时,总黄酮含量变化不大,SNP浓度为150 μmol/L时,达到最大值,叶总黄酮含量为15.04 mg/g;之后开始逐渐下降(图1B)。可见,对1年生‘香玲’核桃,最适调节浓度SNP可能为150 μmol/L。
2.2 SNP对核桃叶多酚抗氧化活性的影响
DPPH·和ABTS·清除率是多酚抗氧化活性的重要表现。对不同浓度SNP处理后的植株进行DPPH·清除率测定,DPPH·清除率越大,核桃叶多酚的抗氧化能力就越强。发现DPPH·清除率的变化与多酚含量及黄酮含量变化趋势一致,都在150 μmol/L处理下,达到最大值,为35.86 mg Vc/g(图2A)。ABTS·清除率的变化与DPPH·变化趋势一致,在150 μmol/L处理下,达到最大值,为46.87 mg/g(图2B)。表明核桃叶多酚抗氧化能力在150 μmol/L SNP处理下最强。
2.3 SNP对核桃叶抗氧化酶活性的影响
抗氧化酶活性变化可以反映SNP处理调控哪些物质和代谢通路来调控植株增强抗性。结果显示,SNP处理下SOD活性随着SNP浓度增大逐渐增加,当SNP浓度为150 μmol/L后缓慢降低,但降低幅度较小(图3A)。POD活性变化与SOD一致,在SNP浓度为150 μmol/L时,POD活性最高(图3B)。GST活性在SNP处理下的变化与POD比较相似,SNP为0~10 μmol/L时,GST活性基本没发生改变,50 μmol/L之后GST活性显著增强,在浓度为150 μmol/L时GST活性最高,SNP浓度在200~500 μmol/L时,GST活性基本不发生改变(图3C)。
2.4 SNP处理下核桃叶各指标值之间的相关性
通过分析DPPH·清除率、ABTS·清除率等指标之间的相关性,能够明确各个指标之间的关系。从表2可看出,总多酚与总黄酮、氧自由基清除、抗氧化酶活性等指标之间具有显著相关性。这表明,核桃叶多酚类物质能够与黄酮类物质同步积累,共同增强抗氧化能力,同时与SOD、POD和GST等逆境响应重要酶活性相关,推测SNP可多方面调节植株逆境过程涉及的抗性生理指标,以此增强植株应对不良刺激的潜力。
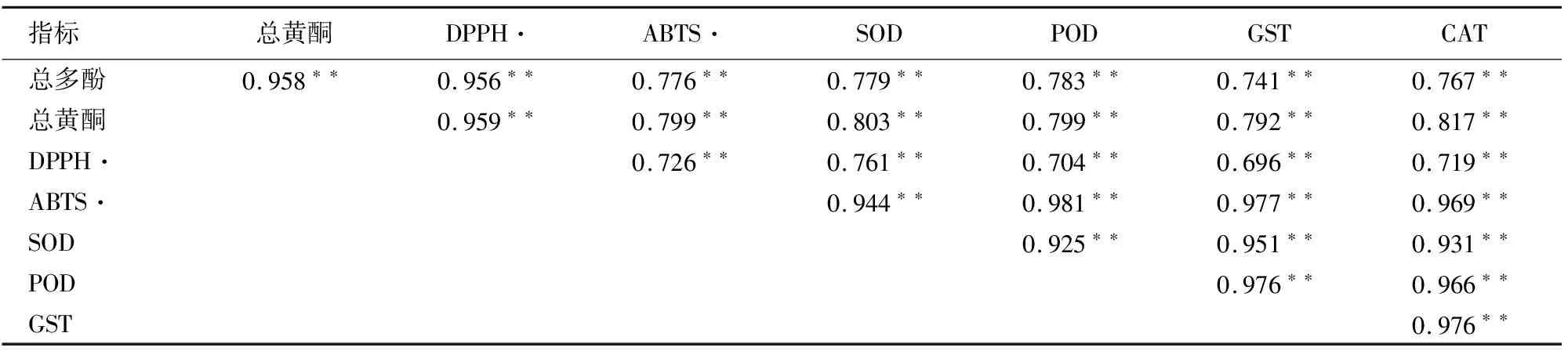
表2 各指标相关性分析(P<0.01)
3 结论与讨论
核桃是世界重要坚果,在区域经济发展上起到重要作用。我国核桃资源丰富,栽培历史悠久,种植范围广泛且仍在扩大,并培育出许多优良品种。核桃种植区大多自然条件差,其产量和质量受水资源直接制约,有着产量少、品质劣等问题。在北方,气温低,常出现冻害和霜害,使得核桃减产,很难维持核桃产业的稳定可持续发展[8]。而核桃叶中含有丰富的多酚活性物质,在活性氧清除、抗氧化保护等方面具有重要作用;多酚含量与抗氧化活性也具有正相关性,其活性主要表现为抗氧化活性清除体内自由基,同时多酚的抑菌能力与黄酮化合物有关[24-25]。由于低浓度的NO与植物抗性有重要关系,能够诱导抗氧化酶基因的表达,提高酶活性[8-17],所以对外源NO对核桃多酚物质积累及其抗氧化活性的影响研究十分必要。因此,本研究选用1年生‘香玲’核桃为试验材料,查阅相关文献后初步筛选出最适SNP处理的浓度范围,在该SNP浓度范围处理下,核桃叶多酚及黄酮含量均在SNP浓度为150 μmol/L时达到最高,且该浓度下DPPH·和ABTS·清除能力达到最大值,分别为35.86、46.87 mg/g,抗氧化能力也最强;并且在该浓度下,SOD、POD、GST的活性也达到最高值。
有研究表明,在干旱胁迫下核桃幼苗叶面喷施SNP能通过提高干旱胁迫下叶片净光合速率与气孔导度、抗氧化酶活性等,减轻叶绿素含量的下降和活性氧、自由基的积累,由此加强对干旱胁迫下核桃幼苗的保护从而提高核桃抗旱性[26]。相昆等[8]研究发现,低温胁迫破坏了细胞的活性氧清除功能,过多的活性氧无法被清除,导致O2-和H2O2含量升高,MDA的积累过快;当外源NO处理核桃幼苗叶片后,活性氧下降,MDA储存减少,膜结构不被破坏,使细胞代谢正常,增强植株抗低温胁迫力。可见,基于核桃多酚类物质积累的特性,探究其逆境响应机理,具有良好的研究前景。
综上所述,对1年生‘香玲’核桃嫁接苗进行处理时,SNP的最适浓度为150 μmol/L。这为今后外源NO在核桃抗逆生产中的广泛应用提供了理论依据。同时,外源NO对核桃多酚物质积累及其抗氧化活性的影响,有利于揭示NO影响核桃抗逆的可能作用机制,进而推进寻找施加外源NO提高核桃抗逆的新方法。
