美洲黑杨杂交良种‘鲁林9号杨’离体再生体系的建立
2022-04-02王如月王雪菱李际红王冬月牛牧歌
王如月,王雪菱,李际红,王冬月,牛牧歌
(山东农业大学 林学院,山东 泰安 271018)
‘鲁林 9 号杨’(PopulusdeltoidesבLulin 9’)是山东省林业科学研究院以美洲黑杨L324杨(P.deltoides‘L324’)为母本,美洲黑杨T26杨(P.deltoids‘T26’)为父本,通过人工杂交选育出的雄性美洲黑杨杂交新品种、良种,具有速生、高抗、适应性强等特点,是我国华北地区主要的造林和园林绿化树种[1]。
杨树作为林木遗传育种中的模式树种[2],自1986年T.J.Parsons 等[3]首次证实可以进行遗传转化和表达外源基因以来,杨树的转基因研究已涉及抗虫、抗除草剂、木材材性改良、抗逆、抗病等方面,其中通过农杆菌介导法进行遗传转化是最常见的方法[4]。R.L.Yang等[5]利用农杆菌介导的方法将多个抗虫基因和抗盐基因转化杨树,从而开发出抗鳞翅目和鞘翅目害虫同时又具有一定的耐盐性的杨树新品种。朱伟康等[6]利用农杆菌介导叶盘法将雄性不育基因TA29-Barnase转化到转基因欧洲黑杨(P.nigra)中,从而获得雄性不育的抗虫性欧洲黑杨。
但目前农杆菌转化成功的基因型大多是欧洲山杨、银白杨、黑杨以及他们的杂交种,针对我国华北地区主栽的一些欧美杨和美洲黑杨优良无性系,其遗传转化体系还有待完善[7]。农杆菌介导法是利用植物的组织再生技术,使用携带目标基因的菌液侵染植物伤口从而获得转基因植株[8]。因此建立杨树的离体再生体系,对杨树品种的遗传改良具有重要的意义。目前关于杨树再生体系的构建已有大量相关报道[9-20]。由于黑杨不同类群之间具有明显的表型和生理特征差异[21],且之前对于黑杨派再生体系的研究较少[19],这也使得黑杨派新品种再生体系的构建存在一定难度。本研究以‘鲁林9号杨’无菌叶片和叶柄作为试验材料,研究杨树生长调节剂对叶片、叶柄直接诱导出芽和诱导生根的影响,旨在建立‘鲁林9号杨’的离体再生体系,为‘鲁林9号杨’的无性扩繁与生产利用做出贡献,同时也为美洲黑杨品种的遗传改良和分子生物育种研究等奠定基础。
1 材料与方法
1.1 供试材料
该试验所需的‘鲁林9号杨’试验材料是于4月在宁阳县高桥林场采集的健壮、无病虫害的1年生枝条,且每个枝条上都有待萌生的腋芽。将采集回来的枝条修剪成30~50 cm,置于光照培养箱中进行水培,培养温度为26 ℃,光照强度为2 000~3 000 lx,光照时间为16 h·d-1,待腋芽萌发长出嫩梢后进行后续试验。
1.2 试验方法
1.2.1 无菌试验材料的获取 取水培后获得的嫩梢,在流水下冲洗30 min,然后将其转移到超净工作台中,用75%的乙醇浸泡30 s,浸泡结束后用无菌水冲洗4~5次,再用0.1%的升汞浸泡15 min(每升0.1%的升汞中添加2~3滴的吐温-80),浸泡结束后用无菌水冲洗4~5次,摊开晾在无菌滤纸上吸干水分。用无菌剪刀将茎段修剪成1 cm,保证每个茎段带有1个或多个腋芽,然后接种于添加0.3 mg·L-16-BA和0.05 mg·L-1NAA的1/2 MS培养基中促进腋芽萌发。
1.2.2 ‘鲁林9号杨’叶片诱导不定芽培养基的筛选 设置6-BA 3个浓度(0.1、0.3、0.5 mg·L-1)、NAA 3个质量浓度(0.1、0.15、0.2 mg·L-1)共9个组合的培养基配方,待腋芽萌发并长至1~2 cm,取其叶片,垂直于主叶脉切3~4刀,然后将其叶片近轴面朝上分别接种到上述培养基中诱导不定芽。每个组合接种15片叶,每个组合设置3次重复。接种30 d后,观察统计在每个处理中叶片的诱导出芽率及诱导出的不定芽的数量。
1.2.3 ‘鲁林9号杨’叶柄诱导不定芽培养基的筛选 设置6-BA 3个质量浓度(0.3、0.5、0.7 mg·L-1)、NAA 3个质量浓度(0.1、0.15、0.2 mg·L-1)共9个组合的培养基配方,待腋芽萌发并长至1~2 cm,取其叶柄,将其剪成1 cm横放于上述培养基中诱导不定芽。每个组合接种15个叶柄,每个组合设置3次重复。接种35 d后,观察统计在每个处理中叶柄的诱导出芽率及诱导出的不定芽的数量。
1.2.4 ‘鲁林9号杨’不定芽诱导生根培养基的筛选 设置IBA 3个质量浓度(0.1、0.15、0.2 mg·L-1)、NAA 3个质量浓度(0.03、0.05、0.1 mg·L-1)共9个组合的培养基配方,待叶片和叶柄上诱导出的不定芽生长至1.5~2 cm,将其接种到上述培养基中诱导生根。每个组合接种15瓶,每瓶接种2棵不定芽,每个组合设置3次重复。接种15 d后,观察统计始生根时间、生根率、生根数量及根系的生长状态。
1.2.5 ‘鲁林9号杨’炼苗移栽 待诱导获得的生根苗生长到5 cm,选取生长健壮的幼苗,先在温室大棚的苗床上放置3~5 d,然后开盖放置2~3 d进行炼苗,炼苗结束后,将生根苗从瓶中取出,轻轻洗净根部的琼脂,移栽到温室的穴盘中,营养基质为草炭∶蛭石∶珍珠岩按体积比3∶2∶1配置而成。移栽前,用0.1%的多菌灵浸泡培养基质30 min,然后用清水冲洗多次,将残留的多菌灵冲洗干净。移栽后1周内用无纺布覆盖在穴盘上,之后将无纺布去除,进行正常的肥水管理,待幼苗长到20 cm可将其移栽到室外大田里。移栽15 d 后,观察统计移栽成活率。
1.3 培养条件
除特殊说明外,试验方法中的培养温度为(24±2)℃,光照强度为2 000~3 000 lx,光照时间为12 h·d-1。方法中所用的培养基中均添加6 g·L-1琼脂和30 g·L-1蔗糖,pH 5.8~6.2。
1.4 数据处理及分析
出芽率/%=诱导出芽的外植体数/接种的外植体数×100%;平均出芽数(个)=诱导出不定芽的总数/诱导出芽的外植体数;生根率/%=生根的不定芽数/接种的不定芽数×100%。平均生根数(个)=诱导出不定根的总数/生根的不定芽数;移栽成活率/%=成活植株数/移栽总植株数×100%。试验数据采用Microsoft Excel 2010进行整理统计,采用SPSS 19.0软件进行分析。
2 结果与分析
2.1 不同质量浓度的激素配比对‘鲁林9号杨’叶片诱导不定芽的影响
将萌发腋芽的叶片接种到9个组合的培养基上,30 d后观察‘鲁林9号杨’叶片诱导出不定芽的情况如表1所示。接种10 d时叶片出现卷曲,接种15 d时切口处膨大并出现芽点。接种30 d时观察发现,随着6-BA质量浓度的增加,叶片诱导出芽率呈现先上升后下降的趋势(图1)。当6-BA质量浓度为0.3 mg·L-1、NAA质量浓度为0.1 mg·L-1时接种叶片出芽率最高达100%,平均叶片诱导出的不定芽数量最多为10.83个(图1D);当6-BA质量浓度为0.5 mg·L-1、NAA质量浓度为0.2 mg·L-1时叶片诱导出芽率最低仅为11%,诱导出的不定芽数量最少仅为1个且叶片出现褐化(图1I)。由此可知,诱导‘鲁林9号杨’叶片产生不定芽的最适激素组合是0.3 mg·L-16-BA和0.1 mg·L-1NAA。
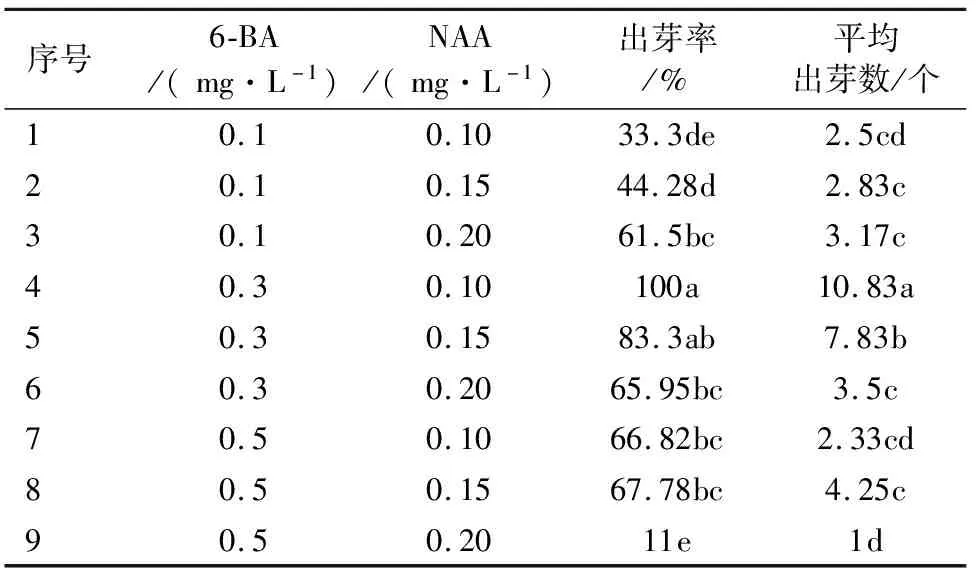
表1 不同质量浓度的激素配比对‘鲁林9号杨’叶片诱导不定芽的影响
2.2 不同质量浓度的激素配比对‘鲁林9号杨’叶柄诱导不定芽的影响
将萌发腋芽的叶柄接种到9个组合的培养基上,35 d后观察‘鲁林9号杨’叶柄诱导不定芽的情况如表2所示。接种20 d时观察发现叶柄两端切口处出现膨大,接种25 d时发现叶柄两端出现芽点,接种35 d后发现,在NAA质量浓度相同的情况下随着6-BA质量浓度的升高,叶柄诱导出芽率呈先上升后下降的趋势(图2)。当6-BA的质量浓度为0.5 mg·L-1,NAA的质量浓度为0.15 mg·L-1时,叶柄诱导出芽率最高为94%且诱导出的不定芽数量最多为5.67个,诱导出的不定芽叶片翠绿,生长状态最好(图2E),当6-BA的质量浓度增加至0.7 mg·L-1时,叶柄诱导分化率降低,且随着NAA质量浓度的增加,叶柄诱导出不定芽的数量逐渐降低,当NAA质量浓度增加到0.2 mg·L-1时,叶柄只有愈伤生长(图2I)抑制不定芽的产生。由此可知,‘鲁林9号’杨叶柄诱导不定芽的最适配方为6-BA的质量浓度为0.5 mg·L-1,NAA的质量浓度为0.15 mg·L-1。
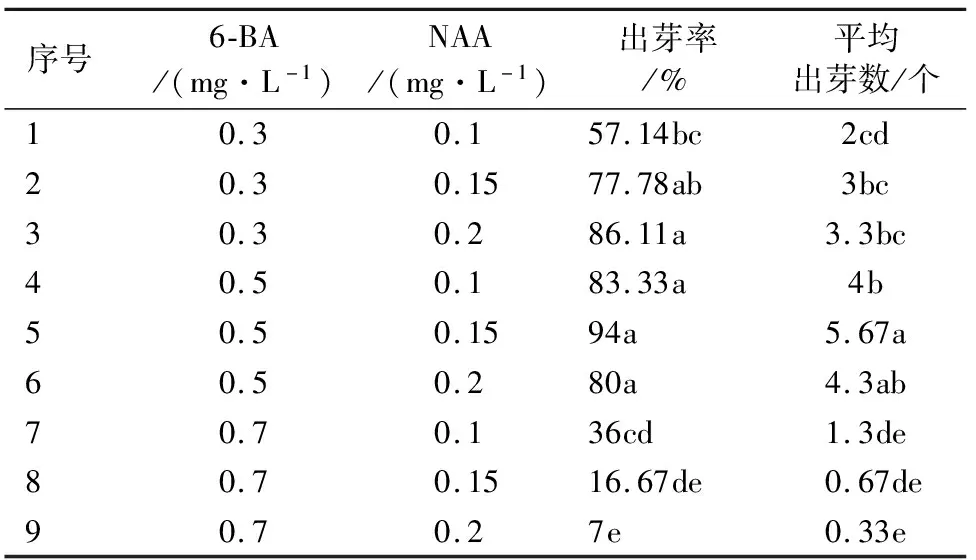
表2 不同激素配比对‘鲁林9号杨’叶柄诱导不定芽的影响
2.3 不同激素配比对‘鲁林9号杨’诱导不定芽生根的影响
待叶片和叶柄上诱导产生的不定芽生长至1.0~2 cm时,将其掰下接种到9个不同组合的培养基中,观察记录始生根时间,接种15 d后观察统计生根情况(表3,图3)。当IBA质量浓度为0.15 mg·L-1,NAA质量浓度为0.03 mg·L-1时,诱导生根率最高为95.2%,根系生长快,始生根时间最短仅为5 d,平均每株生根数量为5条,主根长且粗壮(图3D)。当IBA质量浓度为0.1 mg·L-1,NAA质量浓度为0.03 mg·L-1时,诱导生根率最低仅为36.3%,平均每株生根数量仅为1条,且始生根时间最晚为15 d,根部出现愈伤,抑制根的生长(图3A)。当IBA质量浓度升高至0.2 mg·L-1,NAA质量浓度升高为0.1 mg·L-1时,根部出现大面积愈伤,严重抑制了根的生长(图3I)。由此可知,诱导‘鲁林9号杨’不定芽生根的最适激素质量浓度为IBA质量浓度为0.15 mg·L-1,NAA质量浓度为0.03 mg·L-1。
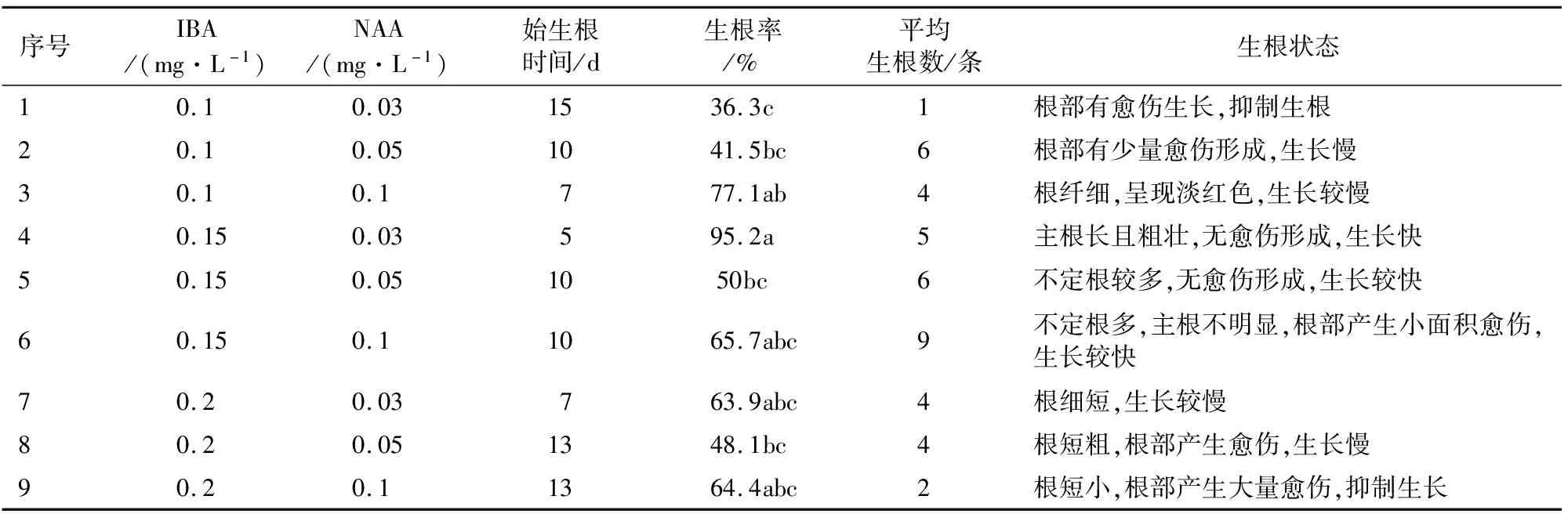
表3 不同激素配比对‘鲁林9号杨’不定芽诱导生根的影响
2.4 ‘鲁林9号杨’组培苗移栽
将生长到5 cm的健壮组培苗,在温室大棚的苗床上放置7~10 d,然后开盖放置2~3 d进行炼苗。炼苗结束后轻轻将根部的琼脂清洗干净,移栽到穴盘中,穴盘中的基质为草炭∶蛭石∶珍珠岩按体积比3∶2∶1配置而成(图4A)。移栽30 d后进行调查,成活率达95%(图4B)。
3 结论与讨论
本研究以‘鲁林9号杨’无菌叶片和叶柄作为试验材料,建立了‘鲁林9号杨’完整的离体再生体系,确定了叶片诱导不定芽的最佳培养基为1/2 MS+0.3 mg·L-16-BA+0.15 mg·L-1NAA,叶片诱导分化率可达100%,平均分化不定芽数达10.83个;叶柄诱导不定芽的最佳培养基为1/2 MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA,叶柄诱导分化为94%,平均分化不定芽数可达5.67个;最佳生根培养基为1/2 MS+0.15 mg·L-1IBA+0.03 mg·L-1NAA,始生根时间5 d,生根率可达95.2%。组培苗炼苗成活率达95%。
杨树的组织培养通常通过愈伤、器官、原生质体等途径进行苗木的再生[22]。愈伤组织诱导易,但再分化时间长,有变异发生,亲本性状的稳定性受限[23]。汪玲等[16]、贾庆彬等[17]在‘725 杨’(P.deltoidescl.‘725’)组培繁殖研究中,叶片接种30 d时诱导获得愈伤组织,愈伤组织接种50 d后其诱导分化率仅为77.71%。在本研究中,在接种30 d时‘鲁林9号杨’叶片诱导分化率即可达100%,平均分化不定芽数为10.83个。康薇等[18]利用美洲黑杨‘中嘉8号杨’(P.deltoides(I-63×I-6))叶片直接诱导分化不定芽,在接种25 d时不定芽诱导分化率达85%,这与我们的研究结果相似。由此可见,利用杨树器官诱导成芽不仅能缩短培育时间,而且诱导分化率高,能够获得性状稳定一致优良苗木。
激素种类及其质量浓度配比也是杨树再生的关键因素[21]。沈周高等[24]发现,当6-BA∶NAA比值在2~5时,有利于中林2001杨(P.deltoidescv.‘zhonglin-2001’)、南林95杨(P.deltoidsBartr.cv.Lux×P.euramericana(Dode)Guineir cv.I-45/51)、南抗杨(P.deltoidescl.Nankang)叶片不定芽的分化。在本研究中,当6-BA与NAA的质量浓度比值等于3时,叶片的诱导分化率为100%且诱导产生的不定芽数量最多达到10.83个;当6-BA与NAA的质量浓度比值等于2.5时,叶片诱导分化率非常低仅为11%且叶片出现褐化的现象。当6-BA的质量浓度与NAA的质量浓度比为10∶3时,叶柄诱导分化率可达94%,诱导产生的不定芽最多,为5.67个,且不定芽生长状态良好;当6-BA的质量浓度与NAA的质量浓度比值升高至3.5时,叶柄伤口处诱导产生大量愈伤从而抑制不定芽的产生。因此6-BA与NAA的质量浓度比值在3时,有利于不定芽的诱导。
