微小RNA-338-3p调控信号转导和转录激活因子1对表皮生长因子受体酪氨酸激酶抑制剂耐药肺癌细胞株PC-9/GR中程序性死亡配体1表达和细胞凋亡的影响
2022-04-02朱洪宇史志敏
朱洪宇, 史志敏
(南京医科大学附属苏州科技城医院 放疗科, 江苏 苏州, 215010)
肺癌目前是中国发病率、死亡率最高的恶性肿瘤, 5年生存率低于18%[1]。非小细胞肺癌(NSCLC)在肺癌中占比为85%, 其治疗方式主要有手术、化放疗、靶向药物治疗等[2]。研究[3]发现,多数NSCLC患者存在表皮生长因子受体(EGFR)基因突变,且EGFR合并肿瘤抑制基因共同突变的患者往往预后不良。EGFR酪氨酸激酶抑制剂(EGFR-TKI)是EGFR突变NSCLC患者的首选治疗方案,但治疗一段时间后会出现耐药现象,影响预后[4]。
微小RNA(miRNA)是广泛参与机体各种生命活动的单链小分子非编码RNA, 其在肿瘤中的差异表达及在肿瘤细胞增殖、凋亡、侵袭、化疗抵抗、耐药等方面的调控作用已被广泛报道[5-7]。研究[8-9]发现, miR-338-3p在肺癌等多种肿瘤中表达下调,有望成为NSCLC治疗的潜在靶点。研究[10]显示, miR-338-3p可通过EGFR信号通路抑制NSCLC细胞增殖、迁移及侵袭,但对NSCLC细胞出现EGFR-TKI耐药的作用研究较少。本研究探讨miR-338-3p对EGFR-TKI吉非替尼耐药的肺癌细胞株PC-9/GR凋亡及程序性死亡配体1(pPD-L1)表达的影响,并初步分析其作用机制。
1 材料与方法
1.1 试剂与仪器
人肺腺癌细胞株PC-9及其吉非替尼耐药细胞株PC-9/GR(货号YS2301C、YS3629C)购自美国ATCC; RPMI-1640培养液(货号CP680110A)购自上海冠导生物工程有限公司; 吉非替尼、Annexin V-FITC/PI凋亡检测试剂盒、信号转导和转录激活因子1(STAT1)抑制剂Fludarabine(货号JKLN007404a、JKMK1417B、JKLN020840)购自上海经科化学科技有限公司; MTT溶液(货号JK3297)购自上海晶抗生物工程有限公司; miR-338-3p NC、miR-338-3p模拟物及miR-338-3p、U6引物购自柏业贸易(上海)有限公司; 兔抗p-STAT1、兔抗STAT1、兔抗PD-L1、兔抗Bcl-2、兔抗Bax、兔抗GAPDH、羊抗兔二抗(货号ab109461、ab210524、ab243877、ab196495、ab232479、ab181603、ab133470)购自美国abcam。NAPCO-8800型培养箱购自美国Shellab; MODEL550型酶标仪、GS-800型凝胶扫描成像系统购自美国Bio-Rad; Lightcycler 480II型荧光定量PCR仪购自德国Roche; CytoFLEX型流式细胞仪购自美国Beckman coulter。
1.2 方法
1.2.1 细胞培养与分组: PC-9细胞、PC-9/GR细胞复苏后接种于含10%胎牛血清的RPMI-1640培养液,放入37 ℃、5% CO2细胞培养箱中,生长至覆盖培养瓶80%面积,弃培养液,用0.25%胰蛋白酶消化,显微镜下观察到细胞回缩变圆后终止消化,吹打为单细胞并更换新鲜培养液重悬,按1∶2比例分瓶传代。
取传代3次的对数生长期PC-9、PC-9/GR细胞,按2×104个/mL接种于细胞培养板,分别加0、0.25、0.5、1、2、4、8 μmol/L吉非替尼,检测细胞增殖情况,以确定吉非替尼用量。此外,传代3次的对数生长期PC-9、PC-9/GR细胞按2×104个/mL接种于细胞培养板培养后,检测细胞中miR-338-3p表达。
将PC-9/GR细胞分为对照组、miR-338-3p NC组、miR-338-3p组和STAT1抑制剂组。其中miR-338-3p NC组、miR-338-3p组、STAT1抑制剂组细胞贴壁后,分别转染miR-338-3p NC、miR-338-3p模拟物和miR-338-3p模拟物,培养48 h后采用实时荧光定量聚合酶链反应(qRT-PCR)检测转染效果,之后4组均在培养液中加1 μmol/L吉非替尼, STAT1抑制剂组同时加100 μmol/L的STAT1抑制剂Fludarabine,细胞继续培养,进行后续实验。
1.2.2 qRT-PCR检测细胞中miR-338-3p表达:细胞培养48 h, 使用TRIzol提取细胞总RNA并检测其浓度、纯度,以RNA为模板行逆转录合成cDNA后进行qRT-PCR反应,用荧光定量PCR仪检测,U6为内参基因, miR-338-3p表达结果以2-△△Ct法表示。miR-338-3p上游引物: 5′-GTCAGTTCCAGCATCAGTGATT-3′, 下游引物: 5′-GTGCAGGGTCCGAGGT-3′; U6上游引物: 5′-GCTCGCTTCGGCAGCACA-3′, 下游引物: 5′-GAGGTATTCGCA CCAGAGGA-3′。
1.2.3 MTT法检测细胞增殖:细胞培养48 h, 每孔加10 μL MTT溶液,培养4 h, 弃上清,每孔加150 μL DMSO, 震荡5 min, 用酶标仪检测490 nm波长处吸光度(OD)值,计算增殖率(%)=OD实验组/OD对照组×100%。
1.2.4 流式细胞仪检测细胞凋亡:细胞培养48 h, 收集后按照Annexin V-FITC/PI凋亡试剂盒说明书进行处理,避光孵育15 min, 使用流式细胞仪进行检测。
1.2.5 蛋白印迹(WB)法检测细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达情况:细胞培养48 h, 收集细胞,使用RIPA裂解液提取总蛋白,BCA法定量。取20 μg蛋白样本, 95 ℃水浴5 min使蛋白变性,上样,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转移目的蛋白至聚偏二氟乙烯(PVDF)膜,用封闭液封闭1.5 h, 放入一抗(兔抗p-STAT1、兔抗STAT1、兔抗PD-L1、兔抗Bcl-2、兔抗Bax、兔抗GAPDH)稀释液(均1∶1 500)中孵育过夜,放入羊抗兔二抗(辣根过氧化物酶标记)稀释液(1∶2 000)中室温孵育1 h, 化学发光法显色,凝胶扫描成像系统扫描图像,分析条带灰度值。目的蛋白表达量以目的蛋白与GAPDH灰度值的比值表示。
1.3 统计学分析
2 结 果
2.1 PC-9细胞、PC-9/GR细胞在不同浓度吉非替尼作用下的增殖率
随着吉非替尼浓度逐渐升高, PC-9细胞、PC-9/GR细胞的增殖率呈逐渐降低趋势(P<0.05); 当吉非替尼浓度升高至1.00 μmol/L时, PC-9细胞与PC-9/GR细胞增殖率比较,差异有统计学意义(P<0.05)。故后续实验均采用1.00 μmol/L作为吉非替尼的处理浓度。见表1。
表1 不同浓度吉非替尼作用下PC-9细胞、PC-9/GR细胞的增殖率比较
2.2 PC-9细胞、PC-9/GR细胞中miR-338-3p表达情况
与PC-9细胞miR-338-3p表达水平(1.00±0)相比, PC-9/GR细胞中miR-338-3p表达水平(0.84±0.12)降低,差异有统计学意义(t=3.266,P=0.008)。
2.3 转染后PC-9/GR细胞miR-338-3p表达情况
对照组与miR-338-3p NC组的miR-338-3p表达水平比较,差异无统计学意义(P>0.05); 与对照组、miR-338-3p NC组相比, miR-338-3p组、STAT1抑制剂组的miR-338-3p表达水平均升高,差异有统计学意义(P<0.05); miR-338-3p组与STAT1抑制剂组的miR-338-3p表达水平比较,差异无统计学意义(P>0.05)。见表2。
表2 转染后PC-9/GR细胞miR-338-3p表达水平比较
2.4 各组PC-9/GR细胞增殖情况
对照组与miR-338-3p NC组的PC-9/GR细胞增殖率比较,差异无统计学意义(P>0.05); 与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞增殖率降低,差异有统计学意义(P<0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞增殖率升高,差异有统计学意义(P<0.05)。见表3。
表3 各组PC-9/GR细胞增殖率比较
2.5 各组PC-9/GR细胞凋亡情况
对照组与miR-338-3p NC组的PC-9/GR细胞凋亡率比较,差异无统计学意义(P>0.05); 与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞凋亡率升高,差异有统计学意义(P<0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞凋亡率降低,差异有统计学意义(P<0.05)。见图1、表4。
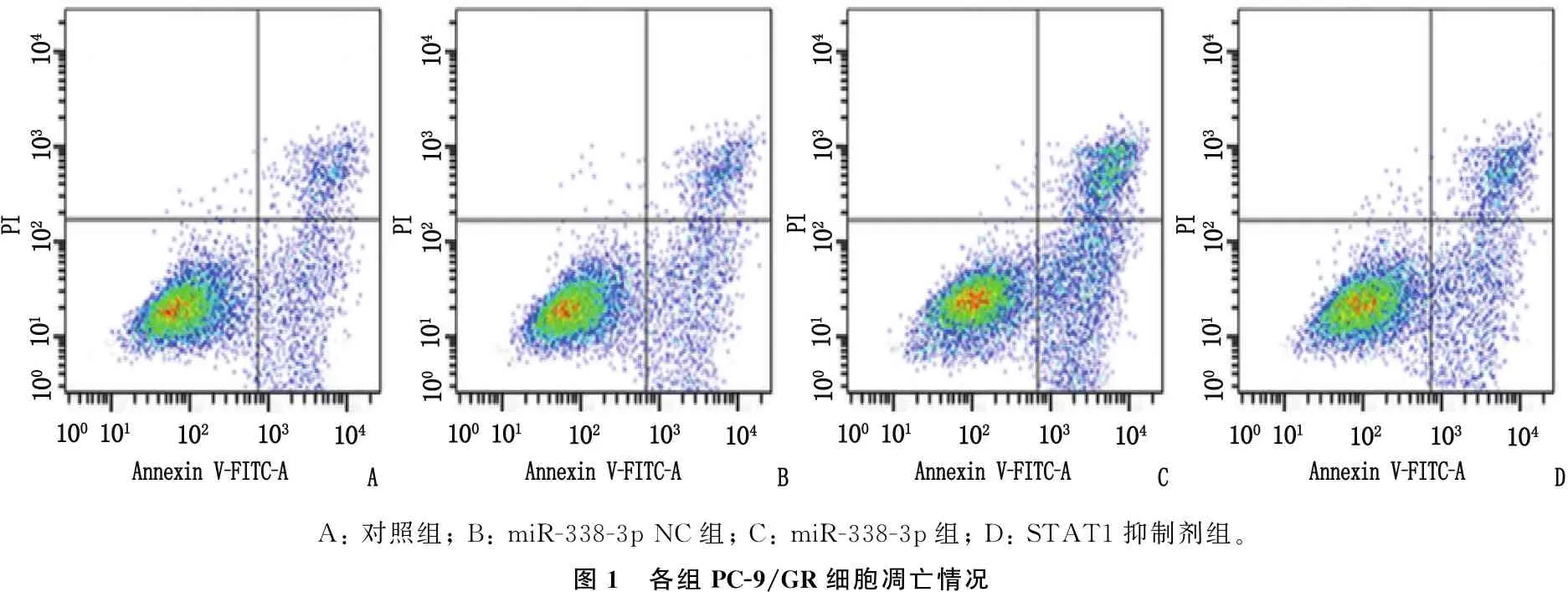
A: 对照组; B: miR-338-3p NC组; C: miR-338-3p组; D: STAT1抑制剂组。图1 各组PC-9/GR细胞凋亡情况
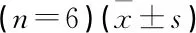
表4 各组PC-9/GR细胞凋亡率比较
2.6 各组PC-9/GR细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达情况
对照组与miR-338-3p NC组的PC-9/GR细胞中p-STAT1/STAT1、PD-L1、Bcl-2、Bax蛋白表达水平比较,差异无统计学意义(P>0.05); 与miR-338-3p NC组相比, miR-338-3p组PC-9/GR细胞中p-STAT1/STAT1、Bax蛋白表达水平升高, PD-L1、Bcl-2蛋白表达水平降低,差异有统计学意义(P<0.05); 与miR-338-3p组相比, STAT1抑制剂组PC-9/GR细胞中p-STAT1/STAT1、Bax蛋白表达水平降低, PD-L1、Bcl-2蛋白水平升高,差异有统计学意义(P<0.05)。见图2、表5。
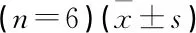
表5 各组PC-9/GR细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达水平比较
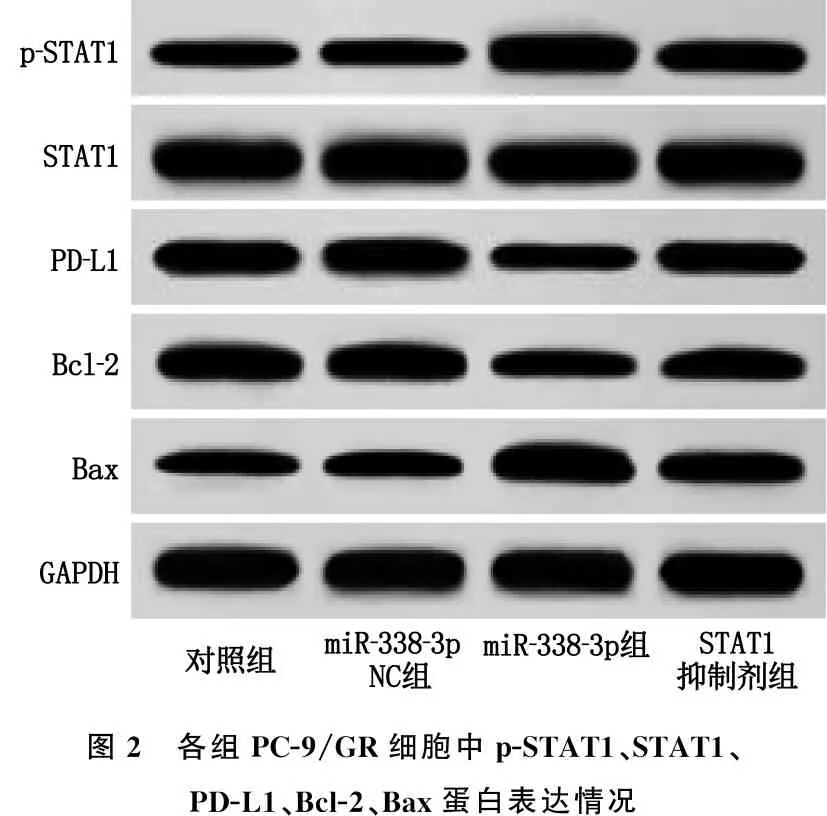
图2 各组PC-9/GR细胞中p-STAT1、STAT1、PD-L1、Bcl-2、Bax蛋白表达情况
3 讨 论
肺癌是全球肿瘤相关死亡的主要原因,近年来其发病率不断升高。EGFR是原癌基因c-erb B1的表达产物,属于酪氨酸激酶受体,在多种肿瘤中高表达[11]。研究[12-13]发现,存在EGFR突变的亚洲肺癌患者占50%, 这部分人群体内肺癌细胞增殖、生长依赖于突变的EGFR, 用EGFR-TKI对其进行治疗,临床疗效较好,但治疗1年内均会出现获得性耐药。故解决EGFR-TKI耐药问题是肺癌治疗方面比较棘手的问题。吉非替尼是第一代EGFR-TKI, 本研究通过设置吉非替尼浓度梯度,检测PC-9细胞、PC-9/GR细胞的增殖率,最终选择1.00 μmol/L作为后续实验中PC-9/GR细胞的吉非替尼用药浓度。
研究[14-15]表明, miRNA在肿瘤组织中异常表达,发挥促癌或抑癌基因的作用,参与肿瘤发生及进展。由于miRNA具有肿瘤病理的特异性,常被认为可作为一种新型靶点用于肿瘤的靶向治疗。研究[16]显示, miRNA不仅可介导肿瘤细胞增殖、凋亡、迁移等生物学行为,在肿瘤发生放化疗抵抗、耐药等过程中亦发挥重要作用。miR-338-3p是miR-338家族成员,在食道癌、头颈部鳞状细胞癌、肾嫌色细胞癌、肾乳头状肾细胞癌、肺鳞癌及甲状腺癌中表达显著下调,而在肝细胞癌、结肠腺癌及肾透明细胞癌中表达显著上调[17-18]。本研究发现, PC-9/GR细胞中miR-338-3p表达水平较PC-9细胞显著降低,提示miR-338-3p在EGFR-TKI耐药的PC-9细胞中差异表达,其低表达可能参与PC-9细胞发生EGFR-TKI耐药的机制。通过转染miR-338-3p模拟物,上调miR-338-3p在PC-9/GR细胞中的表达水平后, PC-9/GR细胞增殖率显著降低,凋亡率显著升高,细胞中Bcl-2家族促凋亡成员Bax蛋白表达水平显著升高,抑凋亡成员Bcl-2蛋白水平[19]显著降低,提示上调miR-338-3p可一定程度逆转PC-9/GR细胞的EGFR-TKI耐药,抑制细胞增殖,并诱导细胞凋亡。PD-L1是在多种肿瘤细胞表面高表达的因子,可帮助肿瘤细胞发生免疫逃逸,其高表达往往与肿瘤预后不良呈正相关[20-22]。上调miR-338-3p表达后, PC-9/GR细胞中PD-L1表达水平显著降低,提示miR-338-3p可能抑制PC-9/GR细胞发生免疫逃逸,进而促进细胞凋亡。
STAT1是一种信号传导与转录活化因子蛋白,能从各个角度参与对细胞生长、分化、存活及凋亡的调控,目前多被认为是肿瘤抑制因子[23-24]。孙思博等[25]研究表明, STAT家族成员在NSCLC获得性耐药过程中发挥重要作用。本研究显示, miR-338-3p表达上调后, PC-9/GR细胞中p-STAT1/STAT1蛋白表达水平显著升高,提示STAT1激活参与miR-338-3p逆转PC-9/GR细胞的EGFR-TKI耐药过程。在miR-338-3p表达上调基础上,加入STAT1抑制剂抑制STAT1激活后, miR-338-3p表达无显著变化,细胞增殖率显著升高,凋亡率显著降低,细胞中Bax蛋白表达水平显著降低, PD-L1、Bcl-2蛋白表达水平显著升高,进一步提示miR-338-3p逆转PC-9/GR细胞的EGFR-TKI耐药过程可能与激活STAT1有关。
综上所述, miR-338-3p表达上调可激活STAT1, 抑制EGFR-TKI耐药肺癌细胞株PC-9/GR细胞中PD-L1表达,并诱导细胞凋亡,这可能为临床解决EGFR-TKI耐药问题提供理论依据。
