血清ProGRP、PGI水平对胃息肉患者内镜下黏膜切除术后复发的影响
2022-04-02严斌朱俊江吴佳健赣南医学院第三附属医院江西赣州341000
严斌,朱俊江,吴佳健(赣南医学院第三附属医院,江西 赣州 341000)
胃息肉因胃黏膜上皮或腺体过度增生形成,起源于黏膜上皮细胞局限性、良性隆起病变,是胃镜检查中最常见的一种病变[1]。研究显示,亚洲国家胃息肉以胃底腺息肉和增生性息肉为主[2]。其中约有2%-19%增生性息肉出现异型增生,0.6%-2%并发胃癌[3]。胃息肉早期发病表现不具有特异性,仅以腹痛、腹胀等症状为主,患者不易察觉,在合并胃溃疡、胃糜烂等疾病时,可表现为上消化道出血,主要以抗幽门螺旋杆菌、内镜止血等方式进行治疗。其中内镜下黏膜切除术(EMR)为最常见治疗方式,但出院后仍有部分患者复发,进而恶化,加重病情发展,影响疾病预后,使患者生命健康受损[4-5]。因此,寻找与胃息肉EMR术后复发的相关因素具有重要意义。为此,本研究回顾性分析2018年10月-2019年10月于我院进行EMR治疗的60例胃息肉患者临床资料,研究血清胃泌素释放肽前体(ProGRP)、胃蛋白酶原I(PGI)水平对胃息肉患者内镜下黏膜切除术(EMR)后复发的影响,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018年10月-2019年10月于我院进行EMR治疗的60例胃息肉患者临床资料,根据术后2年内患者是否复发分为对照组(n=31)与复发组(n=29)。纳入标准:①经病理检查和胃镜检查确诊为胃息肉者;②完成EMR手术者;③研究前一周未服用影响本研究药物者;④临床资料完整者,本研究经我院医学伦理委员会批准且患者及家属自愿参与并签署知情同意书。
排除标准:①既往有胃癌、胃部其他手术史者;②胃镜检查及病理检查出现癌变者;③伴幽门螺旋杆菌感染者;④伴严重并发症者;⑤伴严重心、肺、肝、肾疾病者;⑥近1个月内接受质子泵抑制剂、铋剂、抗生素等药物治疗影响本研究者。
1.2 方法 统计两组年龄、性别、病理类型、息肉部位、吸烟史、饮酒史等一般资料。血清胃泌素释放肽前体(ProGRP)采用化学发光法检测,血清胃蛋白酶原I(PGI)采用化学酶联免疫吸附法进行测定。
1.3 观察指标 ①比较两组一般资料;②比较两组血清ProGRP、血清PGI水平。
1.4 统计学方法 采用SPSS23.0统计学软件进行数据处理,计数资料以[n(%)]表示,采用χ2检验;全部计量资料均通过Shapiro-Wilk正态性检验,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验;偏态分布的计量资料采用中分位数间距[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验;经Logistic回归分析,检验血清ProGRP、血清PGI水平对胃息肉患者EMR术后复发的影响;绘制受试者工作曲线(ROC),并计算曲线下面积(AUC),以检验血清ProGRP、血清PGI水平预测胃息肉患者EMR术后复发的影响风险价值,AUC值>0.9表示预测性能较高,0.71-0.90表示有一定预测性能,0.5-0.7表示预测性能较差;以P<0.05表示差异有统计学意义。
2 结果
2.1 胃息肉患者EMR术后复发单因素分析 两组年龄、性别、病理分型、息肉部位、吸烟史及饮酒史比较,无明显差异(P>0.05);复发组血清ProGRP、血清PGI水平均显著高于对照组(P<0.05)。见表1。
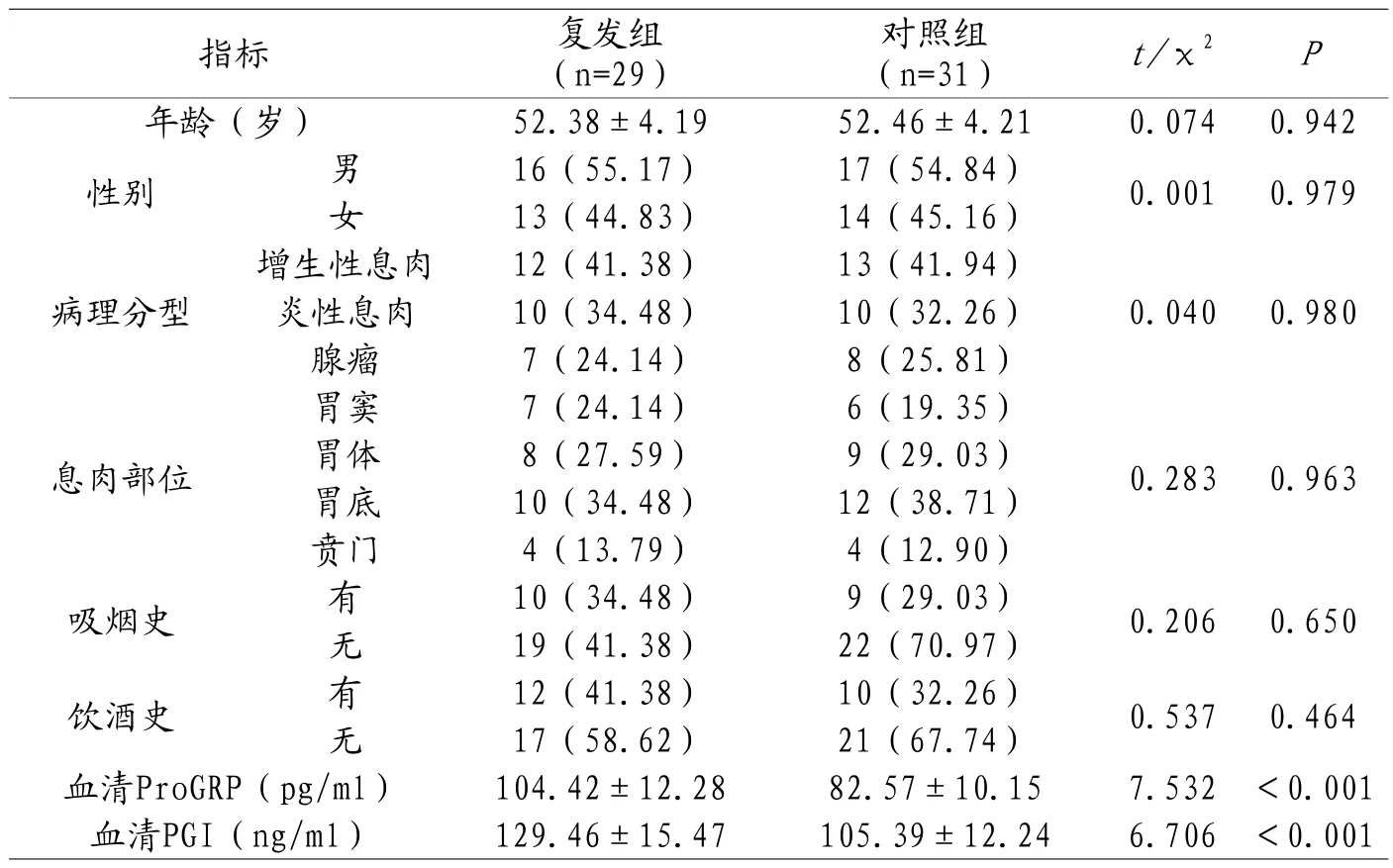
表1 胃息肉患者EMR术后复发单因素分析
2.2 胃息肉患者EMR术后复发多因素分析 以单因素分析中P<0.001的指标(血清ProGRP、血清PGI)为自变量,纳入Logistic回归分析中,以胃息肉患者EMR术后复发为因变量,结果显示血清ProGRP、血清PGI是胃息肉患者EMR术后复发的独立危险因素。见表2。
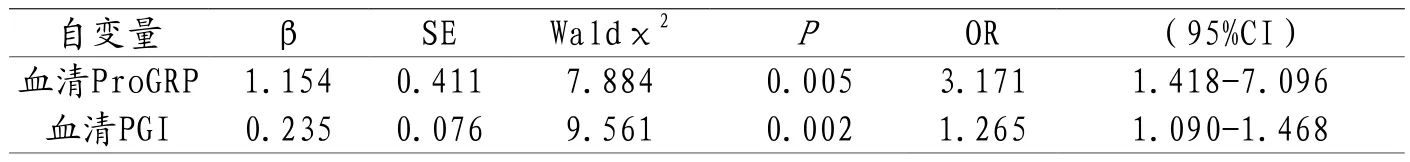
表2 胃息肉患者EMR术后复发的Logistic多因素分析
2.3 血清ProGRP、血清PGI水平预测胃息肉患者EMR术后复发价值分析 分别绘制血清ProGRP、血清PGI水平预测预测胃息肉患者EMR术后复发价值的ROC曲线,结果显示AUC分别为0.935、0.861(P<0.05)。见表3、图1。
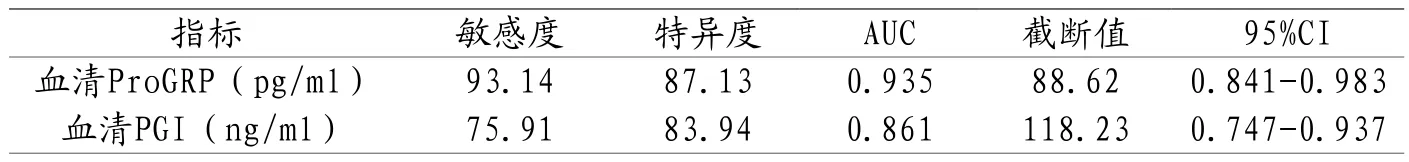
表3 血清ProGRP、血清PGI预测胃息肉患者EMR术后复发价值分析
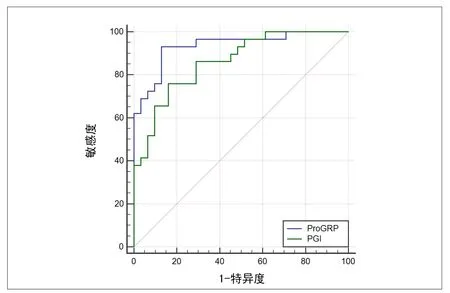
图1 血清ProGRP、血清PGI预测胃息肉患者EMR术后复发价值的ROC曲线
3 讨论
胃息肉被视为胃癌的癌前病变,据统计,胃癌是全球排名第四的常见恶性肿瘤,占据癌症致死率第2位[6]。血清学检查具有安全、方便、易被人们接受的优点,ProGRP是胃泌素释放肽基因编码的产物,能准确表达胃泌素释放肽水平;血清胃蛋白酶原(PG)包括PGI和PGII两种亚型,能反映胃黏膜腺体与细胞数目[7]。
本研究通过对复发组与对照组相关指标进行比较,并进一步对存在显著差异指标行Logistic回归分析。显示胃息肉患者EMR术后复发的独立危险因素包括:①血清ProGRP水平。ProGRP是胃泌素释放肽基因编码产物,胃泌素释放肽是一种分泌性细胞因子,是一种胃肠类蛙皮素样激素,分布于机体胃肠道、呼吸道及肺组织中[8]。胃泌素释放肽半衰期较短,因此在临床检测中常通过检测ProGRP表达胃泌素释放肽水平。胃窦G细胞分泌、合成胃泌素,促进胃酸产生,使胃黏膜上皮细胞增殖、分化、形成血管,抑制细胞凋亡,维护胃黏膜完整性[9]。Jeong[10]等研究表明,胃息肉患者血清胃泌素水平显著升高。胃泌素释放肽具有刺激胃窦G细胞分泌胃泌素作用,使胃黏膜上皮细胞异常增殖、分化等,引起胃腺体扩张,形成息肉。②血清PGI:生理状态下,消化系统通过分泌各种胃肠激素维持胃肠道吸收、分泌、运动等功能平衡,而机体内外环境异常状况下,可引起胃肠激素分泌异常,进而影响消化系统功能出现疾病[11]。血清胃蛋白酶原为胃蛋白酶无活性前体,分为PGI、PGII两种亚型,PGI主要由胃底腺黏液细胞和主细胞合成,合成后的大部分PGI进入胃内,在酸性胃液作用下水解食物中的蛋白质,少部分PGI穿过胃黏膜进入血液循环,且维持稳定状态[12]。因此,血清PGI水平变化可表达胃黏膜形态及分泌状况。Gomes[13]等研究显示,胃息肉的出现与幽门螺旋杆菌感染有关。幽门螺旋杆菌通过生成尿素酶,促进尿素形成“氨云”来保护自身在高浓度的酸性环境下生存,同时促进各种致病因子产生,破坏胃黏膜,刺激机体产生白细胞三烯等炎性因子,引起炎症反应,刺激胃黏膜,导致胃黏膜上皮细胞间隙与血管通透性增加,使释放到血液循环中的PGI增多;同时炎症刺激使胃内糜烂处腺体数目增多,腺颈部延伸,引发胃黏膜增生进而隆起,出现息肉[14-15]。同时,本研究通过绘制血清ProGRP、血清PGI预测胃息肉患者EMR术后复发价值的ROC曲线,结果显示AUC分别为0.935、0.861,表明血清ProGRP、血清PGI对胃息肉患者术后复发具有较好的预测价值。
综上所述,血清ProGRP、血清PGI是胃息肉患者EMR术后复发的独立危险因素,血清ProGRP、血清PGI对胃息肉患者EMR术后复发具有较好的预测价值,可在临床推广使用。
