绵羊MYF6基因多态性对胴体瘦肉性状的影响
2022-04-01鲁玉洁周辉通王继卿黄兆春梁维炜甄慧敏罗玉柱李少斌
鲁玉洁,周辉通,2,柯 娜,王继卿,黄兆春,梁维炜,甄慧敏,罗玉柱,刘 秀,李少斌
(1 甘肃农业大学 动物科学技术学院,甘肃省草食动物生物技术重点实验室,甘肃省牛羊基因改良工程实验室,甘肃 兰州 730070;2 新西兰林肯大学 农业与生命科学学院,新西兰 林肯 7647)
胴体性状是绵羊育种和生产中的一个重要性状,显著影响绵羊的养殖效益。研究发现,肌纤维数量和大小是影响绵羊产肉性能的关键因素[1]。在出生前后,动物肌纤维的发育有明显差异,在胚胎时期,肌纤维数量大量增加;个体出生后,肌纤维数量维持不变,但直径显著增大,导致个体产肉量不断提高[2]。肌卫星细胞是一种肌源性干细胞,在其发育为肌管的过程中,受到生肌调节因子家族(myogenic regulatory factors,MRFs)的影响[3],生肌因子6(myogenic factor 6,MYF6)是其中的一员,MYF6基因由3个外显子组成[4]。
MYF6基因在肌肉发生、肌管和肌纤维肥大等过程中发挥着重要作用[5-6]。敲除MYF6基因后,小鼠出现肌肉发育延迟、功能不全等现象[7]。另外,MYF6基因在小鼠胚胎期第16天(此时肌管大量分化)高度表达,说明该基因具有促进肌管分化的作用[8]。除此之外,MYF6对动物出生后肌肉的生长发育也至关重要,Yin等[9]发现,在肌纤维直径较大的鸡上,MYF6基因表达量显著上调,这表明该基因可促进鸡肌纤维的发育。
MYF6基因的变异会显著影响畜禽的产肉能力。Wyszynska-Koko等[10]研究发现,MYF6基因的c.-335 T>C突变与波兰大白猪的右半胴体质量显著相关(P<0.05)。贾伟德[11]研究发现,黄牛MYF6基因的131 T>G突变会影响肌内脂肪含量等肉品质性状(P<0.05)。MYF6基因的核苷酸序列变异也显著影响着鹅[12]、鸭[13]等动物肌肉的生长发育和肉的品质。目前,学者们已研究了绵羊MYF6基因的甲基化水平[14]及其在肌肉中的表达量[15]和其对绵羊部分屠宰性状[1]的影响(P<0.05),但尚未见关于其对绵羊胴体瘦肉性状影响的研究报道。
本研究采用PCR-SSCP和测序等技术,检测了第1外显子和5′UTR区域的多态性,分析了序列变异对绵羊腰部瘦肉量等7种肌肉性状的影响,并研究了MYF6基因在绵羊背最长肌等8个组织中的表达特征,以期为绵羊胴体性状的改良提供有效的分子遗传标记。
1 材料与方法
1.1 罗姆尼羊胴体性状数据和基因DNA的采集
以13只产肉性能优良的罗姆尼公羊作为父本,采用人工授精技术与罗姆尼经产母羊进行配种。在所产后代羔羊中,挑选215只出生日期接近的公羔,详细记录其耳号、初生体质量和出生等级(单羔、双羔或多羔)。
用VIASCAN(Video Imaging Analysis System,VIASCAN)仪器测量羔羊胴体瘦肉率的精确度(达0.52)远高于传统的热胴体质量和GR值预测法(精确度均为0.19),该方法还具有稳定性高、节省人力、可预测脂肪深度等优点,在自动化预测产肉量方面具有巨大潜力[16]。本研究选取12周断奶羔羊,称取体质量后立即屠宰,用VIASCAN仪器测定其肩部、腰部和后腿3个部位的瘦肉量(以瘦肉质量占胴体质量的百分比表示),计算总瘦肉量(3个部位瘦肉量之和)及这3个部位瘦肉量占总瘦肉量的比例(瘦肉率)[17]。羔羊屠宰前采集血液,提取DNA[18],用于后续试验。
1.2 引物设计与合成
根据GenBank中绵羊MYF6基因序列(GenBank登录号:NM_001134782.1),设计3对特异性引物P1、P2和P3(表1),其中P1和P2引物分别用于扩增MYF6基因的第1外显子(556 bp)和5′UTR(476 bp)区域,P3引物用于MYF6基因在各组织中表达水平的实时荧光定量PCR(RT-qPCR)检测,内参基因为β-actin。试验所用引物及其序列见表1。
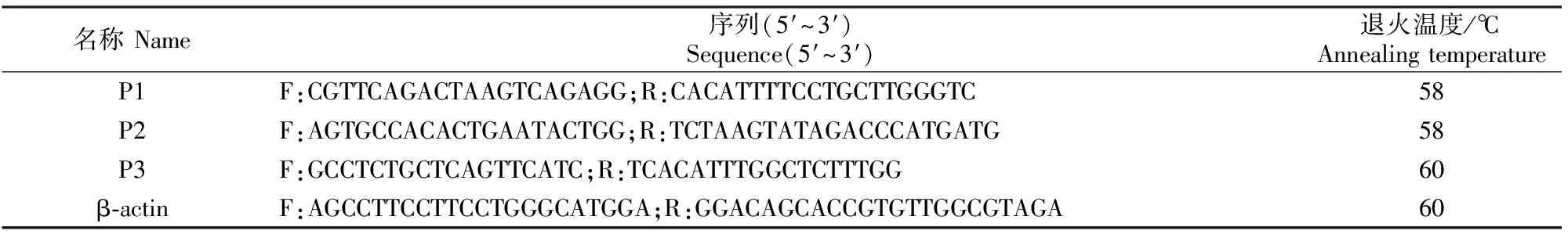
表1 试验所用的引物信息Table 1 Primers used in the study
1.3 MYF6基因第1外显子和5′UTR多态性的PCR-SSCP分析
PCR扩增MYF6基因第1外显子和5′UTR。反应体系为:预混酶(10 U/μL)10 μL,上、下游引物(0.25 μmol/L)各0.8 μL,血液DNA(100 ng/μL) 0.8 μL, ddH2O 7.6 μL。PCR反应参数为:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸5 min,降温至4 ℃结束。
取PCR扩增产物0.7 μL,加SSCP变性缓冲液7 μL,在PCR仪上于100 ℃条件下变性6 min之后,迅速点样于聚丙烯酰胺凝胶中,在Bio-Rad(Bio-Rad,Hercules,CA,USA)的Protean Ⅱ xi系统中进行电泳。第1外显子的电泳条件为:12%凝胶、14 ℃、390 V电泳18 h;5′UTR的电泳条件为:14%凝胶、25 ℃、200 V电泳18 h。对凝胶进行银染显色[19],读取样本的基因型。
1.4 等位基因序列测定
根据基因型,选择适宜的方法测序:对于纯合子,直接进行Sanger测序;对于杂合子(无纯合子个体),则按照Gong等[20]建立的方法切取其中的纯合型条带进行测序。试验设3个生物学重复,以保证结果的可靠性。
用DNAMAN(V.5.2.10)比对MYF6等位基因间核苷酸序列的差异,用POPGENE软件(V.3.2)计算MYF6基因第1外显子和5′UTR区域的等位基因频率、基因型频率、χ2值(Hardy-Weinberg平衡性检验)。
1.5 MYF6基因多态性对羔羊胴体性状的影响
采用SPSS20.0软件的一般线性混合效应模型(general liner mixed-effect models,GLMMs),分析第1外显子基因型对公羔后腿、腰部、肩部瘦肉量及瘦肉比例和总瘦肉量等7个瘦肉性状的影响。由于父本和初生体质量影响了羔羊的瘦肉性状(P<0.01),因此在该模型中,将父本和初生体质量作为随机效应。由于所有羔羊均饲养于同一农场(饲养条件一致),因此在模型中未考虑环境因素[17]。
1.6 MYF6基因在绵羊8个组织中的表达谱
在甘肃省武威市天祝县一绵羊养殖场,选取3周岁、体况良好的3只小尾寒羊母羊。屠宰后采集其乳腺、肝脏、心脏、背最长肌、脾脏、肺脏、卵巢和肾脏等组织,去除表面杂质和血渍后,放入液氮带回实验室保存。用TRIzol Reagent(Invitrogen,CA,USA)试剂盒提取绵羊上述8个组织的总RNA,反转录合成cDNA。以β-actin为内参基因,采用实时荧光定量PCR法检测MYF6基因在各组织中的表达水平。RT-qPCR反应体系为:100ng/μL的cDNA 2μL,0.25 μmol/L的上、下游引物各0.4 μL,10 μmol/L的SYBR qPCR Master Mix 10 μL和RNase-free ddH2O 7.2 μL。RT-qPCR的具体反应程序为:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,45个循环。试验设3个生物学重复和3次技术重复。采用2-ΔΔCt方法计算并比较MYF6基因在上述各组织中的相对表达量[21]。
2 结果与分析
2.1 MYF6基因第1外显子的遗传特征
经PCR-SSCP分析,MYF6基因第1外显子检测到A和B 2个等位基因,存在AA和AB 2种基因型(图1);测序结果表明,2个等位基因间存在c.129 C>T同义突变的单核苷酸多态位点(single nucleotide polymorphism,SNP)(图2)。等位基因A和B的频率分别为89.30%和10.70%,基因型AA和AB的频率分别为78.60%和21.40%,群体的基因型频率符合Hardy-Weinberg平衡(P=0.08)。
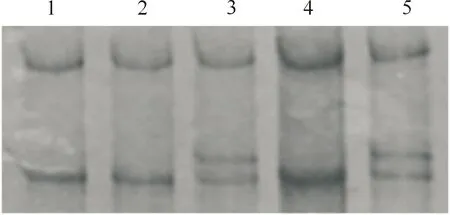
1,2,4.AA基因型;3,5.AB基因型1,2,4.AA genotypes;3,5.AB genotypes图1 绵羊MYF6基因第1外显子区域的PCR-SSCP分析Fig.1 Analysis of the exon 1 region of MYF6 by PCR-SSCP
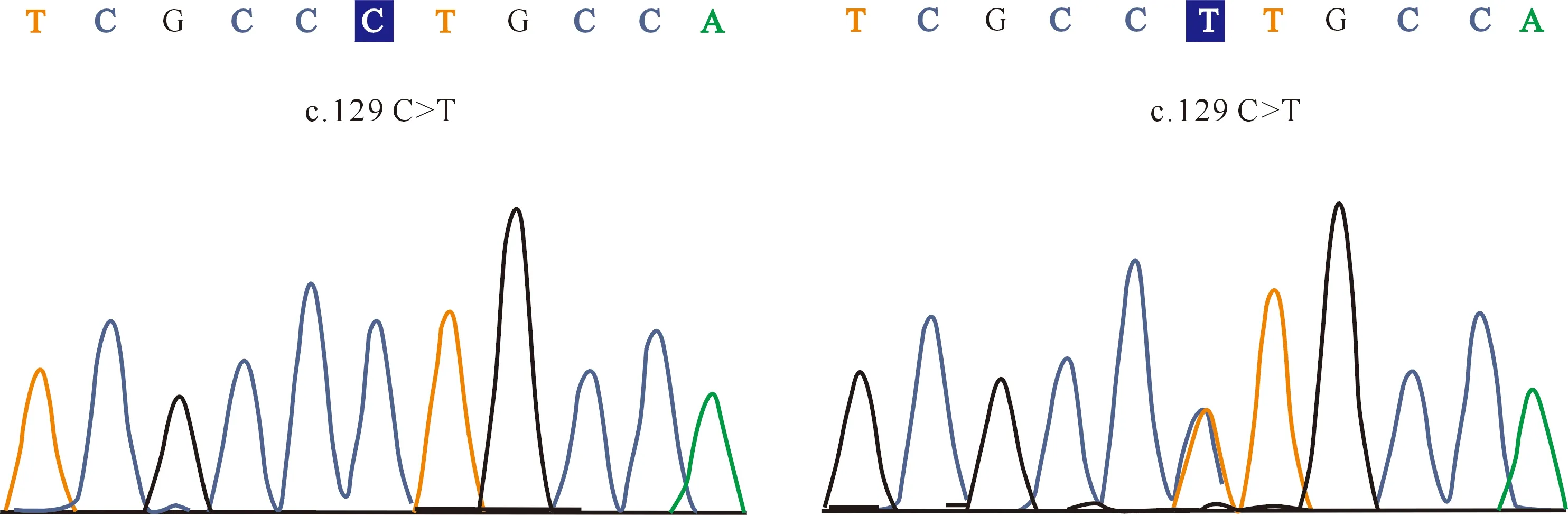
图2 绵羊MYF6基因第1外显子区域的SNP测序峰图Fig.2 Sequencing of SNP in the exon 1 region of MYF6
2.2 MYF6基因5′UTR区域的遗传特征
经PCR-SSCP分析,在MYF6基因5′UTR区域检测到C和D 2个等位基因,存在CC和DD 2种基因型(图3);测序结果(图4)表明,与等位基因D的序列相比,等位基因C的序列中存在3 bp的碱基(c.-589~-590 del ATA)缺失。等位基因C和D的频率分别为98.37%和1.63%,基因型CC和DD的频率分别为96.74%和3.26%。在该研究区域,群体的基因型频率也符合Hardy-Weinberg平衡(P=0.82)。
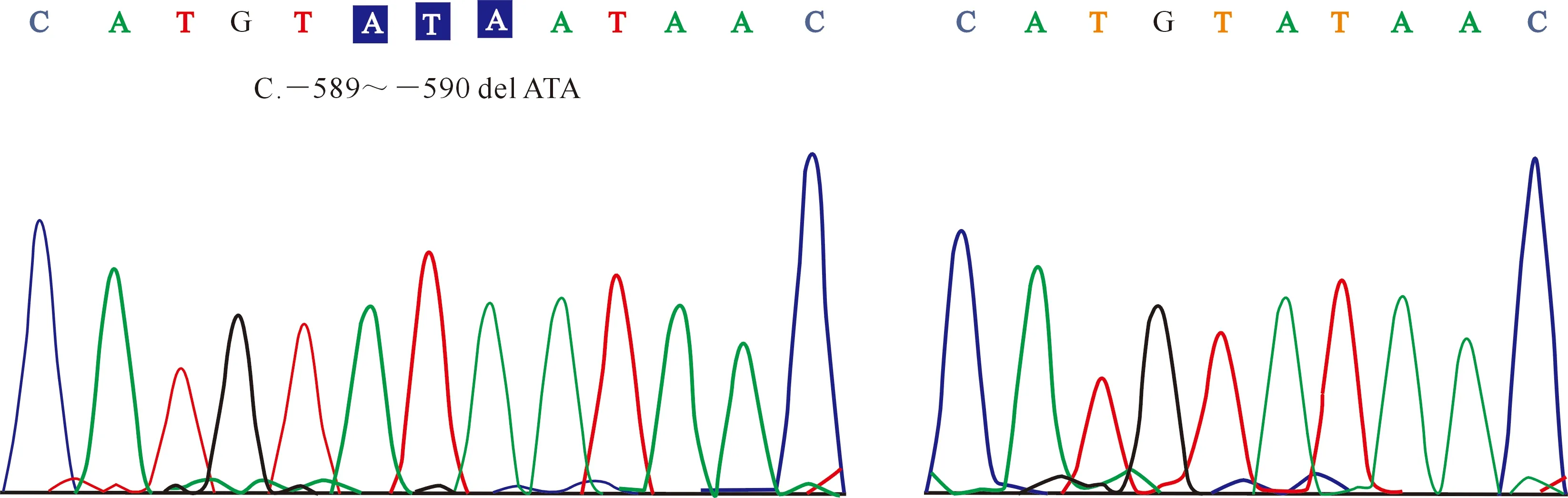
图4 绵羊MYF6基因5′UTR区域的测序峰图Fig.4 Sequencing of 5′UTR region of MYF6
2.3 MYF6基因第1外显子基因型对绵羊公羔胴体性状的影响
在MYF6基因的第1外显子区域上,2个基因型的频率均大于5%,因此被用于对绵羊公羔胴体性状的影响分析;而在5′UTR区域检测到的2个基因型中,DD型的频率小于5%,无法进行相关分析。MYF6基因第1外显子基因型对绵羊公羔胴体性状影响的分析结果见表2。由表2可知,MYF6基因第1外显子基因型对羔羊的后腿瘦肉量、腰部瘦肉量、肩部瘦肉量、总瘦肉量和腰部瘦肉比例均有极显著影响(P<0.01),AA型个体的后腿瘦肉量、腰部瘦肉量、肩部瘦肉量和总瘦肉量分别较AB型高0.5%,0.7%,0.5%和1.7%,但对后腿瘦肉比例和肩部瘦肉比例无明显影响(P>0.05)。

1,2,4.CC基因型;3.DD基因型1,2,4.CC genotypes;3.DD genotypes
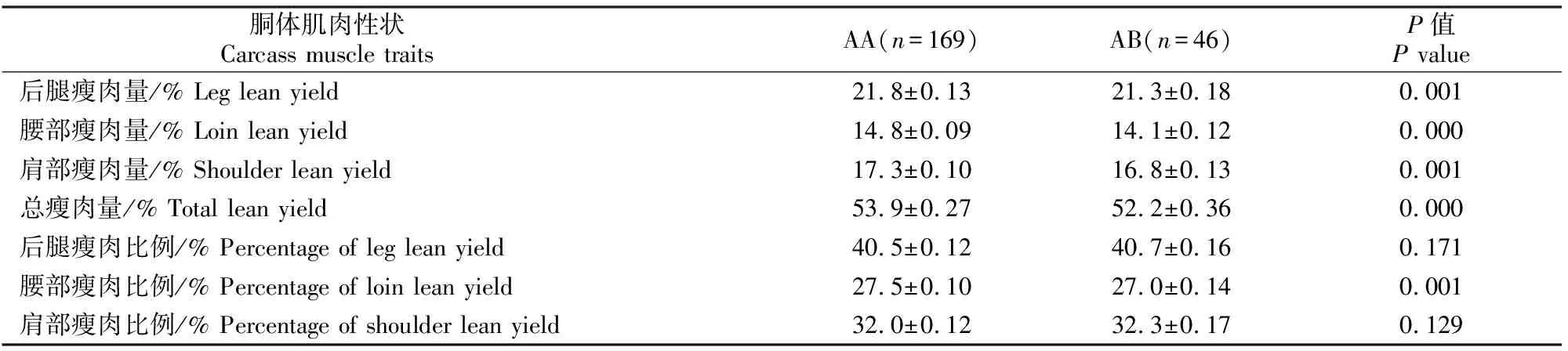
表2 MYF6基因第1外显子基因型对羔羊瘦肉性状的影响Table 2 Effect of genotypes in ovine MYF6 exon 1 on lean traits in male lambs
2.4 MYF6基因在绵羊8个组织中的相对表达量
由图5可知,MYF6基因在绵羊背最长肌、卵巢、肺脏、脾脏、肾脏、肝脏和乳腺等8个组织中均有表达,但以背最长肌中的相对表达量最高,其余依次为卵巢、肺脏、脾脏、肾脏、肝脏、乳腺和心脏,其在背最长肌中的相对表达量分别是上述组织的86,104,108,109,171,1 308和13 841倍(P<0.01)。MYF6基因在卵巢、肺脏、脾脏和肾脏中的相对表达量之间无明显差异(P>0.05),但均显著高于其在肝脏、乳腺和心脏组织中的相对表达量。
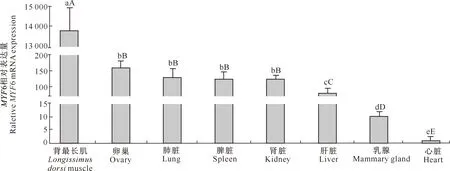
图柱上标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01)Different lowercase letters indicate significant difference (P<0.05) and difference capital letters indicate extremely significant difference (P<0.01)图5 MYF6基因在绵羊不同组织中的表达水平Fig.5 Expression levels of ovine MYF6 in different tissues
3 讨 论
本研究在绵羊MYF6基因的第1外显子上发现了1个同义突变的SNP(c.129 C>T),虽然这个SNP不能改变编码的氨基酸,但其作用不容忽视,因为该SNP有可能与MYF6基因其他重要区域的SNPs连锁,从而调控MYF6基因的表达量或改变编码蛋白的功能。有研究发现,同义突变的SNPs也能影响mRNA的生成效率和稳定性,以及蛋白质的生成效率和空间构象,最终改变基因的功能[22]。Maak等[23]在人、小鼠、狗、鸡和斑马鱼等物种上的研究发现,MYF6基因的启动子区域中存在7个SNPs。前人分别在山羊和鸡MYF6基因的外显子上发现了2个和1个SNP[24-25]。本研究发现的SNPs在上述研究中均未报道,且此SNP形成的2个基因型间的部分胴体性状存在显著差异。本研究在5′UTR区域也发现了1个3 bp的碱基缺失,但由于在本研究选用的215只罗姆尼羊中,这个核苷酸变异产生的等位基因D的频率仅为1.63%,故无法研究该碱基缺失对绵羊胴体性状的影响。前人对其他基因5′UTR区域的研究发现,此区域的碱基缺失具有重要作用,例如Bi等[26]对内蒙古白绒山羊的研究发现,MSTN基因5′UTR区域的1个5 bp的碱基缺失对胸部深度有极显著影响(P<0.01);卢靖坤[27]在牛的MSTN上发现,5′UTR区域1个11 bp的碱基删除造成了蛋白活性区域失活,最终形成了牛的双肌表型。因此,建议将来在其他绵羊品种上,或用更多的绵羊样本来进一步研究MYF6基因5′UTR区域c.-589~-590 del ATA对绵羊胴体性状的影响。
卡方检验发现,在绵羊MYF6基因的5′UTR区域和第1外显子区域内,羔羊的群体遗传结构符合Hardy-Weinberg平衡(P>0.05)。这说明本研究所使用的罗姆尼羊群体未受到明显的人工选择压力,也未受到迁移、严格选配等其他因素的影响。因此,在以后的育种实践中,建议加强人工选择和选种选配,从而提高该群体的瘦肉量和瘦肉率。
王鑫等[28]的研究发现,MYF6基因在山羊背最长肌中的表达量高于肝脏等其他组织。曹婷等[29]在猪上的研究发现,MYF6基因在肌肉中的表达量最高,在心脏中的表达量最低。本研究RT-qPCR结果显示,MYF6基因在绵羊卵巢等8个组织中均有表达,其中在背最长肌中的表达量最高,在心脏中的表达量最低(P<0.05),这与其生物学作用有关。有研究表明,动物出生后随着肌纤维的发育,MYF6在mRNA水平和蛋白水平的表达量随之增加[30],说明MYF6基因在动物生后肌纤维肥大过程中发挥着重要作用[5]。曹婷等[29]研究发现,MYF6在猪的肝脏、脾脏、肺脏和肾脏中均有表达,但目前尚未见该基因在动物卵巢和乳腺中表达情况的报道。本研究发现,除了肌肉和心脏组织以外,MYF6在卵巢、乳腺、脾脏、肝脏、肾脏和肺脏中也有表达。
有学者发现,MYF6基因的基因型对动物肌肉量有显著影响,如郭月英等[1]发现,AB型绵羊的眼肌面积大于AA型绵羊个体;孙文浩[25]发现,AA型鸡具有更大的产肉量和胸肌、腰肌质量(P<0.05)。本研究分析结果表明,MYF6第1外显子的基因型对羔羊的瘦肉量有极显著影响(P<0.01),AA型个体的后腿瘦肉量、腰部瘦肉量、肩部瘦肉量和总瘦肉量分别较AB型高0.5%,0.7%,0.5%和1.7%。在发达国家的市售羊肉中,腰部和腿部的瘦肉都是肉质较好的上等肉,特别是腰部的瘦肉,能被烹饪成法式羊排等附加值极高的食品。鉴于MYF6基因对绵羊后腿部、腰部和总瘦肉量的显著影响,以及这3个部位瘦肉的良好品质,该基因可以作为一个分子标记,用于提高绵羊的胴体瘦肉量。
4 结 论
在绵羊MYF6基因的第1外显子中发现了1个SNP,在5′UTR区域发现了1个3 bp的碱基缺失(c.-589~-590 del ATA)。MYF6基因在绵羊背最长肌中的表达量最高,其基因型极显著影响了羔羊的瘦肉性状,可以作为分子标记用于提高羔羊的酮体瘦肉量。
