基于网络药理学与分子对接探讨“乳香-没药”治疗膝骨关节炎的作用机制
2022-04-01雷经纬周小海胡志希
雷经纬,周小海,卢 敏,胡志希*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007)
膝骨关节炎(Knee osteoarthritis,KOA)是近年来老年患者致残的主要原因之一,其特征是关节软骨退化,关节滑膜并伴有不同程度的炎症,从而出现关节僵硬、疼痛甚至丧失功能活动[1-2]。口服非甾体抗炎药物是目前治疗本病最常见的非手术疗法,但由于其疗效有限且存在诸多不良反应,患者不可长期用药[3]。因此,从寻找可靠、有效的中药治疗KOA成为目前的一大研究热点。
KOA属于中医“膝痹”“骨痹”等范畴,擅于活血消肿止痛之经典药对没药、乳香,出自经典医籍《证治准绳》中收录的“乳香止痛散”,是治疗KOA运用频率最高的处方[4]。乳香性偏温,长于行气活血舒筋,没药性偏平,长于活血散瘀[5]。但中药成分复杂,目前的研究尚缺乏有效方法来客观评价中药多成分的作用机制。网络药理学是一种新的研究方式,可结合系统生物学和生物信息学,通过网络分析探索药物活性的潜在机制[6]。基于此,本文利用网络药理学及分子对接探索乳香、没药的潜在有效物质,并对治疗KOA靶点及分子机制进行预测研究,以期为进一步的相关实验研究提供理论依据。
1 材料与方法
1.1 “乳香-没药”活性成分及其靶点的筛选
检索TCMSP数据库获得“乳香-没药”的有效成分,设定类药性(Drug likeness,DL)≥0.18及口服生物利用度(Oral bioavailability,OB)≥30进行筛选[7],获得药物活性成分及作用靶点,随后借助Uniprot数据库对靶点进行矫正和转换为靶点基因,限定物种为“人类”[8],即为“乳香-没药”主要活性成分的预测靶点。
1.2 KOA疾病相关靶点筛选
以“Knee osteoarthritis”为关键词在GeneCards、OMIM两大常用疾病数据库进行检索,筛选出KOA相关的疾病靶点,去除重复内容后,同样借助Uniprot数据库对疾病靶点进行基因转换。然后借助R语言相关程序将“1.2”项中获得的药物靶点与KOA疾病相关靶点取交集提取交集靶基因,绘制韦恩图。
1.3 “药物-成分-疾病-靶标”调控网络的构建
利用Cytoscape 3.7.0软件将“1.3”项中获得的交集靶基因与药物、疾病相映射,即“药物-成分-疾病-靶标”网络图。网络图中药物成分、疾病以及两者交集靶标分别以不同形状的节点代表,药物活性成分的“degree”值通过使用 “CentiScape”插件分析得出,其值大小用以评估判断活性成分是否发挥主要功能。
1.4 蛋白相互作用网络构建与分析
将交集靶基因导入到STRING平台设置最小互作分数值为0.9(最高置信度),获取蛋白相互作用数据,随后将结果导入Cytoscape 3.7.0软件中用以构建PPI网络,根据“degree”值大小进行排序,其值越大,成为化合物的关键作用靶点可能性越大。
1.5 GO功能富集分析和KEGG通路富集分析
将交集靶标利用R语言软件运行,得到基因本体论(Gene Ontology,GO)及基因通路富集分析(Kyoto Encyclopedia of Genes and Genomes,KEGG)结果,以P<0.05为差异有统计学意义。将得到的KEGG通路分析结果导入Cytoscape 3.7.0软件进行可视化展示。
1.6 活性成分与关键靶点的分子对接认证
分子对接是基于Scripps研究所发与维护AutoDock 4.2软件进行的,通过上述“1.4”项下步骤筛选出富集交集靶点最多的有效活性成分,将其作为配体,其三维结构通过PubChem数据库搜集。步骤“1.5”项中“degree”值最大的蛋白为受体,其蛋白结构通过PDB数据库搜集,将搜集到的蛋白结构导入OpenBabel 2.4.1软件中进行格式转换等操作后,利用AutoDock 4.2软件行分子对接[9]。
1.7 观察项目
本研究基于网络药理学方法对“乳香-没药”药对治疗KOA的机制靶点进行预测,选取的观察指标主要包括药对的关键有效活性成分、蛋白互作网络的核心靶蛋白、GO及KEGG通路富集分析结果以及药对核心有效化合物与靶蛋白的对接活性。
2 结果
2.1 “乳香-没药”有效成分及其靶点筛选结果
经先前设定的条件进行筛选,药对中共有40个有效成分最终纳入,其中乳香32个,没药8个。对这40个有效成分进行靶点预测,去重后共获得靶点基因162个。见表1。
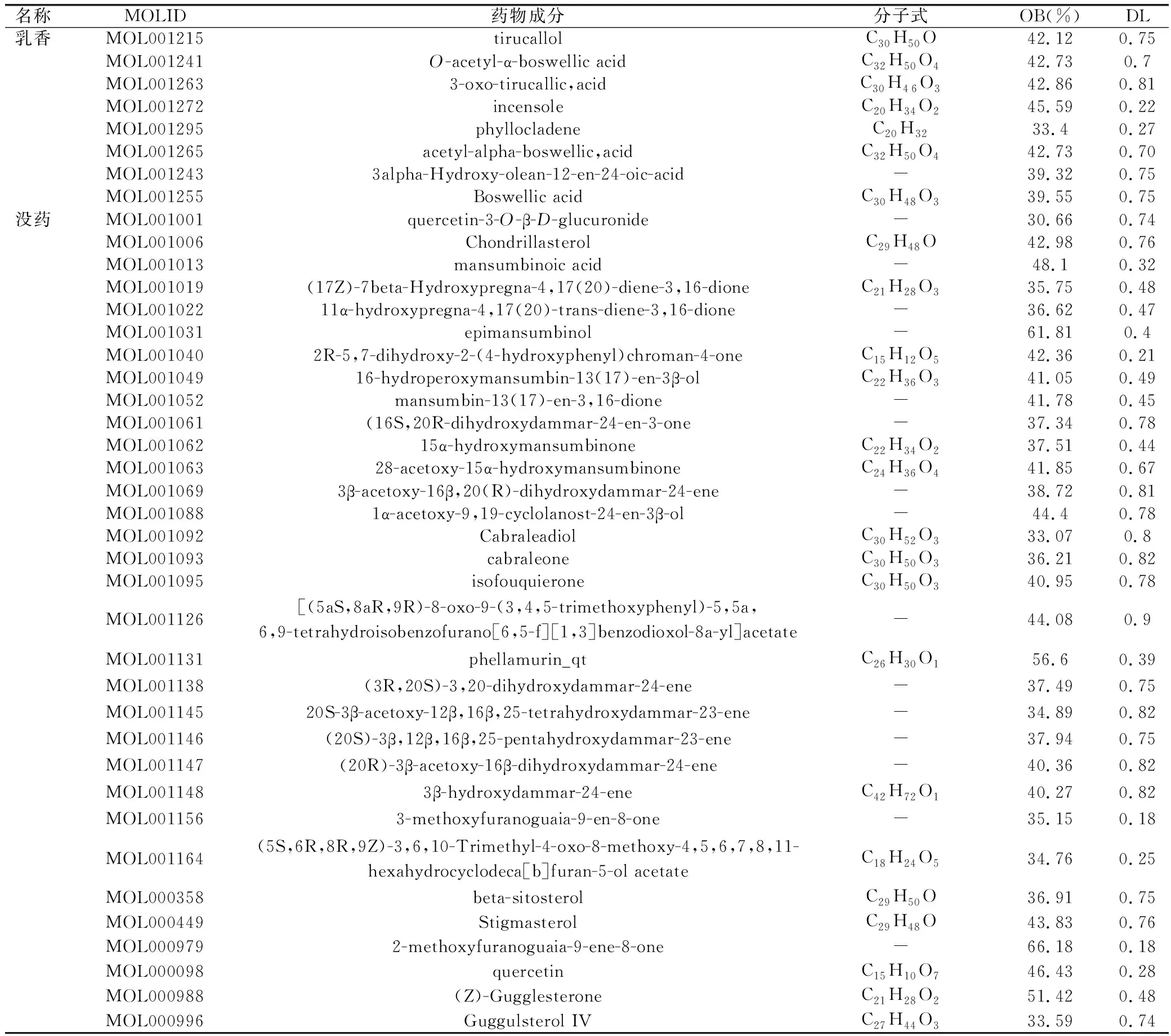
表1 “乳香-没药”药对活性成分列表
2.2 KOA疾病靶点的筛选结果
检索GeneCards、OMIM数据库,获取共1 646个KOA相关的疾病基因,通过使用Uniprot数据库中数据对疾病靶点进行人类基因名注释转换。利用R语言程序提取KOA相关靶基因与药对中有效成分的交集靶点83个,并绘制维恩图,见图1。
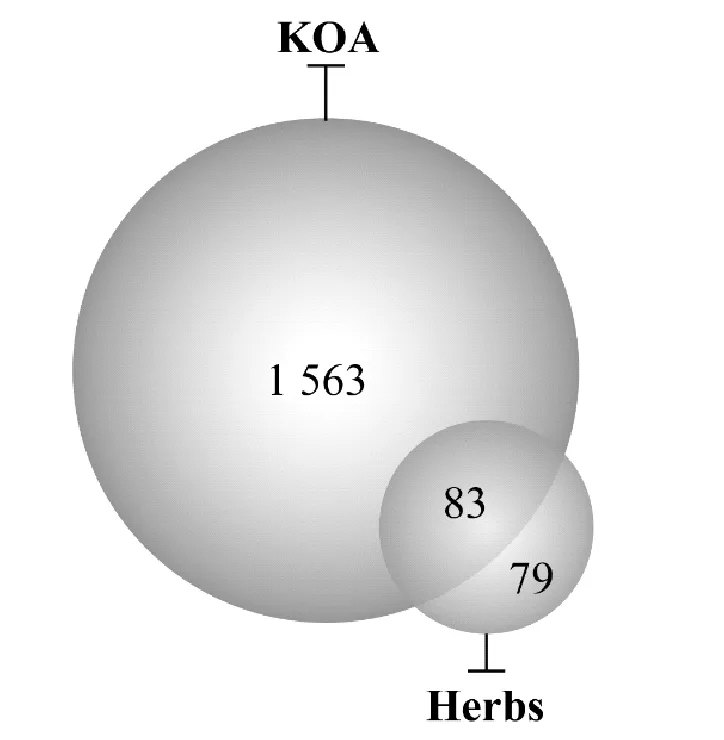
图1 “乳香-没药”药对与疾病靶点的韦恩图
2.3 “药物-成分-疾病-靶标”调控网络的构建结果
将83个“乳香-没药”药对治疗KOA的交集靶基因分别与3个乳香,17个没药活性成分进行映射,建立它们之间的对应关系,将结果导入Cytoscape 3.7.1软件中绘制“药物-成分-疾病-靶标”调控网络图(图2)。借助CentiScape插件,分析出不同节点的degree值,其值越大意味着该节点在网络中发挥越重要的作用。通过计算结果可知:没药中排名前3的有效成分分别为槲皮素(Quercetin)、β-谷甾醇(beta-sitosterol β)、豆甾醇(Stigmasterol),对应的degree值分别为77、14、6。乳香中排名前三的是乳香脂酸(Boswellic acid)、扁枝杉烯(phyllocladene)、3-氧代-酪氨酸(3-oxo-tirucallic acid),对应的degree值分别为2、2、2。
注:菱形节点代表“乳香-没药”药对,六边形节点代表KOA疾病,三角形节点分别代表乳香、没药有效成分,圆形节点代表交集靶标,连线代表靶点之间的联系。
图2 “乳香-没药”治疗KOA的“药物-成分-疾病-靶标”网络
2.4 PPI网络构建及分析结果
筛选得到的83个疾病与药物交集靶标导入STRING平台,限定物种为人类,设置最小互作分数值为0.9(最高置信度)进行蛋白网络互作分析,分析结果导入Cytoscape软件中绘制PPI网络图,如图3所示。网络中共有83个节点,相互间的连线代表存在相互作用。节点的大小和颜色深浅随degree值大小变化,即靶基因的degree值越大,则对应的节点越大和颜色越浓。排名前五的为:白细胞介素-6(IL-6)、Jun激酶(JNK)、白细胞介素-1B (IL-1B)、丝裂原活化蛋白激酶1(MAPK1)、前列腺素内过氧化物合酶2(PTGS2),degree值分别为:28、23、21、17、16,表明其在网络中处于核心地位。
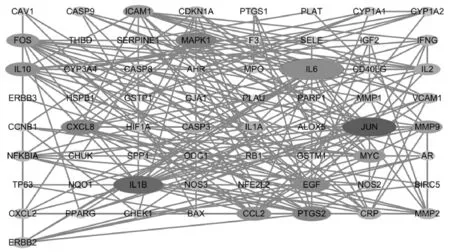
注:图中节点表示PPI网络中的靶蛋白,节点的面积越大且颜色越深则该蛋白的“degree”值越大,在网络中的地位越重要。
2.5 基因功能与通路分析
本次研究GO分析划分为生物过程(BP)、细胞组分(CC)以及分子功能(MF)3类,对排名前5的GO富集分析进行展示。BP分析结果主要集中于脂多糖反应、氧化应激反应、活性氧的反应、细菌来源分子反应等生物过程,见表2。CC分析结果主要集中于膜筏、转录因子复合物、膜微结构域、膜区等细胞组分,见表3。MF分析结果主要集中于细胞因子受体结合、细胞因子活性、受体配体活性、核受体活性、转录因子活性等分子功能。见表4。

表2 “乳香-没药”药对治疗KOA潜在靶点的GO富集分析(BP)
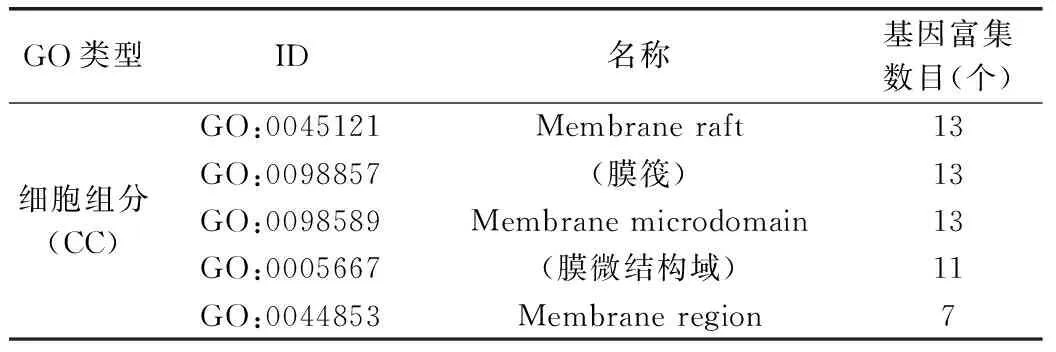
表3 “乳香-没药”药对治疗KOA潜在靶点的GO富集分析(CC)

表4 “乳香-没药”药对治疗KOA潜在靶点的GO富集分析(MF)
KEGG通路分析结果显示,见图4。“乳香-没药”干预KOA主要涉及糖尿病并发症信号通路、黏液剪切应激及动脉粥样硬化、IL-17信号通路、肿瘤坏死因子信号通路等信号通路。以上结果提示“乳香-没药”包含的主要活性成分其作用靶点在不同的代谢通路分布广泛,其干预KOA可能是通过多成分、多靶点相互调节的。
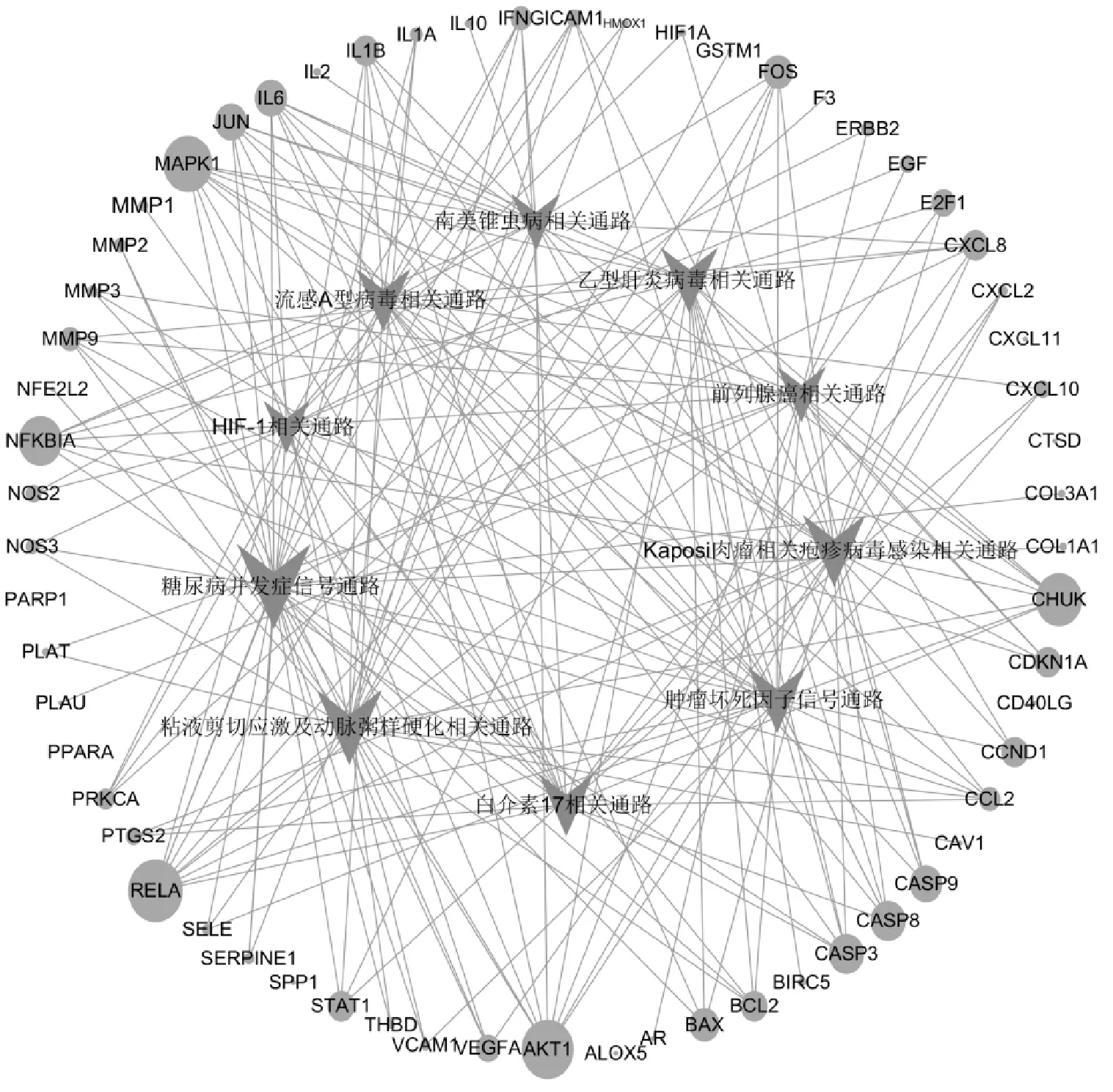
图4 “乳香-没药”药对主要活性成分干预KOA的靶基因-信号通路网络
2.6 分子对接分析结果
基于以上结果分析,活性成分槲皮素涉及的疾病靶点最多,PPI网络中分析得出“degree”值排名最前的靶点为IL-6,因此,分别选择Quercetin和IL-6作为配体和受体用于本次分子对接。通过在PubChem上检索,得到到槲皮素三维结构及其CID:5280343,图5A。通过在PDB上检索,得到IL-6蛋白ID为4NI7并下载其结构,剔除所有配体及水分子(图5B)。经Autodock软件进行分子对接,结果显示槲皮素(quercetin)被“埋在了”受体IL-6蛋白结构4NI7的活性口袋中,这样的结构大大增加了两者结合的可能性,图5C。通过PYMOL软件显示槲皮素与受体IL-6相对应的氨基酸残基分别是第93、97位:氨基酸GLU-93(谷氨酸-93)、TYR-97(酪氨酸-97)、而槲皮素与IL-6之间最短距离为2A,图5D。

注:图5A所示为槲皮素的化合物分子结构;图5B为IL-6的蛋白飘带模型;图5C为槲皮素被包裹在IL-6靶蛋白的活性口袋中;图5D所示化合物槲皮素与受体IL-6的氨基酸(GLU-93、TYR97)残基,虚线表示两者之间的氢键。
3 讨论
3.1 “乳香-没药”的配伍应用具有现代科学依据
乳香、没药配伍成方应用多见于伤科疾病中,目前现代药理学已被证实的主要成分为挥发油类,包括单萜、倍半萜、烯醇和酯类等成分[10-11]。乳香、没药所含活性成分较多,其干预KOA靶点及机制尚不完全明确。通过TCMSP数据量基于ADME标准对药对的活性成分进行筛选,得出在没药的活性成分中槲皮素、β-谷甾醇、豆甾醇干预KOA靶标的基因富集性较高、即成发挥关键作用概率最大。槲皮素通过体内代谢生成的代谢产物所具有的强氧化作用是其发挥抗炎活性的关键[12]。β-谷甾醇可明显刺激成骨细胞OPGm RNA表达,不仅直接促进成骨作用,而且通过有效地抑制破骨作用达到护骨效果[13]。有报道称,豆甾醇可作为治疗KOA的一个可能的治疗剂,其能通过阻碍制促炎性介质(TNF-α,IL-6,IL-1β,iNOS和COX-2)并通过下调关节中NF-κBp65(抑制p-IκB-α激活)和p38MAPK的表达来增加抗炎细胞因子(IL-10)的表达,从而减少软骨退化[14]。在乳香的活性成分中,乳香脂酸能抑制促炎细胞因子(TNF-α、IL-1、IL-2、IL-4、IL-6和IFN-γ)的释放,减轻膝关节的疼痛和僵硬,改善其活动度[10,15]。“乳香-没药”配伍干预的KOA的活性成分多且复杂,且两者的活性成分均对KOA的炎症效应均具有抑制作用,从一定程度上印证二者配伍应用的科学性。
3.2 “乳香-没药”干预KOA的靶点与炎性靶蛋白关系密切
通过构建PPI网络图中得到“乳香-没药”干预KOA的核心靶基因,其中IL-6、JUN、IL1β的度值较高,是“乳香-没药”干预KOA的主要作用靶点。IL-6生物活性复杂多样,能够作用于骨关节炎发生发展病理过程中诸多环节,如促使淋巴细胞分泌相关免疫球蛋白,加重关节的炎症程度等最终导致关节软骨的破坏增强,使病变进一步发展,部分研究表明KOA患者关节损伤程度与血清中IL-6因子水平显著相关[16]。IL-1β属于经典的IL-1家族,为KOA进展过程中涉及的重要促炎细胞因子,在OA的炎症反应过程中不可忽视,IL-1可提高软骨、滑膜等关节组织中基质金属蛋白酶的表达,刺激胶原酶和中性蛋白酶等在滑膜细胞中合成,进而滑膜周围发生炎性病变[17-18]。JUN是AP-1家族主要成员之一,其亚类c-Jun是KOA发病的重要基因,已有研究指出一定程度的应激刺激可激活c-Jun氨基末端激酶(JNK)信号蛋白通路加速软骨细胞外基质降解,引起关节软骨退变,从而加速KOA的进展[19-20]。“乳香-没药”干预KOA的靶点与炎性靶蛋白关系密切,这可能与其无菌性炎症反应的发病机制不谋而合,本研究预测的相关炎性靶点可为进一步实验验证提供指导。
3.3 “乳香-没药”干预KOA的生物学过程具有多组分、多途径的特点
从GO富集分析结果表明,“乳香-没药”治疗KOA生物过程主要涉及脂多糖反应、氧化应激反应等,细胞组分主要涉及细胞膜相关结构上,分子功能主要涉及细胞因子受体结合、细胞因子活性、核受体活性等参与,以上诸多生物学过程和功能在乳香、没药活性成分调节对应靶基因和通路过程中均有体现。脂多糖可诱导生成一氧化氮(NO),NO是KOA重要的炎症介质,其可诱导线粒体损伤和胱氨酸蛋白酶-3(Caspase-3)活化,引发核内染色体降解及凝结,凋亡小体形成,从而软骨细胞凋亡被诱导,加重了软骨损伤的进展[21-22],“乳香-没药”药对可能通过阻断这一恶性过程来干预KOA。大量的KOA相关的信号通路受体聚集在细胞膜上,如TGF-β信号通路中主要通过在细胞膜上形成Ⅰ型受体和Ⅱ型受体的复合体来启动信号的发生[23]。抑制细胞因子介导的信号通路是分子治疗KOA的重要方式,其包括细胞因子中和、受体阻滞、细胞因子过程抑制、细胞因子合成、反应抑制以及联合的治疗[24]。
3.4 “乳香-没药”干预KOA的涉及炎症、代谢以及肿瘤多种信号通路
从信号通路来看,“乳香-没药”治疗KOA主要涉及代谢、炎症、感染以及肿瘤等相关信号通路。其中AGE-RAGE排名最靠前,对于晚期糖基化终产物(AGEs)信号传导途径的深入研究,使人们认识到AGEs可以诱导人OA滑膜细胞COX-2的表达和前列腺素E2(PGE2)、IL-6和MMP-13的产生,另外AGEs受体中和抗体(RAGE)能有效逆转人滑膜细胞的炎症反应和VEGF生成,提示RAGE在滑膜细胞活化中起重要作用,从而促进OA的进展[25-26]。IL-17信号通路关键蛋白(IL-17RA、IL-17RC、ACT1、TRAF6和RELA)过度表达和活化,在关节软骨炎症具有重要作用。 IL-17还能与炎症因子发挥协同作用,放大加强如TNF-α等的致炎效应[27-28]。TNF在体内介导了广泛的细胞反应,TNF-α可以激活JNK和转录因子NF-κB等信号通路,JNK信号通路参与软骨细胞凋亡过程,并可抑制Sox-9的表达,通过阻断NO降低软骨细胞的凋亡水平[29]。NF-κB信号通路被激活,可快速诱导IL-1β、TNF-α、IL-17等相关炎症因子释放加速炎症反应发生[30]。同时,在分子对接结果中,槲皮素与IL-6蛋白之间对接匹配度较适宜,同时它们之间形成的氢键数目较多且距离较短,这说明槲皮素干预KOA作用机制很可能与此氨基酸的残基相关,槲皮素与IL-6关键靶蛋白间的对接具有一定的适配性,从分子角度剖析本研究预测结果的准确性。
3.5 本研究的不足与展望
本研究仍存在一些局限性。首先,药物活性成分的获取基于现有的数据库和文献,而非液相色谱、质谱或其他实验方法来获取。其次,本研究中筛选后的乳香有效成分较少,在匹配靶基因过程中没药有效成分占大部分比例,这与两者配伍用于临床的干预KOA的过程的实际情况可能存在偏倚。同时,本次研究分析得到的部分关键目标和路径尚缺乏实验研究验证,可为今后相关研究提供新的思路。
