肠愈灌肠方对湿热型溃疡性结肠炎大鼠P38MAPK及相关炎性因子影响研究
2022-04-01张欣雨
张欣雨,李 明,纪 翔
(1.安徽中医药大学 研究生院,安徽 合肥 230038;2.安徽中医药大学第一附属医院 肛肠科,安徽 合肥 230038)
溃疡性结肠炎(Ulcerative colitis,UC)患者症状痛苦,严重影响生活质量,且具有癌变倾向,因此及时控制病情并缓解症状为临床治疗目标,但该病反复发作,迁延难愈,且发病机制尚未十分明确,临床治疗存在长期用药副作用多,停药后复发率高,患者依从性差等问题。中医药治疗UC各阶段均有其治疗原则及方法,具有症状缓解持久,复发率相对较低及副作用小等优势。肠愈灌肠方在临床上多用于治疗证属大肠湿热型UC,但却鲜有对其作用机制和路径的研究。研究表明,P38丝裂原活化蛋白激酶(P38 mitogen activated protein kinase,P38MAPK)参与并诱导免疫应答,在UC的发生发展中具有重要影响[1]。本研究采取现代实验技术观察肠愈灌肠方对UC大鼠P38MAPK及相关细胞因子的调控,从免疫炎症反应角度探析其治疗UC的作用机理,丰富该经验方治疗UC的理论基础。
1 实验材料
1.1 SPF实验大鼠
本实验选用 62 只健康 Wistar 大鼠(2月龄),来源于安徽省实验动物中心(动物生产许可证:SCXK(皖)2011-002),雌雄各半,体质量(160±20)g。实验室为SPF级,空调恒温23 ℃,湿度50%±5%,明暗交替12 h/12 h,室内通风换气,食灭菌固体饲料和标准饮用水。
1.2 药材
柳氮磺吡啶肠溶片1 g,购于安徽省中医院药房,产自上海福达制药有限公司(批号:国药准字H31020840);肠愈灌肠方:黄柏6 g(浓缩颗粒剂0.5 g)、白及10 g(浓缩颗粒剂1.3 g)、苦参6 g(浓缩颗粒剂0.5 g)、仙鹤草15 g(浓缩颗粒剂0.9 g)。浓缩颗粒剂供自四川新绿色药业科技发展有限公司。加锡类散1 g(购自杭州胡庆余堂药业有限公司)。
1.3 实验试剂及器材
2,4,6-三硝基苯磺酸(TNBS,Sigma公司)、50% 乙醇、生理盐水、水合氯醛;TNF-α ELISA 试剂盒(批号:93556038)、IL-4 ELISA 试剂盒(批号:230441235)及IL-10 ELISA 试剂盒(批号:10369R);BCA 蛋白定量试剂盒购自上海 BestBio 公司。一抗:兔抗鼠P38MAPK一抗;二抗:IgG-HRP羊抗兔二抗(上海生工生物工程股份有限公司)。VELOCI-TY 高速低温离心机(美国伯乐公司);组织匀浆机(上海净信Tissuelyser-192);Western-blot所用电泳槽及转运槽(Bio-Rad 公司)。
2 方法
2.1 造模方法[2]
环境与饮食干预,联合TNBS/乙醇混合试剂灌肠法,空白组12只大鼠予常规饲养,余50只大鼠给予肥甘饮食(普通饲料掺入12%动物脂肪、10%糖浆融合加工),隔日交替灌喂56度白酒20 mL/kg,后将大鼠放入人工气候箱(参数:高温35 ℃、高湿95%)中,共21 d,以建立内因湿热型模型。造模前一天,大鼠仅饮水,并用棉签擦净肛周秽物,促进排空大便,之后用水合氯醛麻醉,固定大鼠背部于解剖台上,取直径约2 mm灌肠管用石蜡油润滑后,经肛缘缓慢插至结肠约8 cm处,再把TNBS和乙醇混合物注入肛门上段,将大鼠头低脚高位倾斜倒置45°,时间持续2 min,使得溶液能充分进入肠腔内,清醒后自由饮食,观察并记录大鼠情况。3周后评估被抽取大鼠造模水平。造模成功标准:大鼠结肠黏膜充血水肿明显,纹理模糊,部分节段见散在溃疡、糜烂及出血点,甚者附着白色伪膜,与周围脏器有不同程度黏连,肠腔梗阻或狭窄,结肠长度缩短明显。
2.2 分组与药物干预
采用随机数字表法,对62只SPF 级健康大鼠进行分组,分别为空白组、模型组、柳氮磺吡啶组,肠愈灌肠方低、中、高剂量组,空白组12只,其余各组均为10只。空白组(12只大鼠)不作任何干预措施,每日按时给予喂养。模型组每日予3 mL生理盐水灌肠。按照人与实验大鼠体型换算系数法[3],计算有效给药剂量,肠愈灌肠方组每日按低剂量(浓度为0.09 g/mL,相当于成人临床日需量的2.5倍),中剂量(浓度为0.18 g/mL,相当于成人临床日需量的5倍),高剂量(浓度为0.36 g/mL,相当于成人临床日需量的10倍),各3 mL灌肠。柳氮磺吡啶组予柳氮磺吡啶,研磨成粉后用蒸馏水稀释成均匀混悬液,浓度0.02 g/mL(相当于成人临床日需量的5倍),取3 mL灌肠。每日固定时间给药1次,持续14 d为1治疗周期。
2.3 标本采集
各组动物经相关灌肠给药治疗14 d后,禁食过夜24 h,期间饮水不限,用异氟烷吸入麻醉,低温无菌分离腹主动脉,取血5 mL,离心后取上清-80 ℃保存,用于ELISA检测。将大鼠断颈处死,沿纵轴自肛门上端约8 cm处剖开肠腔,取病变最明显处结肠组织约6 cm,用4 ℃生理盐水清洗肠腔并用锡纸包裹,置于液氮冷冻,随后用无酶冻存管-80 ℃保存,备Western-blot法检测。
2.4 一般情况观察
自实验开始每日逐只称量大鼠体质量,观察大鼠精神反应状态,进食量,泄泻程度,毛发密度及光泽度等,采用邻甲苯胺法检测粪便隐血。根据计算公式:DAI=(体质量下降分数+粪便黏稠度+便潜血)/3,评估UC疾病活动指数[4]。见表1。

表1 大鼠DAI评分
2.5 Western-blot检测肠黏膜P38MAPK蛋白水平
截取约50 mg解冻后的肠标本研磨破碎并加入200 μL RIPA试剂(含PMSF),冰浴30 min后低温离心10 min(4 ℃,12 000 rpm)。取上清,用BAC法进行蛋白定量。将总蛋白提取液与1/5的loading buffer均匀稀释,沸水浴使蛋白变性。每孔上样20 μL,根据蛋白分子量大小制备凝胶,随后开始电泳分析蛋白。湿法电转至0.45 μm的PVDF膜,用5%脱脂奶粉+3% BSA将PVDF膜37 ℃温育1~2 h。把PVDF膜放于稀释至1∶2 000的兔抗鼠P38MAPK一抗培育液中,4 ℃静止过夜,洗膜5次。取出PVDF膜,浸于稀释至1∶3 000的HRP羊抗兔二抗培育液中,37 ℃结合反应1~2 h,TBST快摇洗膜5次。用化学发光(ECL)胶片显影。实验均重复3次。
2.6 大鼠血清IL-4、IL-10、TNF-α含量比较
实验结束后,将从腹主动脉取得的血液置于离心机离心10 min(4 ℃,3 000 r/min),收集上清液于-80 ℃ 保存备测。按照 ELISA试剂盒操作规程测定血清IL-4、IL-10以及TNF-α的水平。
2.7 统计学方法

3 结果
3.1 一般情况
空白组大鼠反应快,饮水进食排便均正常,皮毛厚而光滑,粪便为深褐色,呈颗粒状;模型组第2天出现精神不振、嗜睡、毛干枯稀疏,食物摄入量降低,第3天时有血便,第5天出现脓血便;1星期后大鼠体质量明显降低,出现少食懒动、皮毛松散枯槁、嗜睡、黏液脓血便、反应迟钝等症状,生存能力明显下降;药物干预2周后,相较于模型组,各治疗组症状明显减轻,动作敏捷,毛发有光泽、饮食、粪便、体质量接近正常,身体发育良好。实验期间由于灌肠操作不当,模型组大鼠死亡3只,肠愈灌肠方低、中剂量组及柳氮磺吡啶组各死亡2只,空白组及肠愈灌肠方高剂量组未见死亡。肠愈灌肠方中、高剂量组一般情况较好,体质量恢复正常,大便性质明显改善,皮毛有光泽,活动增多,DAI评分比模型组显著降低(P<0.05);肠愈灌肠方和柳氮磺吡啶组组间差异无统计学意义(P>0.05),但肠愈灌肠方高剂量组DAI评分明显低于柳氮磺吡啶组。见表2。

表2 肠愈灌肠方对各组大鼠 DAI 评分影响
3.2 各组大鼠P38MAPK表达水平比较
相较于空白组,模型组大鼠肠黏膜P38MAPK含量明显升高(P<0.05);与模型组比较,肠愈灌肠方(0.36 g/mL、0.18 g/mL)组和柳氮磺吡啶(0.02 g/mL)组均可明显降低结肠组织P38MAPK蛋白表达量,组间有统计学差异(P<0.05);各治疗组间比较,肠愈灌肠方(0.18 g/mL、0.36 g/mL)组及柳氮磺吡啶组(0.02 g/mL)组均优于肠愈灌肠方(0.09 g/mL)组,组间比较有统计学差异(P<0.05)。见表3。

表3 各组大鼠之间P38MAPK蛋白表达比较
3.3 大鼠血清IL-4、IL-10、TNF-α含量比较
相较于空白组,模型组大鼠的IL-4、IL-10含量较低,TNF-α的含量明显升高(P<0.05);与模型组比较,柳氮磺吡啶组和肠愈灌肠方组大鼠血清TNF-α显著降低,IL-4、IL-10 的含量上升,其中以肠愈灌肠方高剂量组最为显著,组间差异有统计学意义(P<0.05)。见表4。
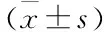
表4 各组大鼠血清中细胞因子含量比较
4 讨论
近年来,由分子机制角度切入,探索炎症介质及其通路在UC肠道病变中的作用成为研究热门。有关实验研究表明[5-6],UC 的发生与机体组织内抑炎因子和促炎因子(或基因和蛋白)的紊乱状态有密切关系,这一观点得到了多数学者的认同[7]。
诸多研究表明,UC活动期人群的血清TNF-α含量较正常人群该项指标升高显著,病情程度越重,血清TNF-α升高越明显,经治疗,血清TNF-α水平会逐渐下降。可见,TNF-α是UC疾病发展过程中的关键细胞因子。IL-4、IL-10与TNF-α不同,这两种刺激分子在UC的发病过程中展现降低趋势,对肠黏膜具有保护作用。IL-4主要由活化的T细胞分泌而来,具有抑制炎症与免疫抑制等多种生物学效力,在肠道黏膜微环境稳定中发挥着重要作用[8]。IL-10可抑制部分炎性细胞因子合成,Th2细胞是其主要来源。研究表明,将小鼠IL-10基因剔除,可使小鼠诱发结肠炎,之后予以IL-10可防治其发生。本实验亦表明,IL-10在保持肠道黏膜免疫调节方面,作用极其重要[9]。此外,对于直肠炎,IL-4、IL-10 具有逆转 Th1/Th2 细胞活化作用,加强 Th2型反应,使得黏膜修复得以改善。
P38MAPK主要位于细胞浆内,其活性在正常情况下很低,可被特定细胞因子刺激而活化,而后通过调控多种蛋白激酶与转录因子,介导细胞应激免疫炎症反应,与炎症的发生发展过程息息相关[10-11]。研究发现,P38MAPK 在 UC 肠黏膜中的蛋白水平显著提高,可能是通过调节下游细胞因子(如 IL-1β、IL-10、TNF-α)的表达,从而参与了 UC 的发生[12]。Li等[13]研究表明,姜黄素可阻断P38MAPK蛋白产生,下调下游炎症因子(IL-6、TNF-α)等的表达,从而改善结肠黏膜对促炎症因子的免疫防御机能。
本实验结果表明,肠愈灌肠方中、高剂量组和柳氮磺吡啶组对UC大鼠的生存状况改善明显,结肠P38MAPK蛋白和血清中TNF-α的表达下调明显(P<0.05),提示肠愈灌肠方治疗大肠湿热型UC具有明显效果,可能与其降低结肠组织P38MAPK的蛋白表达,从而调控血清各细胞因子的水平如TNF-α、IL-4、IL-10,以达到抑制炎症性反应,调节免疫平衡,修复黏膜屏障的效果有关,今后应深入研究该方,为UC治疗提供新的思路与方向。
