3D打印PLLA/HA复合组织工程骨支架及性能表征
2022-04-01任泽宇石永芳
任泽宇,姜 宏,石永芳
(1.新疆大学 机械工程学院,新疆 乌鲁木齐 830047;2.新疆医科大学 医学工程技术学院,新疆 乌鲁木齐 830017)
0 引言
近年来,组织工程骨支架已成为治疗因创伤、感染、骨肿瘤切除等因素而导致的骨缺损的重要手段[1-2]。在骨缺损修复治疗中植入组织工程骨支架,为细胞的依附、增殖、分化提供微环境,促进和诱导新骨再生,以达到骨修复的目的[3-4]。理想的组织工程骨支架要求具有合适的力学强度、可降解性以及良好的生物安全性,同时也应具备一定的三维微孔结构,为细胞的营养渗入和产物代谢提供物质交换的通道。3D打印技术的出现,使构建复杂形态的组织工程骨支架成为了可能,与传统组织工程骨支架相比,3D打印出的复合支架具有多孔结构,有利于细胞的增殖、依附和物质交换,且可根据患者缺损部位的大小和形态,实现个性化骨支架的制备。羟基磷灰石(Hydroxyapatite,HA)作为骨骼中主要的无机盐成分,具有大的比表面积、良好的生物相容性和骨诱导能力,是常见的骨组织修复材料。Leukers等人[5]在体外研究中,通过3D打印技术制备出可改善骨缺损修复的多孔HA支架,诱导小鼠细胞在孔隙间增殖分化,表现为多孔HA对骨生长具有良好的促进作用,但是纯HA支架存在强度低、脆性大、不易降解等问题。因此,需对HA进行表面改性处理来提高其机械性能和降解性能。在有机高分子材料中,聚乳酸类材料具备良好的组织相容性、可降解性和易加工性,被普遍认为是制备复合新型人工骨的最佳聚合物材料[6]。王立等人[7]用聚左旋乳酸(Poly-L-Lactic Acid,PLLA)制备的可降解骨折内固定器械,具有可完全降解吸收等优点;修凯华等人[8]将PLLA加入接骨板内固定系统中发现PLLA具有与人体相匹配的弹性模量;廖建国等人[9]发现HA降解产物呈碱性,加入PLLA,不仅调节了HA的降解速率,还因PLLA的降解产物为酸性,可中和HA降解后的碱性产物。因此,PLLA支架具有良好的力学性能和降解性能,为了加快HA支架的降解速度,本研究通过挤出成型3D打印技术,制备不同质量分数PLLA/HA复合的多孔生物可降解骨组织工程支架,对其物理性能、降解规律和细胞毒性进行实验和分析,探究骨支架材料的可行性和安全性,为后期进一步体内降解和动物实验提供参考。
1 实验部分
1.1 实验材料
HA(粒径40 nm,纯度96%,南京爱普瑞纳米材料有限公司),PLLA(重均分子量20×105,山东岱罡生物),1,4-二氧六环(分析纯),磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS,碧云天生物技术研究所),模拟体液(Simulated Body Fluid,SBF,雷根生物公司),DMEM低糖培养基,胎牛血清(Gibco,美国),CCK-8试剂盒(同仁化学研究所(Dojindo)开发),兔子成骨细胞(新疆医科大学第一附属医院动物中心提供)。
1.2 实验仪器
3D打印机(新疆大学自研),微机控制电子万能试验机(方辰仪器设备有限公司),HH-1 数显恒温水浴锅(金坛市城东新瑞仪器厂),高精度数字电子秤(浙江凯丰集团有限公司),冷冻干燥机(力辰科技有限公司),CO2培养箱(美国Thermo Fisher),超净工作台(苏州净化设备有限公司),全自动酶标仪(美国BioTek)。
1.3 骨支架制备
以HA为对照,按设计要求10%、20%、30%、40%、50%称取PLLA,将PLLA与1,4-二氧六环溶液按照溶质比1∶2混合,在磁力搅拌器中搅拌2 h至透明胶状并挥发出1,4-二氧六环。将胶状PLLA与HA粉末共混,继续搅拌直至形成可打印的白色膏状物,均匀装入挤出料筒之后,按照图1复合支架结构设计编译G代码,采用3D打印机进行打印。因随PLLA质量分数增加,复合支架黏度增大,经实验表明,每增加10% PLLA含量,出丝速率需提高2 mm/h,防止打印喷头堵头,使出丝速率与运动控制平台速率相匹配,以保证骨支架的良好制备。由于1,4-二氧六环具有毒性且极易挥发,利用冷冻干燥抽真空法去除支架中残留1,4-二氧六环并对支架定形。

图1 复合支架结构设计Fig.1 Structural design of composite scaffold

图2 打印出的复合支架Fig.2 Printed composite scaffold
1.4 复合材料性能测试
1.4.1力学性能测试
骨支架需在人体中承受一定压力,因此需对骨支架力学性能进行测试。将PLLA/HA支架放置于电子万能试验机上进行力学试验。实验共分为5组,选择出丝直径为0.84 mm的打印针头,通过3D打印机打印出10 mm×10 mm×8.4 mm大小的骨支架。室温环境下进行测试。采用1 kN的传感器,压缩速度为1 mm/min,每组选取6个样品。绘制应力-应变曲线,检测其最大抗压强度、最大形变等力学数据。
1.4.2微观形貌检测
选择1.4.1力学性能测试中形貌大小相同的骨支架,每组取6块样品,表面喷金,使用MERLIN Compact(德国蔡司)场发射扫描电子显微镜观察表面的超微形态结构,并随机选择样品表面不同区域采集图像。
1.4.3接触角测试
材料的亲水性是影响细胞依附和蛋白质通过的重要属性[10],因此实验对该性能进行测试研究。由HA和PLLA制备的复合支架具有大量的亲水基团-羟基和羧基,测试支架表面接触角,研究PLLA的加入对支架亲水性的影响变化。制备20 mm×15 mm×2 mm的支架薄片,冷冻干燥后放置于接触角测定仪,同一样品测试3个不同部位,取平均值。
1.4.4傅立叶红外光谱
将干燥样品粉碎,在红外光谱仪上扫描32次,分辨率4 cm-1,测定范围为400~4 000 cm-1,使用Origin 9.1作图分析。
1.4.5支架失重率测试
将打印好的支架放入15 mL离心管中,加入10 mL SBF人体模拟液(pH值7.4~7.5),放入恒温水浴振荡器中振荡,每隔7 d测量pH值并换液,2 w,4 w,6 w,8 w,10 w后取出各组支架,去离子水冲洗表面,冷冻干燥24 h,称重。
1.4.6细胞毒性检测
为测定支架材料以及残留1,4-二氧六环的毒性,对支架整体进行细胞毒性测试。按照GB/T16886.12—2005标准制备浸提液,按设计要求称取冷冻干燥后的50% PLLA/HA复合支架50 mg,进行高温高压蒸汽灭菌处理,按50 mg/mL浸提比例加入细胞培养基。以兔子成骨细胞为材料,培养1代后制备浓度为1×104个/cm3细胞悬液,分别接种在3个96孔板内,每组设3个孔为平行实验,以空白培养基为对照组,每孔加入100 μL细胞悬液,静置4 h待细胞完全贴壁,去除原培养基,加入10 μL浸提液。将细胞培养板在37 ℃,5% CO2培养箱中培养1 d、3 d、5 d取出,加入10 μL CCK-8试剂孵育4 h后,用酶标仪测定在450 nm每个孔的吸光度值,最后进行细胞相对增殖率(R)计算,计算公式为
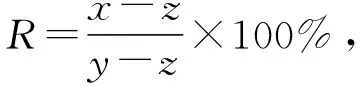
(1)
式中,x为实验组吸光度值,y为对照组吸光度值,z为空白组吸光度值。
2 结果与讨论
2.1 力学性能分析
复合支架的力学强度是由其制备材料的聚合形态、材料在料筒中的分散程度以及表面结合强度等多种因素共同决定的[11]。本实验中,PLLA作为改性材料用以调节HA力学性能。为了得到最佳力学性能,实验制备了PLLA质量分数分别为10%、20%、30%、40%、50%的复合材料进行对比测试。结合后期使用环境,以最大抗压强度为指标来评价复合支架材料的力学性能,并绘制应力应变曲线。
由图3复合支架抗压强度图可以看出,通过挤出成型打印机打印出的复合支架的抗压强度与支架内PLLA的含量成正比关系。当PLLA的质量分数为10%、20%时,支架的抗压强度有小幅度升,但不满足动物体内回植实验所需的最低抗压强度2.5 MPa[12],故后续实验不再进行验证分析。当复合骨支架PLLA质量分数为30%、40%和50%时,复合支架的抗压强度有了明显的提升,三组复合支架的最大压缩强度分别为(3.07±0.31)MPa、(3.99±0.29)MPa和(5.54±0.36)MPa。这是因为随着PLLA质量分数的增加,HA颗粒减少,支架中形成的连续相增加,减少了材料表面的断裂和缺陷,从而增强了复合支架的抗压强度。
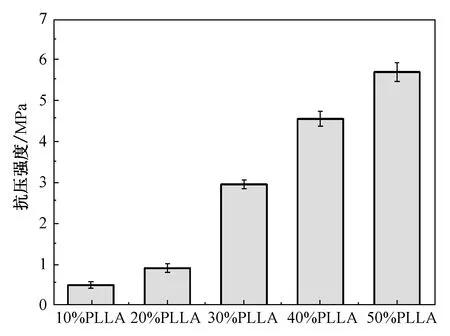
图3 复合支架抗压强度图Fig.3 Composite support compressive strength diagram
由图4复合支架应力应变曲线图可以看出,当复合支架负载相同压力时,复合支架发生形变的形变量随PLLA的质量分数的提升而减小,这是因为HA微粒之间不具备自发结合能力,PLLA质量分数增加,加强了材料结构之间的连续性。当PLLA的质量分数由30%至50%转变时,复合支架的韧性有相应的提升,故当抗压强度一致时,PLLA质量分数为50%的复合支架发生形变的形变量最小。综上,该五组设计实验中,PLLA的质量分数达到50%时,复合支架具有更好的抗压强度和抗变形能力。
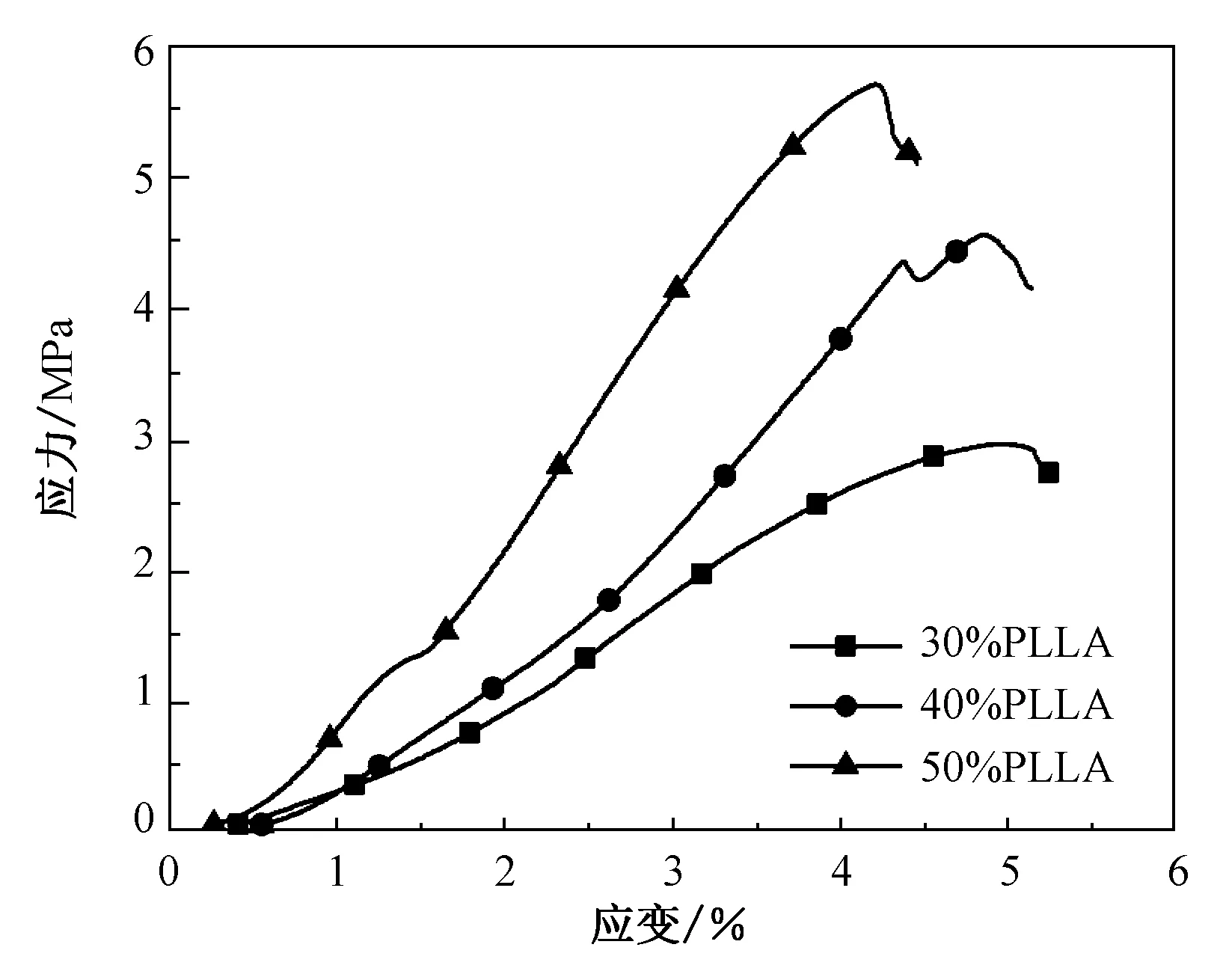
图4 复合支架应力-应变曲线Fig.4 Stress-strain curve of composite support
2.2 微观形貌分析
图5是不同质量分数的PLLA复合支架的扫描电镜表面形貌图。复合支架材料间的间隙大小以及间隙程度与抗压强度抗变形能力密不可分,由扫描电镜图可知,当PLLA质量分数为30%时,复合支架材料表面有明显细小松散的微孔结构且分散均匀,孔隙范围在2~6 μm之间,复合支架材料间的结合能力较差,这可能是当PLLA的含量较少时,仅依靠HA微粒无法通过其自身黏结充分固化,形成的结构较为松散。PLLA质量分数提高至40%时,复合支架材料表面结合程度增强,微孔结构分布较为单一且材料均匀有序,表明打印过程中材料充分均匀混合。当PLLA质量分数为50%时,复合支架表面光滑,PLLA胶体与HA粉末均匀混合黏结,提高了支架的黏结强度,放大2 000倍可看到,PLLA呈胶状附着在支架表面,与HA有效稳固地结合,交联结构增多,支架结构的连续性更强,表现为孔径变小,可承受更大的压应力,材料显示为较好的韧性和延展性,与力学实验中分析结果相匹配。

图5 不同质量分数的PLLA复合支架微观形貌图Fig.5 Microscopic morphology of PLLA composite scaffolds with different mass fraction
2.3 接触角分析
对PLLA质量分数为30%、40%、50%三组支架分别进行接触角测试,结果如表1所示。三组不同PLLA质量分数的差异较为明显。接触角测试中,材料表面的亲疏水性可以由测量接触角角度得出,测量接触角大于90°为疏水性材料,小于90°为亲水性材料。图中看出,当PLLA质量分数为30%时,测量接触角角度为(105.7±0.21)°,表明该质量分数下的PLLA复合支架表面为疏水性,而疏水性材料不利于回植动物体内后成骨细胞的增殖和依附。PLLA质量分数为40%和50%的复合支架表面为亲水性表面,提高PLLA质量分数的含量,其测量接触角的角度随之降低,表现为材料具有更好的亲水性,这可能是因为PLLA中含有大量OH-PLLA—COOH基团,其中羧基(—COOH)具有一定的亲水性,而随着PLLA质量分数的提高,增加了—COOH的含量,使得支架表面具有良好的亲水性能。PLLA质量分数为50%时,其材料表面测量接触角角度为(77.1±0.49)°,该配比下的复合支架亲水性较其他组别有明显提升,有利于回植动物体内后,成骨细胞的增殖、依附和蛋白质的交换。

表1 复合材料接触角Tab.1 Contact angle of composite materials(°)
2.4 傅立叶红外光谱分析
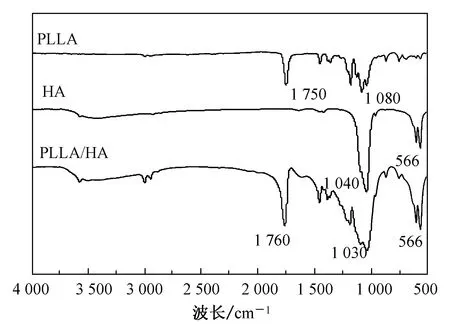
图6 复合材料FTIR图谱Fig.6 FTIR spectra of composite materials
2.5 失重率分析
复合支架体外降解实验是可以预测支架在体内降解过程规律的一种简易实验。由图7不同质量分数PLLA/HA复合支架降解率图可以看出,相同时间内,复合支架的降解失重率随PLLA质量分数的提升而明显增大。复合支架降解前两周,PLLA质量分数为30%时支架降解失重率为(0.79±0.13)%,PLLA质量分数为40%时支架降解失重率为(1.32±0.33)%,PLLA质量分数为50%时支架降解失重率为(1.48±0.88)%。随复合支架降解至第10周,复合支架降解速率随PLLA质量分数的提高而加快,第10周时,PLLA质量分数为30%时降解失重率为(5.04±0.53)%,PLLA质量分数为40%时降解失重率为(6.91±0.73)%,当PLLA质量分数为50%时,支架的降解失重率较第8周提高1.9倍,支架的降解失重率达到最大,为(14.22±1.23)%,这是因为体外降解主要为水解反应,而PLLA中含有大量的末端基团(羟基和羧基),其水解断裂速度是自由链断裂速度的近十倍,随着PLLA质量分数增大,大分子链水解形成小分子链,末端基团增多,则加快了支架的体外降解速率[13]。体外降解是体内降解的初步反映,根据降解失重率可以看出,质量分数为50%的PLLA复合支架在体外降解最快,可以有效减少新骨生成过程中,因支架应力集中而发生的偏移现象,是三组复合支架中可回植动物体内较好的选择。图8为复合支架降解过程中溶液的pH值,血液中稳定的pH值是维持细胞各项生命机理活动的重要指标,正常人体血液呈碱性,pH值为7.35~7.45,血液pH值过低会引起酸中毒,过高会引起碱中毒。从图中可以看出,复合支架在前10周的降解过程中pH值大致稳定在7.2~7.5之间,PLLA质量分数为30%时,pH值波动较大。PLLA质量分数为40%和50%时,pH值相对稳定。此外,质量分数为50%的PLLA复合支架在有较大的降解速率过程中,也能维持一定pH值的稳定,没有产生较大的pH值波动,这可能是因为复合支架中PLLA与HA是按照1∶1配比混合制备,PLLA酸性的降解产物与HA碱性的降解产物发生了中和反应,故pH值没有明显的变化。
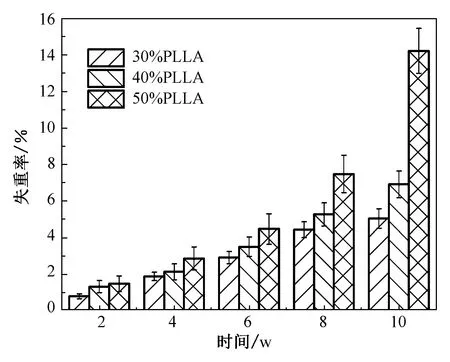
图7 不同质量分数PLLA/HA复合支架降解率Fig.7 Degradation rate of PLLA/HA composite stent with different mass fraction
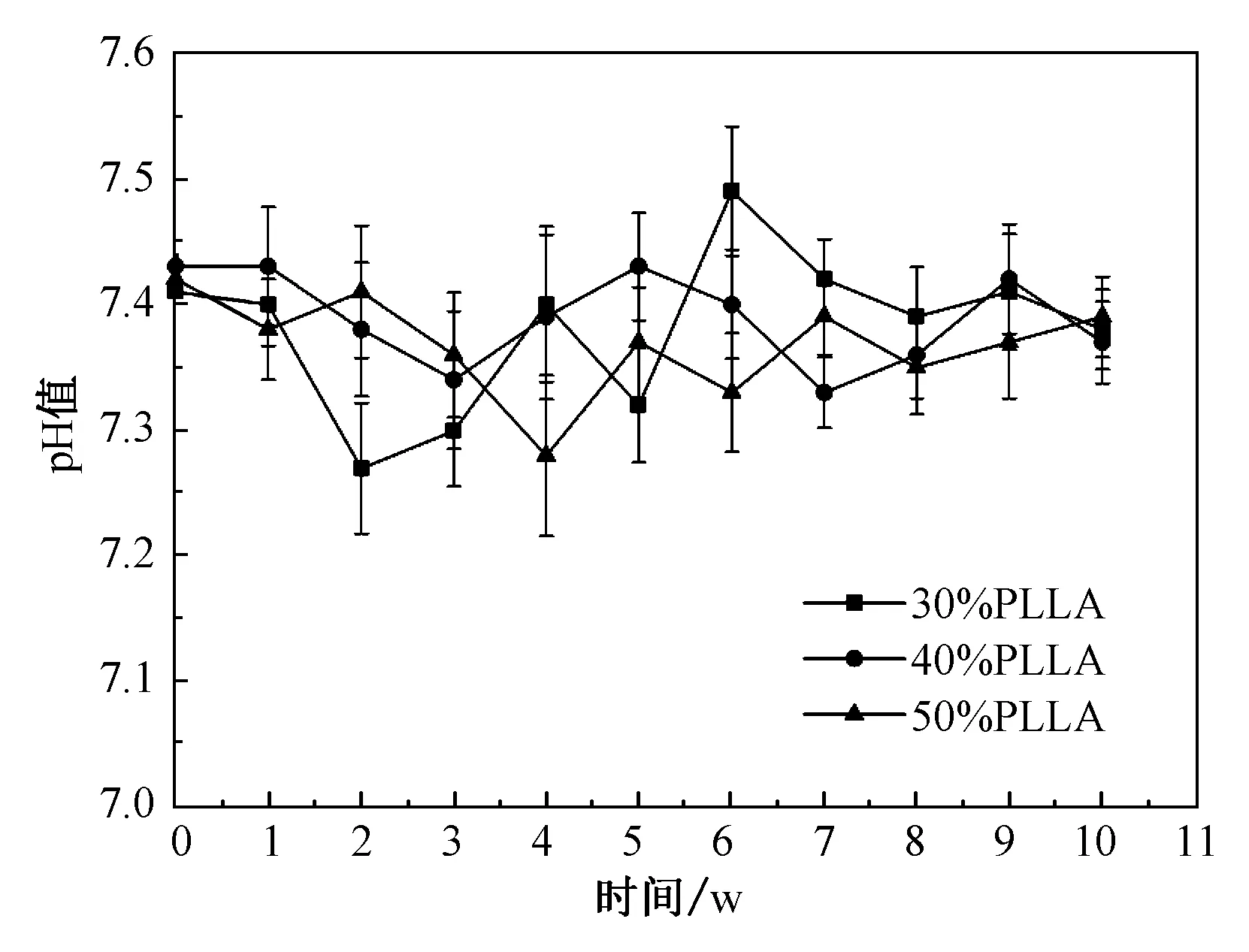
图8 pH值随降解时间变化曲线Fig.8 pH curve with degradation time
2.6 细胞毒性实验结果
通过CCK-8体外细胞毒性实验验证复合材料的安全性,将兔子成骨细胞与不同质量分数PLLA复合支架材料进行CCK-8试剂检测并计算细胞相对增殖率。结果如图9成骨细胞培养不同时间吸光度值显示,随着培养时间的增加,各组细胞的吸光度值随之增加。其中对照组为仅含有成骨细胞、CCK-8检测试剂而没有支架和浸提液的吸光度值。将测得吸光度值代入式(1)求得3组复合支架5 d后的细胞相对增殖率分别为:85.8%、83.7%、82.5%。根据ISO 10993-5—2009医疗器械生物学标准评价体外细胞毒性试验[14],试样的细胞相对增殖率大于70%可认为无毒,则3组复合支架材料均无毒副作用,可以进行动物体内的回植实验,具有良好的生物安全性。

图9 成骨细胞培养不同时间吸光度值Fig.9 The absorbance value of osteoblasts culture at different time
3 结论
本文采用挤出式3D打印技术,以PLLA和HA作为复合支架主体材料,制备出不同质量分数的PLLA/HA复合多孔支架。通过力学性能、接触角测试、降解性能以及生物安全性实验分析得出,复合支架的抗压强度随PLLA质量分数的提高而增强,当PLLA质量分数达到50%时,抗压强度及抗变形能力达到最大。接触角测试中显示接触角角度随着PLLA质量分数的提高而减小,即增强材料表面的亲水性。FTIR图谱与SEM结合分析得出,PLLA与HA是通过物理作用结合,且支架材料之间的结合能力与PLLA质量分数成正比关系,且PLLA质量分数达到50%时,材料结合能力最大。体外降解实验结果表明,通过3D打印制备出的PLLA/HA复合多孔骨支架的降解速率可调且与支架中PLLA的含量呈正比,50% PLLA复合支架降解速率最快,pH值较为稳定,且通过细胞毒实验表明该组复合支架满足生物安全性要求。下一步研究中,将50%的PLLA/HA复合支架植入生物体内,对材料内部细胞增殖黏附状况、材料降解行为及规律进行探究。
